柯萨奇病毒B组2型SYBR Green I RT-PCR检测方法的建立*
杨亚平,段素琴,杨凤梅,李艳艳,刘权,刘雨,赵远,马绍辉,和占龙
(中国医学科学院 &北京协和医学院 医学生物学研究所,云南 昆明 650118)
手足口病(hand,foot and mouth disease,HFMD)是一类由人肠道病毒(human enterovirus,HEV)感染引起的流行性传染病,多发生于5岁以下婴幼儿,可引起严重的中枢神经系统损伤和心肺衰竭等症状[1-2],2008年5月HFMD被纳入我国法定报告的丙类传染病[3]。近年来,HFMD引起的病例呈高发态势,严重危害婴幼儿健康和生命安全,给家庭带来沉重的疾病和经济负担[4]。目前,我国对HFMD的监测主要集中在肠道病毒71型(enterovirus A71,EVA71)、柯萨奇病毒A组16型(coxsackievirus A16,CVA16)、柯萨奇病毒A组10型(coxsackievirus A10,CVA10)和柯萨奇病毒A组6型(coxsackievirus A6,CVA6),对其他肠道病毒的分型鉴定尚不多,但近年来其他肠道病毒比例有所升高[5];此外,引起HFMD的病原谱构成呈多样化和复杂化[6]。柯萨奇病毒B组2型(coxsackievirus B2,CVB2)属于小RNA病毒科肠道病毒属B组[7]。流行病学调查显示,CVB2是引起儿童HFMD的病原体之一[8],CVB2还会引起心肌炎和无菌性脑膜炎[9-10],严重者可导致多器官感染[11],尤其是病毒性心肌炎常见的原因[12-13]。目前,对于病毒性心肌炎的临床诊断,主要依据临床症状、生化检查和心电图[14-15],但由于病毒性心肌炎发病初期症状不典型,出现临床症状时往往已经累及心肌,引起心肌不可逆转的损伤,严重危害健康[16]。由于目前有关CVB2检测方法的报道甚少,为了加强对CVB2引起的HFMD的监测及预防,因此本研究拟建立检测CVB2的SYBR Green I逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)方法,为CVB2的快速诊断和流行病学调查提供快捷、有效的分子检测手段。
1 材料与方法
1.1材料
1.1.1病毒 CVB2(RW41-2/YN/CHN/2012)、CVA6及CVA10病毒由中国医学科学院医学生物学研究所遗传室马绍辉课题组惠赠。
1.1.2主要试剂和仪器 JM109感受态细胞、pMDTM19-T Vector Cloning 、PrimeScriptTMOne Step RT-PCR Kit Ver.2、AxyPrep DNA Gel Recovery Kit、in vitro Transcription T7 Kit、One Step TB Green®PrimeScriptTMPLUS RT-PCR Kit及DNA A-Tailing Kit 均购自大连宝生物工程有限公司,TIANpure Midi Plasmid Kit购自天根生物有限公司,C1000型 PCR 仪、C1000 TouchTM Thermal Cycler实时荧光定量PCR仪及凝胶成像自动分析仪均购自美国BIO-RAD公司。
1.2方法
1.2.1引物设计与合成 利用GenBank中CVB2毒株(RW41-2/YN/CHN/2012)的病毒衣壳蛋白1(virus protein 1,VP1)基因序列,通过MEGA7.0软件对本毒株和GenBank中其他CVB2基因序列比对,之后利用Primer5.0软件设计引物(表1) ,由上海生工生物工程(股份)公司合成。
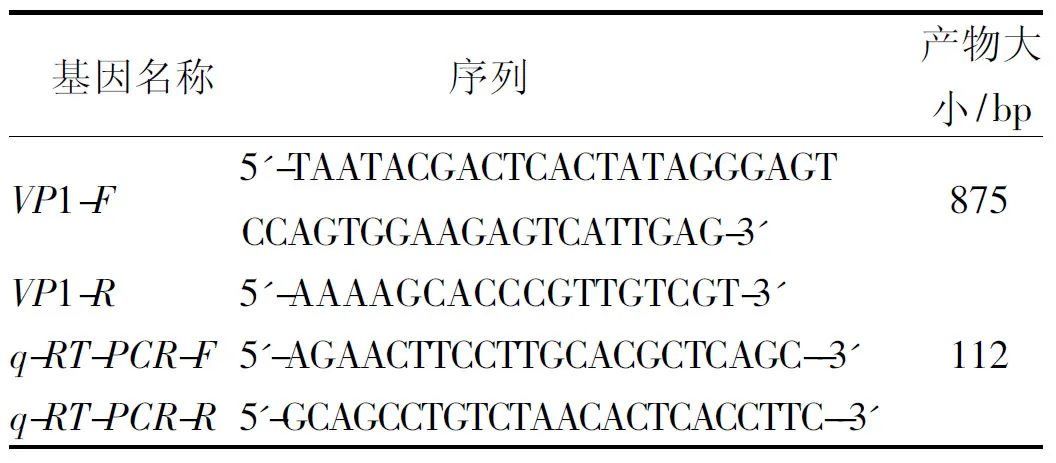
表1 引物序列Tab.1 Primer sequence
1.2.2制备标准品 用Trizol法提取病毒RNA,采用RT-PCR扩增的方法,用PCR引物VP1-F和VP1-R特异性扩增875 bp的CVB2 DNA片段;用AxyPrep DNA Gel Recovery Kit纯化PCR产物,利用DNA A-Tailing试剂盒和pMDTM19-T Vector Cloning试剂盒对纯化后的PCR产物进行末端加A与载体连接,形成T-A连接产物;将连接产物转化至JM109感受态细胞,用蓝白斑试验筛选重组质粒,挑取白色菌落转接至含有氨苄的LB培养液中,37 ℃、200 r/min。酶切产物用1%琼脂糖凝胶电泳,切下含有目的片段的3 572 bp琼脂糖凝胶,用AxyPrep DNA Gel Recovery Kit纯化后进行体外转录,体外转录用In vitro Transcription T7 Kit体外转录获得模板RNA。于室温下采用20 μL体系:10×缓冲液2 μL,腺嘌呤核糖核苷三磷酸(adenine ribonucleoside triphosphate,ATP)、鸟嘌呤核糖核苷三磷酸(guanine ribonucleoside triphosphate,GTP)、胞嘧啶核糖核苷三磷酸(cytosine ribonucleoside triphosphate,CTP)及尿嘧啶核糖核苷三磷酸(uracil ribonucleoside triphosphate,UTP)各2 μL,T7 RNA Polymerase 0.5 μL,核酸酶抑制剂2 μL,线性化质粒50 ng,去离子水补足至20 μL,37 ℃、3 h,转录产物加RNase free DNase I(1 U/L)0.2 L,37 ℃、30 min,用苯酚/氯仿抽提、异丙醇沉淀转录RNA,采用紫外分光光度计测定RNA浓度,计算标准品的拷贝数[17]。
1.2.3RT-PCR反应体系优化及检测方法评价 (1)优化反应体系,在相同模板量与反应体系中,采用矩阵法优化引物浓度,即以无引物二聚体产生、背景噪音小、荧光信号强等为判断标准,确定引物的最佳浓度;(2)建立标准曲线,以10倍梯度稀释CVB2病毒VP1重组质粒的体外转录标准品,取浓度102~109拷贝/μL标准品稀释液8个梯度,进行SYBR Green I RT-PCR反应,同时设立阴性对照,制作标准曲线;(3)特异性检测,利用优化的SYBR Green I RT-PCR检测体系对CVB2、CVA6、CVA10、CVA16及EV71的病毒核酸进行检测,评价方法的特异性;(4)灵敏性检测,将CVB2的标准品按10倍梯度稀释(100~109拷贝/μL),使用建立的SYBR Green I RT- PCR方法进行检测,评价其对病毒核酸检测的灵敏性;(5)重复性检测,分别制备不同浓度梯度的标准品(103、106及109拷贝/μL),同时进行SYBR Green I RT-PCR,每个标准品做3个重复,观察组内重复性;对上述不同浓度的标准品分别做独立的SYBR Green I RT-PCR检测,同样做3个重复,观察组间重复性。
1.3统计学分析
2 结果
2.1CVB2特异性片段VP1的扩增
CVB2扩增产物经1.2%琼脂糖凝胶电泳检测,700~1 000 bp见一条特异性条带,大小与预期一致,见图1A;重组质粒pMD19-T-CVB2经Xbal酶切后,3 572 bp出现一条清晰的条带,与预期相符,见图1B;用测定的重组质粒序列与GeneBank数据库中的CVB2株(RW41-2/YN/CHN/2012)的基因序列进行序列比对,同源性为99.77%。
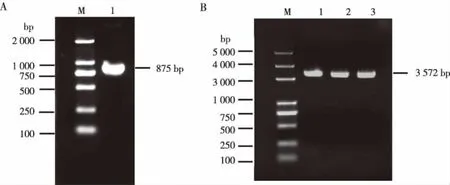
注:A为CVB2的VP1片段,B为酶切后的重组质粒;M表示DNA marker ,1~3表示3个重组质粒。图1 RT-PCR产物电泳及重组质粒的酶切产物电泳结果Fig.1 Electrophoresis results of RT-PCR products and recombinant plasmids after enzyme
2.2反应体系优化
经矩阵法优化后最佳引物终浓度为300 μmol/L,SYBR Green I RT-PCR反应体系及各试剂使用量为:2×One Step TB Green RT-PCR Buffer 10 μL、TaKaRa Ex Taq HS Mix 1.2 μL、PrimeScript PLUS RTase Mix 0.4 μL、RNase free dH2O 5.2 μL、q-RT-PCR-F/R(10 μmol/L)各0.6 μL、模板2 μL。反应条件为42 ℃、5 min,95 ℃、10 s,95 ℃、5 s,60 ℃、30 s,共40次循环。
2.3检测方法的评价
2.3.2特异性评价 该方法检测CVB2为阳性,CVA6、CVA10、CVA16及EV71无荧光扩增曲线,提示该方法特异性较强,见图2D。
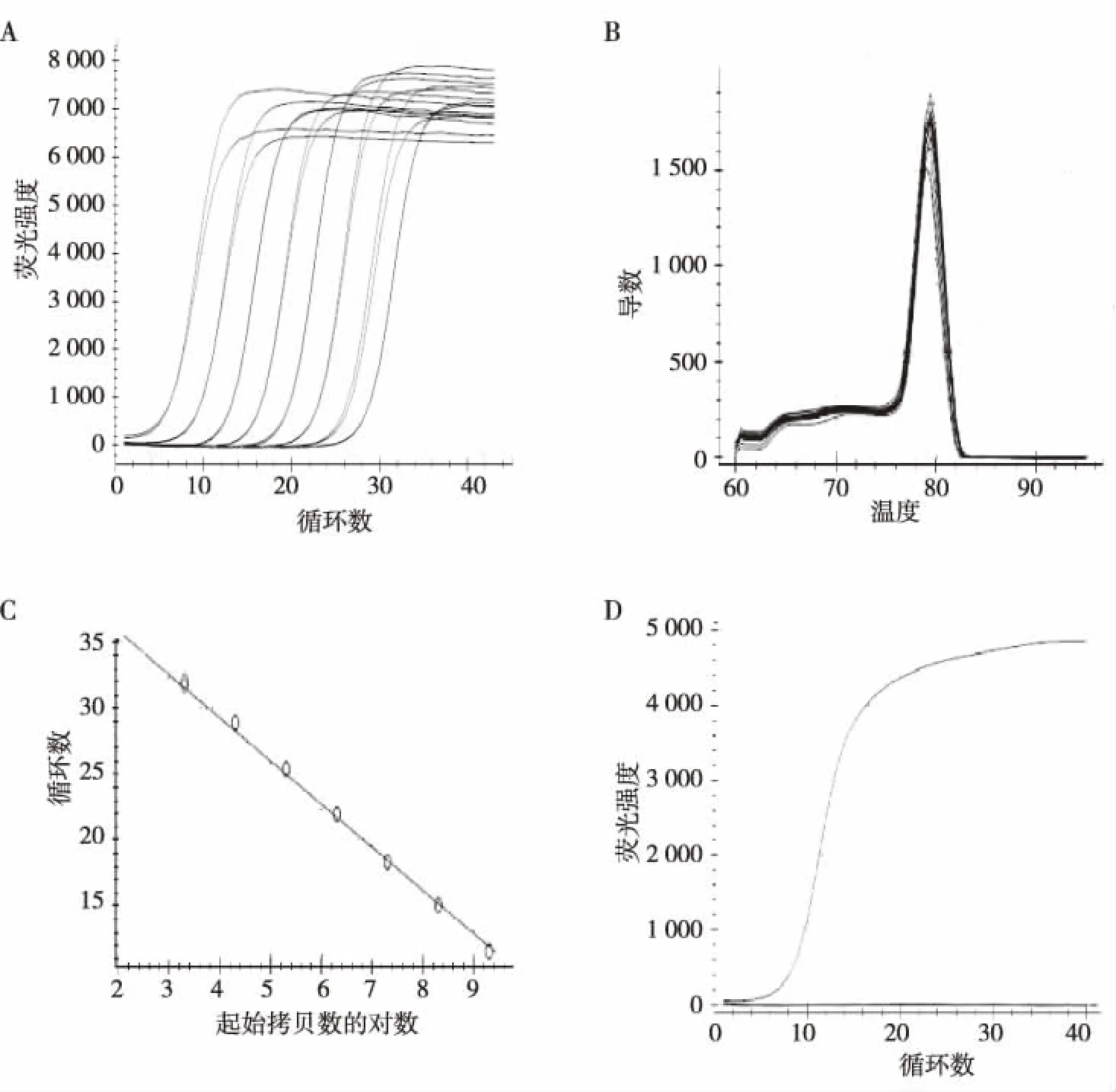
注:A为扩增曲线,B为熔解曲线,C为标准曲线,D为特异性检测。图2 SYBR Green I RT-PCR标准曲线的建立和特异性检测Fig.2 Establishment and specific detection of SYBR Green I RT-PCR standard curve
2.3.3灵敏性评价 该方法检测标准品在102~109拷贝/μL时,可出现较好的扩增曲线,建立的SYBR Green I RT-PCR方法的最低检测限为102拷贝/μL。
2.3.4重复性评价 对不同浓度梯度的标准品(103、106及109拷贝/μL)各进行3次组间和组内重复性实验,结果显示组内及组间CV均<1%,见表2。
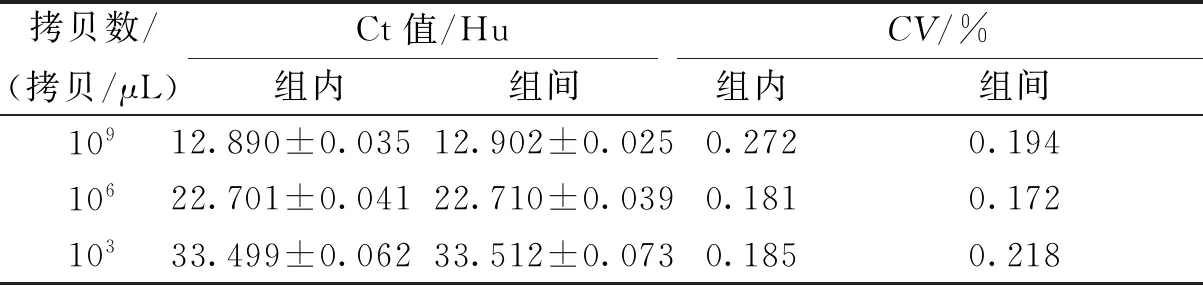
表2 SYBR Green I RT-PCR重复试验Tab.2 Repeated test results of SYBR Green I RT-PCR
3 讨论
近年来CVB2病毒感染引起手足口病的报道逐渐增多,建立一种简单快速、特异性强及灵敏性高的检测方法对于手足口病病原的检测和分型有重要意义[18]。HFMD相关病原体的检测方法有病毒分离和血清学诊断,前者是诊断病毒性疾病的金标准,但检测周期较长,敏感性较低;后者虽快速,但操作繁琐,费时费力且易出现假阳性、假阴性的问题[19]。目前,HFMD病原体常用检测技术有RT-PCR、实时荧光PCR探针法、环介导等温扩增技术和基于毛细管电泳芯片的激光诱导荧光检测系统[20-23]。但这些方法需用昂贵的荧光探针或需要引物和复杂的设备,而SYBR Green I 染料法不需要荧光探针,并且设备简单[24]。SYBR Green I 染料法中的染料与双链DNA结合后使荧光增强1 000倍左右,并能对PCR扩增产物进行连续的检测,通过溶解曲线判断引物是否有特异性,通过熔解温度有效区分特异性产物、非特异性产物及引物二聚体[25]。同时,该方法检测样品简便快捷,无需凝胶电泳且可实时观察结果,大大节省了时间[26]。吕莉琨等[27]应用该方法对柯萨奇病毒A组的3个基因型进行了分型鉴定。当然SYBR Green I RT-PCR检测方法自身也有不足之处:如无法检测扩增产物的大小,因各实验室所用的标准曲线的标准品不一致,可能会使结果缺乏可比性等,随着对检测方法的进一步优化,这些问题都将能得到改进[28]。
本研究以CVB2的保守基因片段作为RNA标准品制备的模板,以保证实验检测的准确性。在扩增合成VP1标准品RNA的DNA模板时,在用以扩增VP1的上游引物的5′端加了T7启动子,之后在体外对重组质粒的VP1片段进行转录。该方法从技术上避免了用载体合成RNA的缺点,同时利用试剂盒体外转录的RNA,可以避免交叉污染,减少生物安全风险。本研究构建的含有T7启动子的CVB2的重组质粒,经体外转录、精制获得的RNA用做标准品,将标准品梯度稀释后经优化后的反应体系获得的熔解曲线单一,曲线平稳且无非特异性溶解峰,可对CVB2实现特异性扩增。同时,利用标准品建立的标准曲线在102~109拷贝/μL范围内具有良好的线性关系,最低检测限度 102拷贝/μL,R2为0.996,扩增效率 102.2%;对EVA7、CVA16、CVA10和CVA6均无交叉反应,组间和组内的CV均小于1%。
综上所述,本实验建立的检测CVB2的SYBR Green I RT-PCR方法具有良好的灵敏性、特异性和重复性,可用于CVB2毒的快速检测和定量分析。

