IgA型PIGN患者的肾组织病理学特点和治疗效果及预后*
郭永力,穆永芳,管仁苹,滑丽美
(1.秦皇岛市第一医院 肾内科,河北 秦皇岛 066000;2.秦皇岛市第一医院 急诊科,河北 秦皇岛 066000;3.白求恩国际和平医院 营养科,河北 石家庄 050000)
报道显示,病毒、或细菌的感染与多种类型的肾小球肾炎的发病之间均存在着密切联系,如乙型、或丙型肝炎病毒可导致膜性肾小球肾炎、人乳头瘤病毒(human papillomavirus,HPV)和塌陷性肾小球疾病的发生有关[1-2]。感染后相关性肾小球肾炎(postinfectious glomerulonephritis,PIGN)是一类免疫介导的肾小球损伤疾病,主要是由宿主对肾脏外感染的反应所致,病因和金黄色葡萄球菌感染相关[3-4]。研究显示,在葡萄球菌感染合并肾小球肾炎的患者中,肾小球上存在免疫球蛋白(immunoglobulin,Ig)显性或(和)IgG、补体C3共显性的沉积物[3],由此以IgA沉积为主要表现的PIGN被首次提出,其特点是免疫荧光检查显示肾小球有IgA沉积,与IgA肾病十分相似,因此将其定义为IgA型PIGN[6]。临床上关于IgA型PIGN患者的肾组织病理特点、治疗效果及预后方面的相关报道仍较少,本研究通过回顾性分析2005年5月-2018年5月肾内科收治的100例IgA型PIGN病例资料,探讨其肾组织病理学特点、治疗效果及预后,现报道如下。
1 资料与方法
1.1资料、主要试剂与仪器
1.1.1资料 收集2005年5月-2018年5月某院肾内科收治的IgA型PIGN患者临床资料及治疗前B超引导下经皮肾活检组织,其中急性期22例、亚急性期78例。入选病例符合:(1)通过肾组织病理切片确诊为IgA型肾病,光镜检查显示有毛细血管内增生性病变,电镜检查显示伴有或不伴有上皮侧驼峰改变,免疫荧光检查可见系膜区有IgA、补体C3、或以IgA为主的免疫复合物沉积;(2)急性起病,尿常规检查有蛋白尿或血尿,并有高血压症状或一过性氮质血症;(3)近期有以呼吸道感染、或皮肤感染为主的前驱感染症状,感染部位分泌物实验室检查存在金黄色葡萄球感染;(4)年龄≥18岁;(5)临床资料完整。排除标准:(1)单纯IgA肾病;(2)狼疮性肾炎;(3)膜增生性肾小球肾炎;(4)合并其余重要脏器功能障碍。共纳入IgA型PIGN患者100例,男57例、女43例,年龄18~67岁、平均(40.83±7.69)岁。
1.1.2主要试剂与仪器 AHB-2-HL型奥林巴斯显微镜(日本奥林巴斯公司)、JEOL 1010型透射电镜(日本电子公司)、FS-113型免疫荧光检测仪(广州万孚生物技术股份有限公司)、RM2035型石蜡切片机(德国LEICA公司)和EG1140C型组织包埋机(德国LEICA公司);兔多抗IgG、鼠单抗一抗HBsAg、兔多抗一抗HBcAg及荧光标记二抗HBcAg(丹麦DAKO公司)。
1.2方法
1.2.1苏木精-伊红(hematoxylin eosin,HE)染色 肾组织病理切片分别由脱腊Harris苏木素染色8 min,多余染液使用清水冲洗干净,1%盐酸酒精分离,1%氨水返蓝数秒,反复清水冲洗,1%伊红染色5 min。
1.2.2过碘酸雪夫(schiff periodate,PAS)染色 病理切片由1%过碘酸水溶液染色12 min,蒸馏水冲洗碘酸,进行Schiff试剂反应16 min,所获得的反应物用自来水冲洗7~11 min,细胞核再次经苏木素复染,1%盐酸酒精分化处理。
1.2.3六胺银(periodic acid-silver metheramine,PASM)-Masson染色 病理切片分别使用1%过碘酸水溶液染色、5%铬酸水溶液浸泡30 min,清水冲洗40 min,铬酸使用1%亚硫酸钠浸泡20 min后去除,反复清水冲洗,置于50~70 ℃六胺银溶液,放置20 min后冲洗4次,分别经0.2%氯化金水溶液、5%硫代硫酸钠水浸泡3~4 min,清水、蒸馏水反复冲洗,再次HE复染。
1.2.4电镜检查 病理切片使用3.75%冷戊二醛固定,1%四氧化锇后固定,逐级丙酮脱水,常规树脂包埋、聚合,半薄切片使用甲苯胺蓝染色定位后,进行50 nm厚度切片,轴双重电子染色,电镜下观察结果。
1.2.5免疫荧光检查[7]检测IgG、IgA、IgM、C3和C1q染色,按照免疫荧光强度试验5级法分为0~4级。
1.2.6治疗方法及效果评价 所有患者均接受抗菌药物治疗,其中48例患者接受甲泼尼龙0.5 g/d静脉冲击治疗(持续3 d),2例给予环磷酰胺冲击治疗,11例接受临时血液透析治疗,余39例患者给予泼尼松45 mg/d口服治疗。治疗后1个月随访判断治疗效果。评价标准[8]:肾功能恢复正常,24 h尿蛋白定量<0.2 g,尿红细胞含量<3个/HP,判断为完全缓解;肾功能部分改善,24 h尿蛋白定量0.2~1 g,判断为基本缓解;肾功能和治疗前比较无明显改变,未满足完全缓解、基本缓解标准,判断为无效。
1.3统计学分析
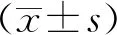
2 结果
2.1光镜检查
光学显微镜观察结果显示,急性期IgA型PIGN可见弥漫性增生性肾小球肾炎,这种变化在肾小球毛细血管内比系膜区多,有中性粒细胞渗出;亚急性期IgA型PIGN主要特征表现为系膜细胞增生,每个肾小球中中性粒细胞≤5;HE染色显示,急性期上皮侧嗜复红物较为明显,亚急性期间质纤维化较为明显;PAS染色结果显示,急性期间质纤维化较为明显,亚急性期间质水肿较为明显;PASM染色显示,急性期间质炎症细胞浸润较为明显,亚急性期刷状缘脱落较为明显;Masson染色显示,急性期新月体较为明显,亚急性期球型硬化较为明显;急性期和亚急性期IgA型PIGN活检组织上皮侧嗜复红物、间质纤维化、间质炎症细胞浸润及间质水肿阳性检出结果比较,差异有统计学意义(P<0.05)。见表1、图1。

表1 急性期和亚急性期IgA型PIGN患者光镜结果Tab.1 The comparison of light microscopic results among the patients with IgA PIGN in acute and subacute stage
2.2电镜检查
电镜检查显示有83例患者的组织切片可见巨大上皮下沉积物(驼峰),急性期患者表现更加明显,且所有病理组织均至少有5个膜内或皮下沉积物;在亚急性期患者组织切片上皮下沉积物显示广泛或局部吸收,主要表现为电子密度、微泡的损失和(或)在沉积物中有膜样结构表现。见图2。
2.3免疫荧光检查
免疫荧光结果显示,在系膜区、外周毛细血管区存在颗粒状IgA和C3染色,IgG染色强度弱于IgA、C3,强于IgM、C1q,差异均有统计学意义(P<0.05)。见表2。
2.4患者治疗效果及预后的单因素和多因素分析
治疗后1个月,IgA型PIGN患者中完全缓解23例、部分缓解54例和无效23例,其中有4例患者治疗无效死亡,治疗总缓解率为77.00%;单因素分析显示,治疗缓解组和未缓解组在不同年龄、有无基础疾病、血尿、间质纤维化比较中,差异有统计学意义(P<0.05);多因素Logistic回归分析显示,年龄≥60岁、合并基础疾病、血尿及间质纤维化均是影响IgA型PIGN患者预后的危险因素(P<0.05)。见表3、表4。

图1 急性期和亚急性期IgA型PIGN患者肾组织学变化(100×)Fig.1 The comparison of renal histologic change among the patients with IgA PIGN in acute and subacute stage(100×)
急性期 亚急性期图2 急性期和亚急性期IgA型PIGN患者电镜检查结果(2 500×)Fig.2 The results of electron microscopy among the patients with IgA PIGN in acute and subacute stage(2 500×)
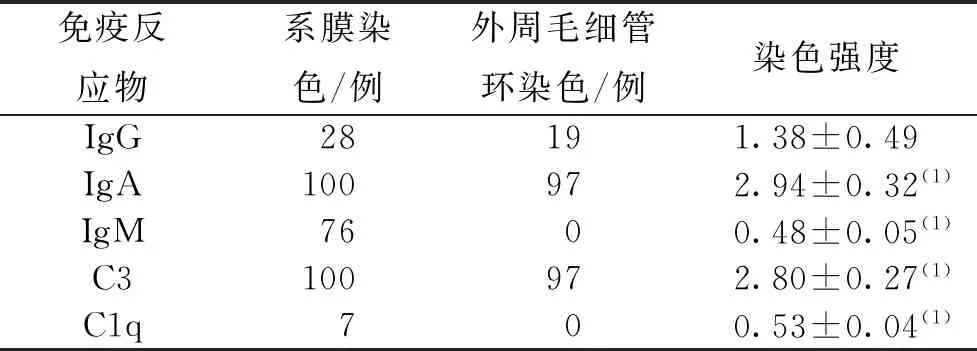
表2 IgA型PIGN患者免疫荧光染色结果Tab.2 The results of immunofluorescence staining in the patients with IgA PIGN
注:(1)与IgG比较,P<0.05。
3 讨论
关于IgA型PIGN目前仍未有统一的诊断标准,根据既往的研究总结,除需有典型的血尿、水肿、高血压及一过性肾功能衰退等临床症状之外,患者还需有金黄色葡萄球菌感染病史,甚至活检组织确诊,包括光镜检查下肾小球中有中性粒细胞浸润,电镜检查下伴或不伴上皮侧驼峰改变,免疫荧光检查可见系膜区有IgA、C3、或以IgA为主的免疫复合物沉积等内容[9-10]。本研究根据上述结论,纳入IgA型PIGN患者的肾组织进行研究,光镜结果显示急性期患者有肾小球中性粒细胞浸润,亚急性期患者虽有毛细血管内皮细胞、系膜细胞增生情况,但中心粒细胞明显减少;且急性期活检组织中肾小球毛细血管内比系膜区多,有肾小球中性粒细胞渗出,分析可能是由于在急性期患者中,肾小球毛细血管增生情况较重,并可能进一步促进炎症细胞浸润,破坏肾间质、肾小管等,造成间质纤维化[10-11]。此外,电镜结果显示大部分巨大上皮下沉积物(驼峰),其中急性期患者表现更加明显。在免疫荧光检查中显示,所有活检组织均显示在系膜区、外周毛细血管区存在颗粒状IgA、C3染色,IgG染色强度弱于IgA和C3,强于IgM、C1q,差异有统计学意义(P<0.05),其中仅有少数患者存在C1q系膜染色,且染色强度较低。

表3 IgA型PIGN患者预后的单因素分析[n(%)]Tab.3 Univariate analysis of prognosis in the patients with IgA PIGN [n(%)]

表4 IgA型PIGN患者预后的Logistic多因素分析Tab.4 Multivariate Logistic analysis of prognosis in the patients with IgA PIGN
临床上针对IgA型PIGN的治疗建议仍选择抗生素为主[12-13],但某些情况下可给予类固醇激素的使用,因类固醇的使用方法和疗效方面仍不明确,若使用不当也会增加复发风险,因此临床研究建议使用短疗程冲击治疗和口服类固醇即可[14-15]。本研究在针对IgA型PIGN的治疗中主要使用甲泼尼龙或环磷酰胺冲击、口服泼尼松及血液透析治疗,结果显示总缓解率为77.00%,预后较好。IgA肾病感染后出现的肾小球肾炎是一种自限性疾病,但在成年患者中其预后相对较差,导致该情况出现的原因与急性发病后肾组织出现的病理改变情况存在一定的相关性。根据相关的研究结果显示,肾活检光镜下主要表现为系膜细胞与弥漫内皮增生以及肾小球炎细胞浸润等[16-17]。该类毛细血管出现的内增生情况能够导致毛细血管出现拌腔堵塞的情况,进而诱发肾功能不全,同时炎症细胞在浸润的过程中会导致肾小管以及肾间质出现进一步的损伤[18-19]。
此外,本研究通过分析影响IgA型PIGN患者的预后,结果显示,年龄≥60岁、合并基础疾病、血尿及间质纤维化的患者中,治疗缓解率较低,可能是由于在年龄越大、基础疾病较多的患者中,机体各器官功能处于逐渐衰退的状态,抗感染能力也明显降低[20-21];有血尿、间质纤维化患者中,本身病情更重,肾功能损伤程度也更高,影响治疗效果和预后[22-23]。因此在今后的临床上,对此类患者给予治疗方案的同时,需积极控制基础疾病,并针对性给予降压、利尿及保护肾功能,此后也仍需进一步分析不同治疗方案对IgA型PIGN患者的疗效差异,以期为临床治疗提供更可靠的参考依据。
综上所述,IgA型PIGN的肾组织病理学表现多样,主要表现为弥漫性增生性病变或系膜细胞增生病变,伴或不伴上皮侧驼峰改变,系膜区有IgA、C3沉积,在年龄越大、合并基础疾病、血尿、间质纤维化患者中,治疗效果较差。

