贵州产灯盏细辛组织培养快速繁殖体系的建立*
张洁,毛春燕,刘利利,曾丽娜,刘红美
(贵州医科大学 医药生物技术工程研究中心 &生物与医学工程重点实验室,贵州 贵阳 550025;贵州医科大学 生物与工程学院 生物技术教研室,贵州 贵阳 550025)
灯盏细辛[Erigeronbreviscapus(Vant.)Hand.-Mazz.]又名灯盏花,菊科飞蓬属,属多年生草本植物,主要分布于云南、贵州和四川等省[1]。灯盏细辛亦是贵州民间及少数民族地区常用药材[2],被收载于2015年版《中国药典》[3]、《贵州中药资源》[4]和《贵州省中药材、民族药质量标准》[5],具有活血通络止痛、祛风散寒功能,临床上主要用于缺血性心脑血管病的治疗[6-8],同时还可用于风湿、老年性痴呆、肾衰和糖尿病等疾病的治疗[9-11],因此药材市场需求量大。由于过度采集挖掘,野生灯盏细辛已逐渐枯竭。植物组织培养技术具有繁殖快、周期短、不受外界因素限制和易管理等优势,是保护野生资源和解决药材供求矛盾的有效措施[12]。目前,在灯盏细辛组织培养研究方面,学者们对不同外植体诱导效果、愈伤诱导影响因素以及快繁体系建立等方面进行了研究[13-18],但这些研究报道均为云南产区灯盏细辛,且在培养基和激素配比的种类、浓度都有所差异,贵州产区灯盏细辛组织培养快速繁殖的相关研究还未见报道。贵州省亦是灯盏细辛的重要核心产区之一[1,19],且灯盏细辛药材的有效药用成分含量高,质量优良[20-23]。因此,本研究通过对贵州产区的灯盏细辛种子进行无菌播种、获取无菌苗后,采用不同激素配比的培养基对灯盏细辛离体培养过程中愈伤组织诱导、不定芽形成与增殖、壮苗生根移栽等的影响进行了系统研究,以期为贵州优质灯盏细辛种苗的快速繁殖提供技术支撑。
1 材料与方法
1.1材料
1.1.1种子 从贵州省六盘水地区野外采集的灯盏细辛种子,由贵州医科大学生物技术教研室刘红美教授鉴定。
1.1.2主要试剂和仪器 配制 Murashige&Skoog (MS)或1/2 MS培养基的化学试剂:琼脂、6-苄基腺嘌呤(6-benzyladenine,6-BA)、奈乙酸(α-naphthalene acetic acid,NAA)、吲哚丁酸(indole-3-butyric acid,IBA)、甘氨基、肌醇、烟酸、维生素B1、维生素B6及蔗糖均购于北京索莱宝科技有限公司,硝酸铵、硝酸钾、氯化钙、硫酸锰、磷酸二氢钾、硫酸锌、硼酸、碘化钾、钼酸钠、硫酸铜、氯化钴、乙二胺四乙酸二钠及硫酸亚铁均购于天津市致远化学试剂有限公司;LDZM-60L立式压力蒸汽灭菌器购自上海申安医疗器械厂,SW-CJ-1FD 型超净工作台购自苏州安泰空气技术公司。
1.2方法
1.2.1培养基及培养条件 以MS和1/2MS为基本培养基,添加不同浓度的激素(6-BA、NAA、IBA),具体浓度及培养基配方见表1,所有培养基添加3%蔗糖和0.9%琼脂,pH 6.0~6.1,高压灭菌条件121 ℃、25 min。培养条件为(25±2)℃、光照时间13 h/d,光照强度1 200 lx。

表1 培养基编号和配方Tab.1 Medium number and formulations
注:空格表示没有加该材料。
1.2.2初代培养 将灯盏花种子用纱布包裹后扎好口,按常规冲洗干净后灭菌处理;用75%乙醇浸泡0.5 min,无菌水冲洗2次,3%次氯酸钠浸泡2 min,无菌水冲洗3次,3%次氯酸钠浸泡3 min,将种子接种到不含激素的1/2 MS培养基上进行初代培养以获取无菌苗。
1.2.3叶片和叶柄愈伤组织的诱导 将获得的生长健壮的无菌苗叶片切割成0.5 cm×0.5 cm,叶柄切成长1 cm的小段,分别平放接种到添加不同浓度的6-BA和NAA的A1~A9培养基中;每种培养基接种5瓶,每瓶接种3~5个外植体,重复3次;培养10 d后观察愈伤组织的诱导生长情况,用“+”表示出现愈伤组织的体积,“+”越多表示愈伤体积越大。
1.2.4不定芽的分化与增殖 将愈伤组织诱导分化的丛生芽切成单株接种于添加不同浓度的6-BA和NAA的A1-A9培养基中,接种要求同1.2.3,培养20 d后对不定芽的分化增殖与生长情况进行观察统计。
1.2.5生根移栽 将培养后高1.5~2.0 cm的无根小苗转接到添加不同浓度的NAA和IBA的B1~B5培养基中诱导生根,接种要求同1.2.3,待组织培养苗根系生成、并长至合适长度后后进行炼苗移栽,室内放置2 d,去封口膜,轻轻洗净苗根部培养基,移栽到高温灭菌后的泥土与珍珠岩1 ∶1混合的基质中。
1.3统计学分析

2 结果
2.1初代培养获取无菌苗
采用2次3%次氯酸钠的灭菌方法对种子进行灭菌,污染率为10%;接种6 d左右,种子开始萌发,萌发率可达65%。
2.2叶柄愈伤组织的诱导与分化
叶柄诱导愈伤组织结果表明A3培养基愈伤诱导时间较短,10~15 d就出现愈伤组织,20 d后愈伤组织的体积较大,且新增芽点多,有利于下一步芽的诱导分化,故选择A3培养基(MS+1.0 mg/L 6-BA+0.3 mg/L NAA)为最适宜叶柄愈伤诱导的培养基。见表2。
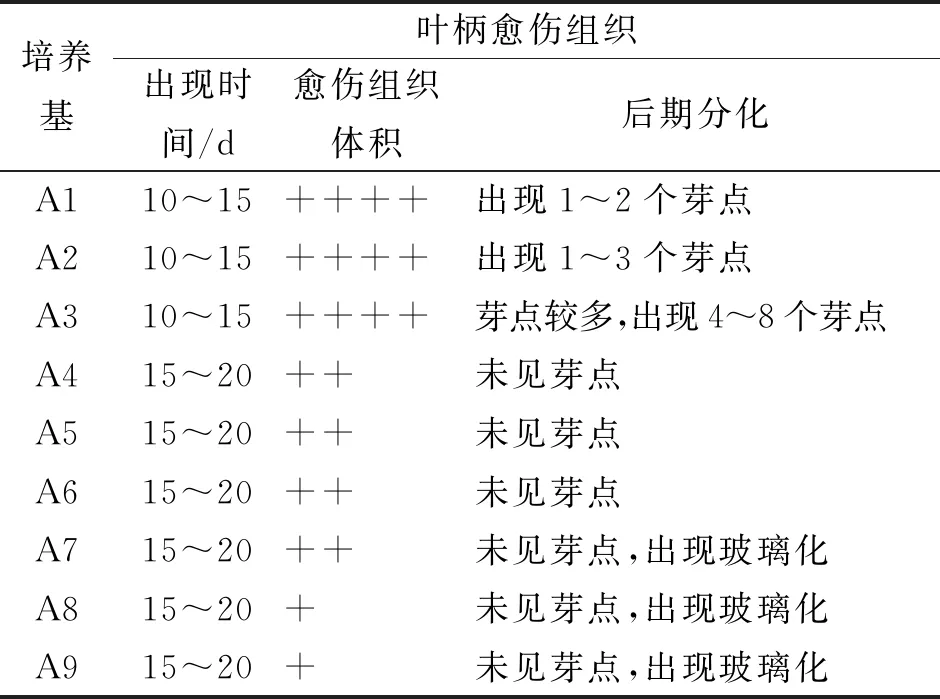
表2 不同培养基对叶柄愈伤组织诱导的影响Tab.2 Effect of different medium on callus inducement of E.breviscapus petiole
注:+表示出现愈伤组织的体积,越多表示愈伤体积越大。

10 d 20 d图1 3号培养基中不同时间叶柄愈伤组织诱导Fig.1 The effect of No.3 medium on callus induction
2.3叶片愈伤组织的诱导与分化
叶片接种于培养基后,早期均出现膨大、卷曲,颜色由深绿变成浅绿;培养至第15天时仅A7培养基中叶片上出现较小的突起;培养至第20天时所有培养基中的叶片均逐渐发黄,A3、A4、A7、A8及A9培养基中出现较为少量的愈伤组织,结构较为致密;随着培养时间延长,愈伤组织增殖均不明显,无芽点出现,愈伤组织和叶片逐渐出现黄化、褐化。因此,叶片不适合作为外植体。
2.4不定芽的增殖
将A3号培养基中叶柄诱导的带丛生芽的愈伤切成小块或单株接种到A1~A9培养基中培养,20 d后不定芽的增殖结果表明A6培养基的增殖倍数相对较高,可达12倍,分化出的不定芽多,且无菌苗的生长状况也较好,不定芽较粗壮,叶片大,颜色深绿,无玻璃化现象。故 选择A6培养基(MS+2.0 mg/L 6-BA+0.3 mg/L NAA)为最佳分化增殖培养基。见表3、图2。
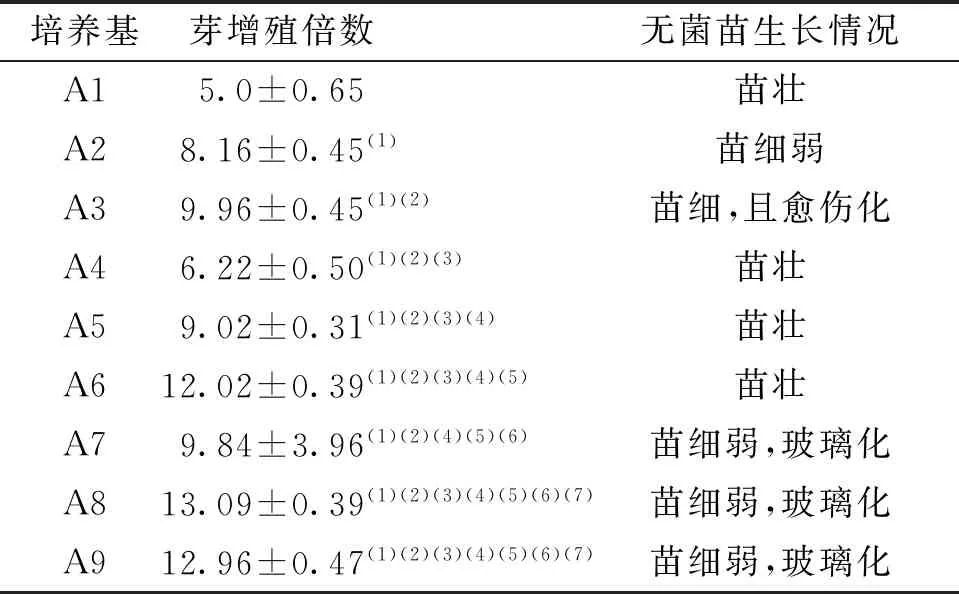
表3 不同培养基对组培苗增殖的影响Tab.3 The effects on the proliferation of tissue culture seedlings in the different mediums
注:(1)与A1比较,P<0.05;(2)与A2比较,P<0.05;(3)与A3比较,P<0.05;(4)与A4比较,P<0.05;(5)与A5比较,P<0.05;(6)与A6比较,P<0.05;(7)与A7比较,P<0.05。

图2 6号培养基中增殖的灯盏细辛组培苗Fig.2 Seedlings of E.breviscapus in the sixth medium
2.5生根培养
将增殖培养20 d无根小苗转接到B1~B5培养基中,10 d后观察生根情况。结果表明,灯盏细辛接种在不添加激素的MS培养基中时生根率可达74.44%,但生根数目较少,根较细长;降低培养基无机盐浓度,并添加生长素0.3 mg/L NAA和0.3mg/L IBA后生根率提高到89.58%,根生长较为粗壮;当NAA浓度增加到0.5 mg/L和IBA增加至0.8 mg/L时,不仅生根率达到至100%,且生根数目最多,根粗苗壮,故B5培养基(MS+2.0 mg/L 6-BA+0.3 mg/L NAA)生根效果最佳,为适宜生根的培养基;待灯盏细辛的根生长至3 cm左右时,即可进行炼苗移栽,成活率可在85%以上。见表4。

表4 不同培养基对灯盏细辛无菌苗生根的影响Tab.4 The effects on the rooting of aseptic seedlings in the different mediums
3 讨论
为了对保证野外采集种子的灭菌效果,同时增强种子对灭菌剂的耐受性,本研究采用了分开2次2%次氯酸钠的灭菌方法,灭菌效果较好,污染率低,同时60%的种子能够萌发,从而有效建立无菌体系,获取无菌苗。在植物组织培养快繁体系建立的过程中,激素的种类与配比对于愈伤组织诱导、器官分化、增殖、生根起着关键性作用[24]。在愈伤诱导实验中,本研究中选用了最常用的6-BA和NAA激素,采用不同的浓度配比,对叶柄进行愈伤诱导,结果表明的细胞分裂素6-BA为1.0 mg/L时,出现愈伤时间较早,体积也较大,其中又以与0.3 mg/L的生长素NAA的搭配效果最好,出现的芽点较多,非常有利于后期的分化增殖和植株再生。故筛选出的最适愈伤诱导培养基为MS+1.0 mg/L 6-BA+0.3 mg/L NAA。另一方面,不同外植体在植物组织培养中诱导愈伤的反应能力是有差异的[25]。实验中以灯盏细辛的叶片作为外植体时,愈伤诱导反应不佳,并出现褐化、黄化现象,故在该试验条件下,叶柄比叶片更适合做为诱导愈伤组织的外植体,这与刘成洪等[16]研究结果一致。
细胞分裂素6-BA对不定芽的增殖和分化有着较强的促进作用,但浓度过高时往往会增加再生芽畸形、玻璃化的概率[26-27]。本实验中NAA浓度一定时,随着6-BA浓度的升高,芽的增殖倍数明显增高,当6-BA升至3.0 mg/L时,分化的芽增多,增殖倍数最高可达13倍,但苗较细弱、容易出现玻璃化。因此,6-BA的适宜浓度为2.0 mg/L。同时,适量的生长素配合6-BA使用,不仅能够促进植株的生长也能提高芽的增殖与分化能力[28]。实验中6-BA为2.0 mg/L时,搭配0.3 mg/L的NAA,增殖倍数可达到12倍,无菌苗生长状态也良好,故此为分化增殖最适宜的浓度搭配。
生根实验结果表明,灯盏细辛组培苗的生根较为容易,在不添加激素的情况下,生根率就可达74.44%,只是根数目较少,根不够粗壮,不利于移栽。实验中,采用降低培养基无机盐浓度的1/2 MS培养基和添加生长素NAA和IBA,均有利于提高生根率和生根质量。随着NAA和IBA的浓度升高,都能够使生根率和生根数目随之增高,NAA浓度为0.5 mg/L、IBA为0.8 mg/L时,获得最佳生根效果,这与吴毅歆等[17]采用的激素配比结果一致。生根效果好的组培苗非常有利于提高后期的炼苗移栽的存活率,同时移栽初期也要注意盖塑料薄膜保湿,移栽后成活率在85%以上,可用于种植推广。
综上所述,本研究建立了适宜于贵州产区的灯盏细辛的组培快繁体系,从叶柄外植体诱到再生苗移栽大约只需要50~60 d,和常规人工栽培育苗需要80~90 d的周期相比,大大缩短了育苗周期,有利于快速、高效、低成本的为人工栽培提供大量品质优良的种苗,对于发展和推广贵州灯盏细辛中药材的规模化种植具有重要意义。

