水杨酸对NaCl胁迫樟子松抗氧化酶活性及MDA含量的影响
冯海华
(山西省林木育种研究中心,山西 太原 030031)
由于人们不恰当的施肥以及土壤管理方式,导致了很多地区土壤发生盐碱化,土壤肥力降低,使得树木幼苗生长缓慢甚至死亡[1]。目前我国盐碱地面积一直呈现出增加的变化,在很多地区成为了作物生产和林木育苗的限制因素[2]。樟子松是一种在山区造林和城市园林绿化中应用比较广泛的针叶树木之一,部分研究表明樟子松成年树具有一定的耐盐能力,但是幼苗耐盐能力较差,土壤的盐碱化严重影响了樟子松育苗和山地造林工作[3-4]。因此,研究提高樟子松苗木抗盐机制对指导育苗实践具有重要的现实意义。水杨酸是植物体内重要的抗逆信号分子,通过影响离子的跨膜运输影响植物的水分代谢活动,对改善植物耐盐性具有重要作用[5]。Horváth研究认为,水杨酸主要作为非生物胁迫的信号分子,通过改变植物生理代谢途径提高抗逆性[6];Ashraf认为水杨酸通过改变植物体内生理活性物质含量,提高植物耐盐性[7];Hayat研究认为,通过外源水杨酸同样可以提高植物耐盐性[8];Jayakannan认为,水杨酸提高植物耐盐性的机理是通过影响植物离子吸收和调节超氧阴离子代谢系统活性提高耐盐性[9];朱广龙[10]研究认为,外源水杨酸提高了高梁幼苗内的保护酶活性,有效缓解了盐胁迫对高梁幼苗的伤害。从前人的相关研究结果来看,水杨酸已经应用于多种作物耐盐研究中,但是目前尚未见到外源水杨酸在樟子松抗盐育苗中应用的相关报道。本文以此为契机,通过分析外源水杨酸对NaCl胁迫下樟子松抗氧化酶活性及MDA含量的影响规律,探讨水杨酸提高樟子松抗盐生理机制,为其育苗中进行抗盐化学调控提供理论依据。
1 材料与方法
1.1 试验材料
试验时间为2019年3~10月,试验地点为山西省林木育种研究中心实验苗圃内,试验所选樟子松为2a生实生苗。2017年3月于山西省林木育种研究中心试验田内在育苗钵中采用播种方式育苗,2017年6月,将生长发育正常的幼苗移栽至高32cm,口径30cm的塑料盆中。塑料盆中的营养土用腐殖土∶园土∶蛭石∶河沙按照 3∶2∶1∶1 的比例混合均匀配置而成。待缓苗结束后,将苗木放置于自然状态下生长,人工养护,防止出现旱涝灾害。2018年3月,将塑料盆按照长×宽为30cm×30cm距离摆放整齐,每盆浇灌300mL的Hoagland营养液,然后自然状态下生长1a。2019年2月末,选择长势一致的苗木搬运至苗圃空地上,按照株行距为30cm×40cm距离摆放整齐,然后进行盐胁迫和水杨酸处理。
1.2 试验设计
试验共设置4个处理,其中T1为对照:3月10日每株浇灌300mL的Hoagland 营养液,5~9月每月10~11日下午18:00每株喷施30mL蒸馏水;T2为NaCl胁迫处理:用Hoagland 营养液配置0.5%的NaCl溶液,3月10日每株浇灌300mL,5~9月每月10~11日下午18:00每株喷施30mL蒸馏水;T3为NaCl+SA处理:用Hoagland 营养液配置0.5%的NaCl溶液,3月10日每株浇灌300mL,5~9月每月10~11日下午18:00每株喷施30mL 1.0mmol/L的水杨酸;T4为 SA处理:3月 10日每株浇灌300mL的Hoagland 营养液,5~9月每月10~11日下午18:00每株喷施30mL 1.0mmol/L的水杨酸。按照试验设计土壤浇灌完苗木后,将其搬运至全日光遮雨棚中,夏季防止降雨影响。整个试验期间,为防止发生旱涝胁迫进行人工浇水,所有处理每次浇水量相同。每处理共20盆,3次重复,不同处理在遮雨棚中随机排列。
1.3 试验取样及测定项目
分别于5~9月每个月15日到防雨棚中取样,每处理随机选择3株樟子松苗木,将全部叶片摘取后放置于自封袋中,然后放在带有冰块的保温箱中,迅速带回实验室,冲洗干净后进行相关指标的测定。其中SOD活性测定采用NBT光化还原法[11],POD活性测定采用愈创木酚法[11],CAT活性测定采用紫外吸收法[11],MDA含量测定采用硫代巴比妥酸法[11]。每项指标测定3次,取平均值作为最后结果。
1.4 数据处理
数据处理以及图表制作使用Excel2010版软件,方差分析使用DPS7.05版软件。
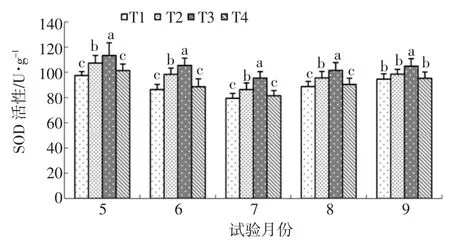
图1 水杨酸对NaCl胁迫下樟子松SOD活性的影响
2 结果与分析
2.1 水杨酸对NaCl胁迫下樟子松SOD活性的影响
由图1可知:5~8月,T2 SOD活性分别高于对照 9.88、11.95、7.00、6.80U/g,差异显著,说明 NaCl胁迫显著提高了樟子松叶片内SOD活性;9月T2仅高于对照3.92U/g,无显著差异,表明NaCl胁迫在9月对SOD活性影响不显著。5~9月,T3始终处于最高值,T3与T2相比分别提高了5.59%、7.19%、10.49%、6.22%、6.48%,差异显著,说明水杨酸可以有效提高生长季节NaCl胁迫下樟子松叶片内的SOD 活性;5~9 月 T3 分别高于 T1 15.88、19.03、16.07、12.74、10.30U/g,差异显著,说明水杨酸处理与T1相比同样显著提高了樟子松SOD活性。5~9月,T4分别高于 T1 处理 3.88、2.23、2.04、1.69、0.73U/g,无显著差异,说明水杨酸对SOD活性影响较小。
2.2 水杨酸对NaCl胁迫下樟子松POD活性的影响
由图2可知:樟子松POD活性随着试验时间的延长表现为先升高后降低的变化趋势,不同处理对POD活性的影响存在差异。整个试验期间,T3处理POD活性始终处于最高值,与对照相比分别提高了 112.84%、94.24%、36.67%、40.23%、33.03%,差异显著;5~9 月,T2 分别高于对照 5.14、6.72、5.73、4.83、4.00U/g,差异显著,说明 NaCl胁迫导致樟子松POD活性增加;T3分别比T2提高了53.86%、38.58%、16.25%、19.32%、13.75%,差异显著,说明水杨酸与单纯NaCl胁迫处理相比显著提高了樟子松叶片内的POD活性。5~9月,T4分别高于T1处理1.89、1.64、0.99、0.92U/g,无显著差异,说明单纯喷施水杨酸对POD活性影响较小。整个试验期间,T4均显著低于T3处理,说明在相同水杨酸处理下,NaCl胁迫显著提高了樟子松POD活性。

图2 水杨酸对NaCl胁迫下樟子松POD活性的影响
2.3 水杨酸对NaCl胁迫下樟子松CAT活性的影响
由图3可知:樟子松CAT活性在整个生长季节表现为先升高后降低的变化趋势,不同处理之间存在显著差异。5~9月,T2分别比对照提高了48.36%、39.28%、28.12%、22.55%、22.03%,差异显著,说明 Na-Cl胁迫会导致樟子松CAT活性显著升高;T3处理整个生长季节均处于最高值,与对照相比分别提高了120.70%、95.22%、55.41%、41.34%、46.28%,差异显著,T3分别高于 T2处理 48.76%、40.17%、21.30%、15.33%、19.87%,差异显著,说明水杨酸有利于NaCl胁迫下樟子松CAT活性显著升高;T4与对照无显著差异,说明水杨酸对樟子松CAT活性影响效果不明显。T4显著低于T3处理,说明在相同水杨酸处理条件下,NaCl胁迫仍然会显著提高樟子松CAT活性。
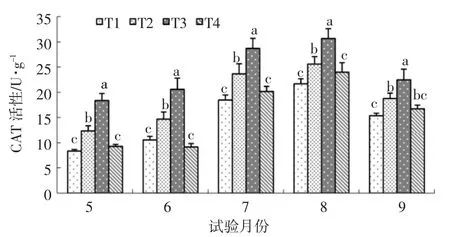
图3 水杨酸对NaCl胁迫下樟子松CAT活性的影响
2.4 水杨酸对NaCl胁迫下樟子松MDA含量的影响
由图4可知:5~9月,T2处理始终处于最高值,与对照相比分别提高了13.32%、15.67%、17.36%、35.69%、22.79%,差异显著,说明NaCl胁迫显著提高了樟子松叶片内MDA含量,也说明该浓度的Na-Cl使樟子松受到了一定的伤害。T3分别低于T2处理 4.95%、11.56%、9.32%、12.66%、9.30%,6~8月 T3与T2处理之间差异显著,说明水杨酸在这3个月份可以显著缓解NaCl胁迫导致的膜脂过氧化作用,同时5、9月两个处理之间无显著差异,说明水杨酸在这两个月份同样缓解了NaCl胁迫对樟子松的伤害,但是效果未达到显著水平。5~9月T3分别高于对照 5.21、1.21、2.92、5.83、4.87μmol/g,除 8 月份之外,两个处理之间无显著差异,说明T3樟子松MDA含量在5、6、7、9月与对照相比处于同一水平。T4与对照之间无显著差异,说明单纯喷施水杨酸并未对樟子松MDA含量产生显著影响。
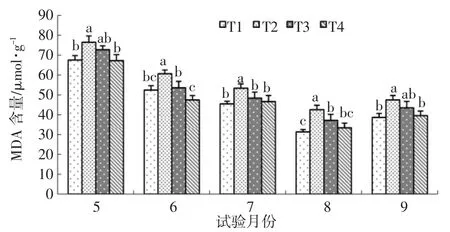
图4 水杨酸对NaCl胁迫下樟子松MDA含量的影响
3 讨论
NaCl胁迫下,植物体会产生较多的活性氧,包括超氧阴离子和过氧化氢,如果植物体不能及时清除便会导致膜系统受到伤害,进而影响植物正常代谢活动的进行[12]。为清除多余超氧阴离子的危害,植物体内保护酶活性会升高,从而提高和抗坏血酸-谷胱甘肽系统代谢能力,降低活性氧含量,维持植物体正常代谢活动的进行[13]。水杨酸与植物活性氧代谢有直接的关系,Horváth认为水杨酸主要通过两种方式清除植物体多余的活性氧,一是直接清除,二是通过提高保护酶活性如SOD、POD、CAT用于清除活性氧,从而会缓解植物盐胁迫下的伤害[6]。外源水杨酸的受体是植物体内的CAT,并且外源水杨酸又是CAT单电子的供体底物,所以适宜浓度的外源水杨酸可以显著提高植物体内CAT活性[14]。CAT活性的升高诱导了植物体内SOD、POD活性升高,加速了活性氧代谢效率,从而有利于植物体MDA含量降低[15]。从本试验研究结果来看,NaCl胁迫与对照相比显著提高了樟子松SOD、POD、CAT活性,这与范鑫[16]的研究结果相似,说明NaCl胁迫使樟子松细胞内产生了较多的有害物质,导致了活性氧清除系统显著升高,以缓解NaCl胁迫造成的伤害。NaCl+水杨酸与单纯NaCl胁迫处理相比提高了保护酶活性,这与WANG[17]的研究结果相似,说明外源水杨酸通过提高保护酶活性,促进了AsA-GSH代谢系统清除樟子松叶片内多余活性氧,从而缓解NaCl胁迫的伤害[18]。从单纯喷施外源水杨酸处理的保护酶活性变化上来看,水杨酸一定程度上提高了保护酶活性,但是差异不显著,这与Hasanuzzaman[19]的研究结果相似,说明水杨酸在不同环境下对植物保护酶活性的影响存在差异。水杨酸处理提高了樟子松保护酶系统活性和活性氧代谢能力,从而降低了NaCl胁迫对樟子松膜系统的伤害,有效的降低了MDA含量,这与熊雪[20]的研究结果相似,表明外源水杨酸对降低MDA含量,缓解樟子松NaCl胁迫具有显著作用。本项研究结果中清水+水杨酸处理与对照之间并未出现显著差异,分析原因可能与本试验中喷施的水杨酸浓度过高有关[5],后续研究中应深入分析不同浓度水杨酸对樟子松保护酶系统的影响规律。
4 结论
盐胁迫与对照相比会显著提高樟子松保护酶系统活性,同样也提高了叶片内MDA含量,使植物受到了一定的伤害;在盐胁迫基础上喷施水杨酸,提高了保护酶活性,降低了MDA含量,缓解了樟子松在盐胁迫下受到的伤害;外源水杨酸会提高非盐胁迫下保护酶活性,效果不明显。综合分析来看,1.0mmol/L的水杨酸可以有效提高NaCl胁迫下樟子松保护酶活性和缓解盐胁迫对植物体的伤害。

