铁营养水平对紫花苜蓿吸收镍的影响
/ 上海新金桥检测技术服务有限公司
0 引言
根据2014年环境保护部和国土资源部发布的《全国土壤污染状况调查公报》显示,八种重金属中点位超标率最高的和次高的分别是镉和镍,分别为7.0%和4.8%[1],镍含量排在第二位,已经成为不可忽视的污染土壤的重金属元素。植物修复技术是以植物忍耐和超积累某种或某些污染物的理论为基础,利用自然生长或遗传工程培育的植物,清除环境中污染物的环境污染治理技术[2]。铁是植物有氧呼吸酶的重要的组成物质,因此,铁参与植物的呼吸作用,是植物能量代谢的重要物质。缺铁会影响植物的生理活性,也影响养分的吸收[3]。保证植物的铁元素营养,有利于增强一些植物的抗病能力。紫花苜蓿不仅具有生长快、产草量高、利用年限长、再生性强、适口性强、营养丰富的特点,而且根系发达,根部生长的根瘤菌具有很强的固氮能力[4-5],能够改善土壤物理性状和养分状况[6]。研究表明通过调控铁营养水平,可以影响植物对其他金属的吸收。本研究的目的是研究铁营养水平对植物镍吸收能力的影响,为农艺调控措施提供一定的理论支持。
1 实验原理
1.1 缺铁诱导对紫花苜蓿吸收镍的影响
将植株缺铁培养一段时间后,再转移到含一定浓度硫酸镍的营养液中处理,分根和地上部分收获,以正常生长植株为对照。测定样品中镍含量,计算转运系数和植物富集系数。
1.2 不同铁营养水平对紫花苜蓿吸收镍的影响
将植株移入一定浓度的硫酸镍营养液中,进行不同浓度铁处理。培养10 d后分根和地上部分收获并测定样品中的镍含量。
1.3 缺铁时间对紫花苜蓿吸收镍的影响
将在完全培养液中生长的植株移入缺铁培养液中培养不同的天数后,移入一定浓度的NiSO4缺铁营养液再处理后,分根和地上部分收获并测定样品中的镍含量。
2 试剂和设备
试 剂:硝酸 镍 Ni(NO3)2、硝酸钙 Ca(NO3)2、氢氧化钠NaOH(浓度1 mol/L)、盐酸、磷酸二氢钠NaH2PO4、硫酸镁MgSO4、硫酸钾K2SO4、硝酸钾 KNO3、硫酸铵(NH4)2SO4、氯化钙 CaCl2、硼酸H3BO3、硫酸锰MnSO4、硫酸锌ZnSO4、硫酸铜CuSO4、钼酸钠Na2MO4、Fe-EDTA、硝酸HNO3、双氧水H2O2(浓度30%),以上试剂均为优级纯,国药集团化学试剂有限公司;紫花苜蓿,巨人201+Z,北京金种子公司。
主要设备:恒温培养箱(RXZ-300A)、电子天平(FA2004N)、电热鼓风干燥箱(DHG-9145A)、pH-902笔式防水型pH计、微波消解仪(SG-70卡入市单体消解罐)、小型控温加热板、火焰原子吸收分光光度计(GGX—600)、Ni空心阴极灯(北京有色金属研究总院)。
3 试验方法
3.1 营养液的配置
根据表1中试剂的浓度,用纯水将称量好的试剂完全溶解后,配置成A液~H液八种不同浓度的营养液[7]。
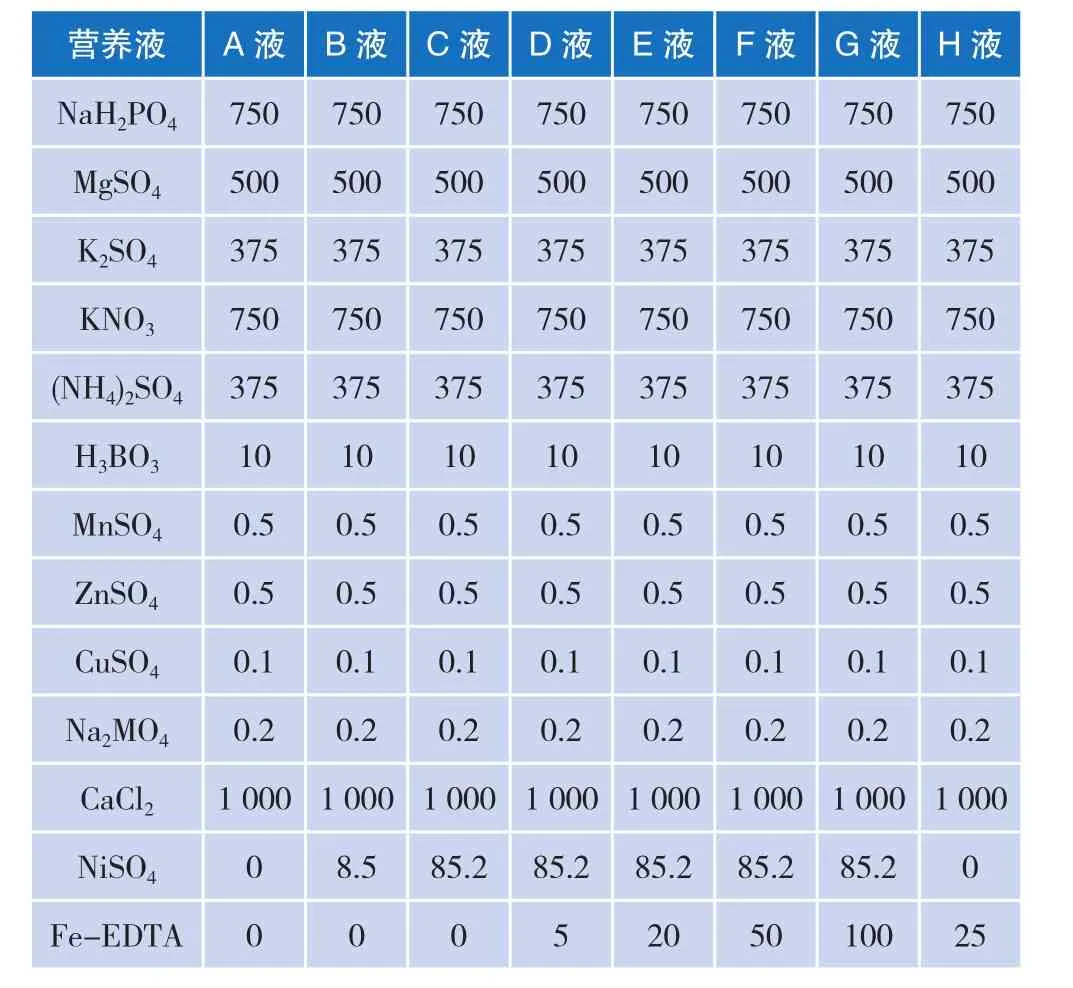
表 1 营养液配方 单位:μmol·L-1
3.2 植株的培养方法
育苗:将种子播种在盛有蛭石的育苗盘中,用清水浸湿。放置在温暖、光照充足的地方,3~4 d等到萌芽之后,添加1/2浓度的完全营养液(华南农大叶菜配方),植株的培养在智能人工气候箱中进行(每天保持在 28 ℃,光照 16 h 和 20 ℃,黑暗 8 h)。待苗长至4~7片真叶期时移栽至水培杯中,用完全营养液并且从人工气候箱中移栽到花房中培养,移栽最初3 d在弱光照下缓苗。培养一定时间(视幼苗长势而定)后,按照不同的条件换营养液培养所需要的时间。
3.3 缺铁诱导对紫花苜蓿吸收镍的影响
育苗后在每个水培杯中移栽两株苗,一共需要移栽到8个水培杯即16株苗,需要在A营养液中培养5 d后,最后将株苗分为两部分处理,其中一部分(4个水培杯中8株苗)用B营养液(即缺铁条件下)加入浓度为0.85 μmol/L的镍处理48 h,另一部分(剩余4个水培杯中8株苗)用C营养液(即缺铁条件下)加入浓度为8.5 μmol/L的镍处理48 h,之后将所有的苗进行预处理后测量镍含量。
3.4 不同铁营养水平对植株镍浓度的影响
育苗在每个水培杯中移栽2株苗,分成五组,每组4个水培杯8株苗,第一组用C营养液即不加铁、5 mg/L镍离子浓度处理10 d;第二组用D营养液即加5 μmol/L的Fe-EDTA、5 mg/L镍离子浓度处理10 d ;第三组 用 E 营 养液即 加 20 μmol/L 的 Fe-EDTA、5 mg/L镍离子浓度处理10 d;第四组用F营养液即加 50 μmol/L 的 Fe-EDTA、5 mg/L 镍离子浓度处理10 d;第五组用G营养液即加5 μmol/L的Fe-EDTA、100 mg/L镍离子浓度处理10 d,之后将所有的苗进行预处理后测量镍含量。
3.5 缺铁条件下不同时间对植株吸收镍的影响
育苗在每个水培杯中移栽两株苗,分成六组,每组4个水培杯8株苗,第一组用C营养液即不加铁、5 mg/L镍离子浓度处理0 d;第二组用C营养液即不加铁、5 mg/L镍离子浓度处理2 d;第三组用C营养液即不加铁、5 mg/L镍离子浓度处理4 d;第四组用C营养液即不加铁、5 mg/L镍离子浓度处理6 d;第五组用C营养液即不加铁、5 mg/L镍离子浓度处理8 d;第六组用C营养液即不加铁、5 mg/L镍离子浓度处理10 d,将处理不同天数的的紫花苜蓿进行预处理后测量镍含量。
3.6 植物的富集总量、富集系数、转运系数
1)植物富集总数是描述重金属在植物体内富集积累量的一个重要指标。
植物富集总量=植物的干重×植物组织中重金属浓度
2)植物富集系数为植物体内某种重金属含量与相应环境中重金属含量的比值。也可以认为是植物对重金属的吸收速率与植物体内重金属的净化速率之比,植物富集系数是描述重金属在植物体内累积趋势之重要指标。
植物富集系数=植物组织中重金属浓度/溶液或土壤中重金属浓度
3)转运系数是指植物地上部分某种重金属含量与根部该种重金属含量的比值。转运系数用来评价植物将重金属从地下部向地上部的运输和富集能力。转运系数大的植物从根系向地上部器官转移的吸收量大。
转运系数=地上部重金属浓度/根中重金属浓度
4 结果与分析
4.1 标准曲线
吸取镍的标准使用液(0.00、0.50、1.25、2.50、4.25、5.00)mL分别于6个25 mL的比色管中,用去离子中定容并摇匀。此标准系列分别含(0.00、0.20、0.50、1.00、1.50、2.00)μg/mL。测其吸光度(见表 2),并绘制标准曲线,如图1所示。
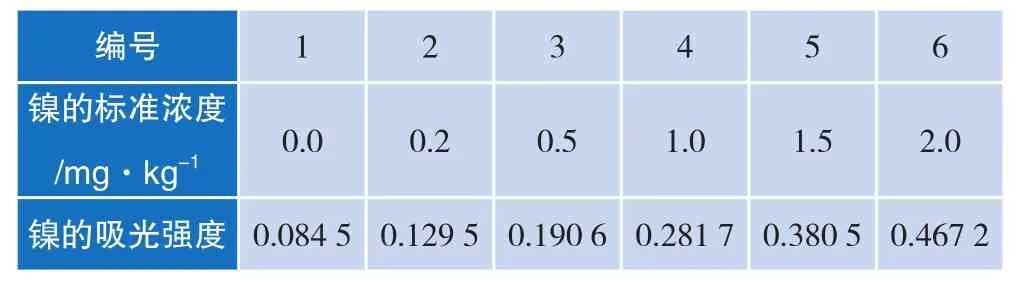
表2 测定镍元素标准曲线的参数

图1 镍的标准曲线
镍的相关线性方程为y= 0.190 7x+ 0.090 4,相关系数为R2= 0.999 1
4.2 缺铁诱导对紫花苜蓿吸收镍的结果分析
缺铁诱导对紫花苜蓿吸收镍的影响见表3、表4。
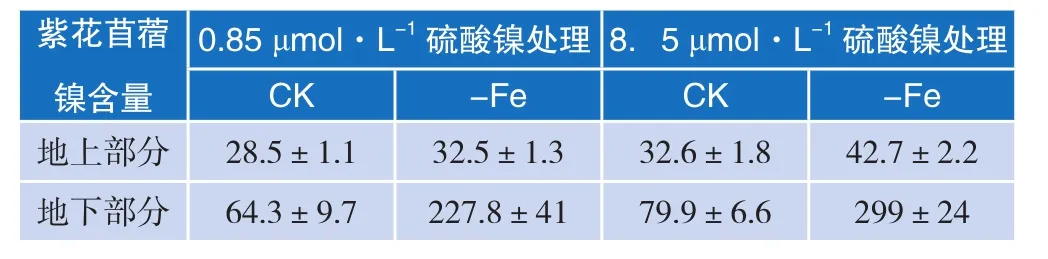
表3 缺铁诱导对紫花苜蓿吸收镍的影响(a)
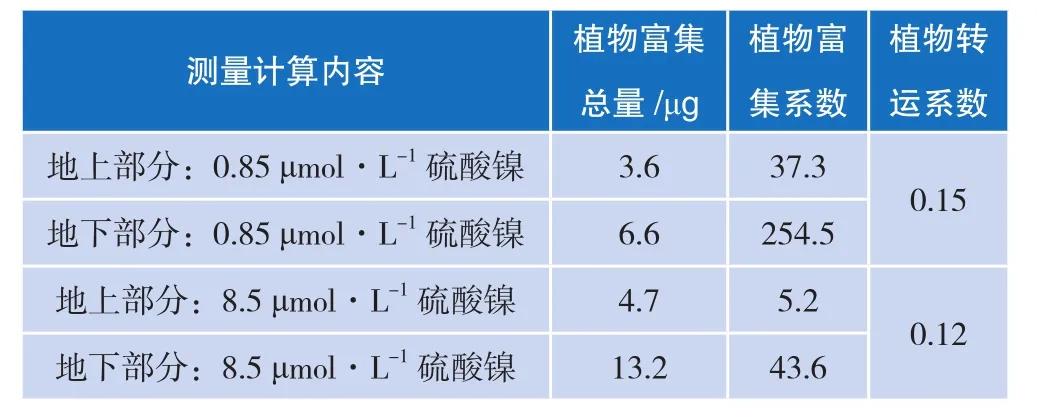
表4 缺铁诱导对紫花苜蓿吸收镍的影响(b)
将紫花苜蓿在缺铁的条件下培养5 d之后,将植株移到含有 0.85 μmol/L、8.5 μmol/L 硫酸镍营养液中处理48 h,分地上部分和地下部分收获。以正常生长的紫花苜蓿植株为对照,实验结果表明,硫酸镍浓度在 0.85 μmol/L 和 8.5 μmol/L 时,缺铁诱导紫花苜蓿地下部分镍含量是对照组的3.5倍和3.8倍,这说明与正常植株相比,缺铁培养都能够显著提高植株的镍富集量。从数据中可以看出当硫酸镍浓度在8.5 μmol/L时,镍的促进富集效果更明显。在低浓度或高浓度的硫酸镍处理时,缺铁诱导对于促进紫花苜蓿根系吸收镍的吸附量更大(见表4)。在8.5 μmol/L硫酸镍营养液处理下的紫花苜蓿根系比0.85 μmol/L硫酸镍营养液处理下的紫花苜蓿根系对于镍的吸收富集效果更好。在低浓度和高浓度两个浓度处理时,缺铁诱导下紫花苜蓿地上部分吸收镍的含量也增加了,结果表明缺铁诱导下能够使镍从紫花苜蓿的根部向地上部分的转运效果增加。但是地上部分对于镍含量的提高的效果远远小于根系部分对于镍含量提高的效果,表明在缺铁培养的条件下紫花苜蓿根系对于镍的吸收效果远大于紫花苜蓿地上部分对于镍的吸收效果。
比较8.5 μmol/L硫酸镍营养液处理下的紫花苜蓿和0.85 μmol/L硫酸镍营养液处理下的紫花苜蓿,无论地上部分还是地下部分,8.5 μmol/L硫酸镍营养液处理下的紫花苜蓿吸收镍含量更高。
综上所述,用8.5 μmol/L硫酸镍处理的紫花苜蓿比用0.85 μmol/L硫酸镍处理的紫花苜蓿对于镍的富集吸收效果更好一些。因此,本实验后续选用8.5 μmol/L浓度的硫酸镍作为镍源提供。
4.3 不同铁营养水平处理下镍含量的结果分析
不同铁营养水平对紫花苜蓿镍含量的影响见表5、图2、图3。

表5 不同铁营养水平对紫花苜蓿镍含量的影响
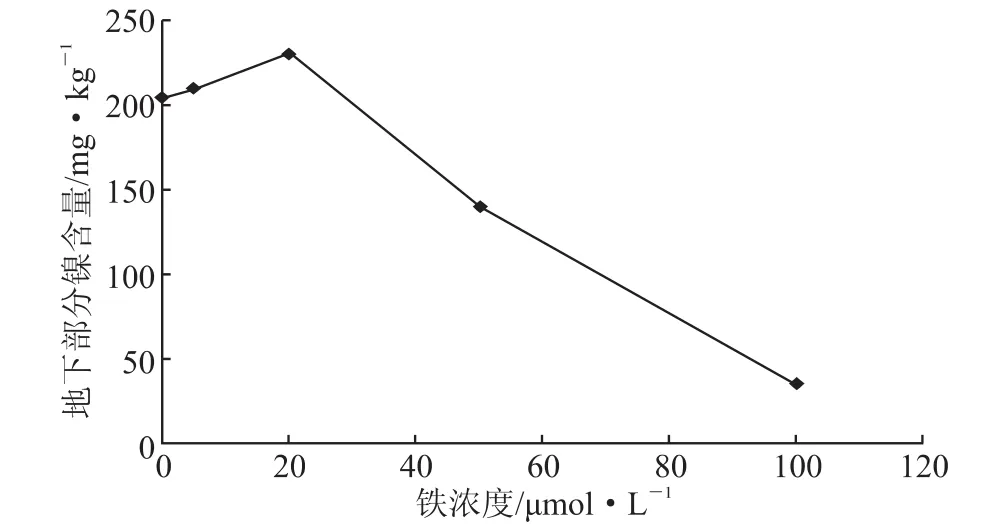
图2 不同铁浓度对紫花苜蓿地下部分镍积累的影响
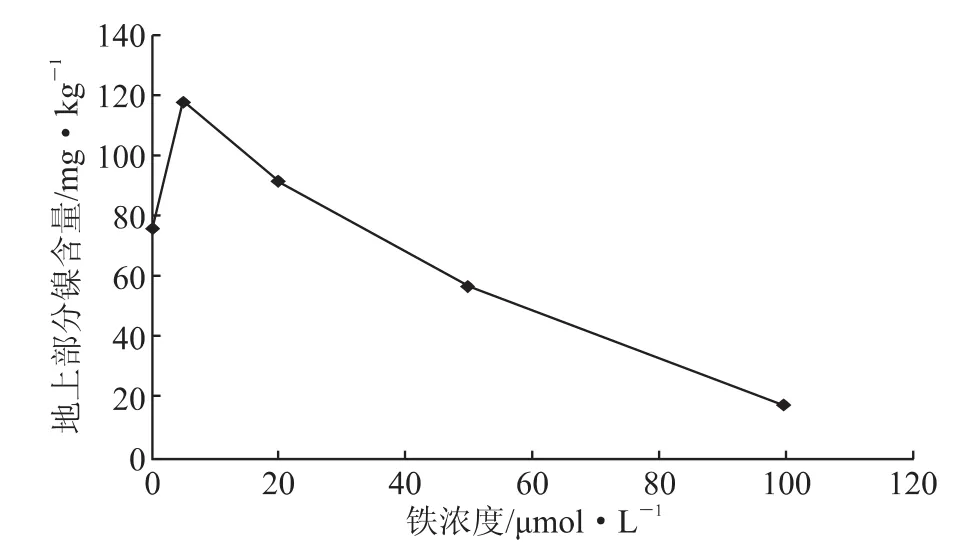
图3 不同铁浓度对紫花苜蓿地上部分镍积累的影响
将紫花苜蓿植株移入 5 μmol/L NiSO4的营养液中,在不同浓度的铁处理条件下,铁以Fe(Ⅲ)-EDTA(乙二胺四乙酸)的形式供应,处理的浓度梯度 设 为 0 μmol/L、5 μmol/L、20 μmol/L、50 μmol/L、100 μmol/L,培养10 d之后,分地上部分和地下部分收获。实验数据表明,5 μmol/L的硫酸镍营养液中紫花苜蓿根系和地上部分的镍含量会随营养液中的Fe(Ⅲ)-EDTA的浓度的增加先上升之后明显下降。当紫花苜蓿中的铁含量从0 μmol/L上升到20 μmol/L 时,紫花苜蓿的镍浓度从 204 mg/kg缓慢上升到230 mg/kg,增加了0.13倍,对于地下部分镍浓度的增长量很少。当营养液中的Fe(Ⅲ)-EDTA的浓度从 20 μmol/L 上升到 100 μmol/L,反而使紫花苜蓿根部镍含量的积累量急剧地下降,从230 mg/kg降到26 mg/kg。紫花苜蓿地上部分中镍的含量也随着铁浓度的增加反而下降,铁的处理在5 μmol/L的时候出现了转折。当营养液中的Fe(Ⅲ)-EDTA的浓度从0 μmol/L上升到5 μmol/L时,紫花苜蓿地上部分镍含量从76 mg/kg上升到117 mg/kg,紫花苜蓿的镍含量上升幅度为0.54倍。当营养液中的Fe(Ⅲ)-EDTA 的浓度从 5 μmol/L 上升到 100 μmol/L 时,紫花苜蓿地上部分镍含量从117 mg/kg降到17 mg/kg。图3上呈现出的是逐渐下降的一个趋势,但是叶片基本都没有出现明显的黄化现象,这可以说明低铁可以提高紫花苜蓿根系和地上部分对镍的吸收富集能力。
对紫花苜蓿地下部分,刚开始镍含量增长量很小,基本属于缓慢生长,虽然图2中表示上升的趋势,但是在数据中看出基本变化不大。当到20 μmol/L的Fe-EDTA营养液处理后开始出现了直线下降的状态,对于地上部分在5 μmol/L的Fe-EDTA营养液处理就开始出现了下降的趋势,但在5 μmol/L到20 μmol/L之间变化不是很明显,20 μmol/L的Fe-EDTA营养液处理后也开始出现了直线下降的趋势。这说明无论地上部分还是地下部分,在20 μmol/L的Fe-EDTA营养液处理之前都有一定的促进作用,之后的促进效果开始减退。进而可以看出,在5 μmol/L的Fe-EDTA营养液处理为分界,用5 μmol/L的Fe-EDTA处理下紫花苜蓿的转运系数最高,达到0.56。这可以看出在这个浓度下的紫花苜蓿从地下转移到地上的效果最好,浓度越高对于紫花苜蓿将镍从地下部分转运到地上部分的转运能力越差,这可能是由于高浓度的铁营养水平对植物根系或者转运酶等能够影响到植物的生理生化的过程导致的,使其不能够正常完成镍的向上转运。在不同铁浓度的营养液处理下,没有发现紫花苜蓿的植株出现很明显的黄化现象。从紫花苜蓿的长势来看,植株在5 μmol/L的Fe-EDTA营养液和20 μmol/L的Fe-EDTA营养液处理下的长势是最好的,无论从植株的地下根部的长度,还是地上植株的茎长和植株叶片的颜色等,都比缺铁和高浓度铁条件下处理的植株生长得好。虽然在100 μmol/L的Fe-EDTA处理下紫花苜蓿的转运系数达到0.49,但是由于其植物富集总量太小,所以导致其转运系数的增大。
根据植物富集总量来看,当用20 μmol/L的Fe-EDTA处理时,紫花苜蓿地上和地下部分的植物富集总量分别为 15.8 μg和 12.6 μg,在所有梯度铁浓度中植物富集总量是最大的。其次,用5 μmol/L的Fe-EDTA处理时,紫花苜蓿地上和地下部分的植物富集总量达到 14.2 μg和 9.3 μg,其余梯度铁浓度中植物富集总量相对较小,说明在20 μmol/L和5 μmol/L的Fe-EDTA处理时,紫花苜蓿有更好的植物富集效果。根据植物富集系数来看,0 μmol/L的Fe-EDTA处理时,紫花苜蓿地上和地下部分的植物富集系数分别为9.0和27.1,5 μmol/L的Fe-EDTA处理时,紫花苜蓿地上和地下部分的植物富集系数分别为13.2和23.7, 用 0 mol/L 和 5 μmol/L 的 Fe-EDTA 处 理时,紫花苜蓿的植物富集系数更高,当铁浓度提高时植物富集系数开始降低。
综上,通过镍含量的吸收、植物富集总量、植物富集系数、植物转运系数四个指标综合比较,5 μmol/L的Fe-EDTA处理紫花苜蓿处于较理想的状态。实践中用5 μmol/L的Fe-EDTA营养液处理是比较符合实际,能够达到预期的理想效果的。
4.4 缺铁时间对紫花苜蓿吸收镍的影响结果分析
缺铁时间对紫花苜蓿吸收镍的影响见表6、图4、图5。

表6 缺铁时间对紫花苜蓿吸收镍的影响

图4 不同缺铁诱导时间紫花苜蓿地上部分对镍吸收的动态
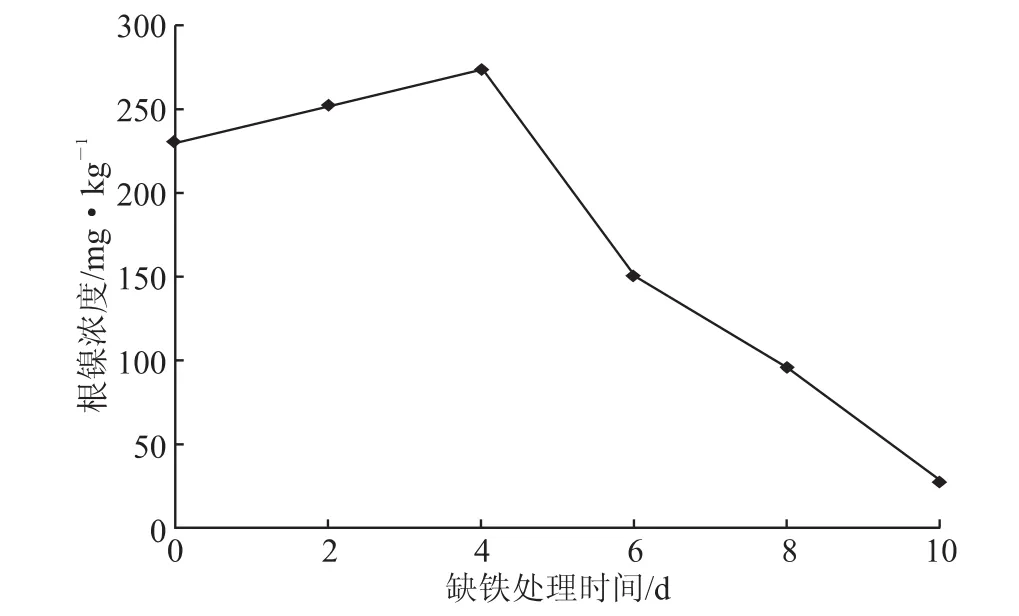
图5 不同缺铁诱导时间对紫花苜蓿地下部分镍吸收的动态
将完全培养液中生长的紫花苜蓿移栽到缺铁培养液中,营养液中不加入Fe(Ⅲ)-EDTA,其他营养液中的成分与完全培养液相同,调节至pH6.7左右,分别培养 0 d、2 d、4 d、6 d、8 d、10 d,然后分别将这几天培养下的紫花苜蓿移栽到5 μmol/L的硫酸镍的缺铁营养液中,处理48 h后,分地上和地下两部分收获。从图4、图5中看出,当缺铁的处理时间增加,紫花苜蓿地上部分呈现先稳定后下降的趋势,地下部分呈现先上升后下降的一个形态。地上部分在缺铁诱导时间2 d的时候紫花苜蓿对镍的吸收富集的量最高值53 mg/kg,第四天达到50 mg/kg,与第二天两者差距不大,当第四天之后紫花苜蓿吸收富集镍的含量开始下降。紫花苜蓿地下部分在缺铁4 d的时候达到一个顶点,0 d开始到4 d呈现出缓慢上升的形态,当4 d之后紫花苜蓿地下部分的含量开始出现明显的下降趋势。实验过程中,缺铁处理的前6 d对于紫花苜蓿并没有明显的缺铁叶片黄化的现象,说明紫花苜蓿在前6 d的处理下并没有影响到植物的转运酶等生理生化的过程。当缺铁处理第八天开始,植物的缺铁现象通过紫花苜蓿叶片的黄化现象开始显露出来。伴随着缺铁时间的增加,紫花苜蓿缺铁叶片黄化现象也越明显。由于紫花苜蓿的缺铁处理时间的增加,植物中的很多酶蛋白等物质不能够正常地利用,导致植物本身根质膜发生永久性的伤害,植物本身的生理生化功能不能正常运转,这样必然会影响到紫花苜蓿根系对镍的吸收,以及紫花苜蓿根部转运到叶片的镍也相对减少。
紫花苜蓿在缺铁 0 d、2 d、4 d,无论地上还是地下部分的镍含量差别不大,从植株地下转运到地上部分的镍含量相差不多,这说明紫花苜蓿镍转运效果在4 d前基本变化不大。但是第四天之后就开始出现了下降的趋势,不仅地下部分植株的镍含量下降,地上部分植株的镍含量也随着下降。转运效果虽然在数量比上来看是一个增高的状况,可是数值本身还是递减的,这有可能是因为在培养到第六天之前地下植株转运到地上部分,然后分别在植株体内有一定的积累富集的基础。当天数增加,地下部分植株的镍含量开始出现下降的情况,说明缺铁时间过久导致其富集吸收的能力下降。当时间增加之后,地上部分植株因为之前的富集积累有了一定的镍含量基础,所以没有因为地下部分植株的含量减少,地上部分植株减少与地下部分植株较少比例同步,相反的地上部分植株的减少量反而很小。当到达到第十天的时候,植株地上部分和地下部分基本对镍的积累富集量很小了。
通过以上结果,可以发现当紫花苜蓿在缺铁4 d的时候对镍的富集量是最大的。
5 结语
本文主要研究在不同铁浓度水平下紫花苜蓿对镍吸收的情况。本实验用紫花苜蓿作为实验材料,分为三个部分。第一部分在缺铁的条件下培养5 d,然后分别在两个低高浓度镍下处理紫花苜蓿。第二部分通过不同的供铁浓度来影响紫花苜蓿对镍的吸收。第三部分研究不同缺铁时间对紫花苜蓿吸收镍的影响。
缺铁诱导对紫花苜蓿吸收镍的结果表明,硫酸镍浓度在 0.85 μmol/L 和 8.5 μmol/L 时,缺铁诱导紫花苜蓿地下部分镍含量是对照组的3.5倍和3.8倍。这说明与正常植株相比,缺铁培养都能够显著提高植物的镍富集量,并且从数据中可以看出,当硫酸镍浓度在8.5 μmol/L时植株对镍的促进富集效果更明显。
不同铁营养水平处理下紫花苜蓿镍含量的结果表明,低浓度的供铁对紫花苜蓿吸收镍有一定的促进作用。当浓度升高之后,植物体内的镍含量反而出现了下降的趋势,这有可能是浓度太高导致植物体内某些酶的永久性伤害,或者开始出现抑制植物的吸收导致的;在20 μmol/L的Fe-EDTA处理下紫花苜蓿和5 μmol/L的Fe-EDTA处理下紫花苜蓿有更好的植物富集效果。从植物富集系数的比较来看,在0 μmol/L和5 μmol/L的Fe-EDTA处理下紫花苜蓿的植物富集系数更高,当浓度提高时植物富集系数开始减小。
缺铁时间对紫花苜蓿吸收镍的影响结果表明,在不同的缺铁处理时间之后,地上部分和地下部分分别出现了先上升后下降的趋势,虽然在0 d、2 d、4 d的植物的体内镍含量变化不是很大。在缺铁处理7 d之后,紫花苜蓿开始出现缺铁黄化的现象,随着缺铁时间的继续增加,黄化现象越来越明显。造成这种现象的原因是由于缺铁时间的不断增加,导致根非共质体中的铁不能再被利用,从而根质膜发生一些不能自动恢复原态,造成持久性不可恢复的伤害,因此导致质膜转运蛋白和其他酶系的表达也受到了巨大的伤害。
紫花苜蓿其生物量大,抗逆性强,植物生长快,一年可以收获3~4次等特点,并且修复效率高,在镍污染的植物土壤修复治理中,紫花苜蓿作为重金属镍污染的修复植物具有巨大的潜力。

