广西家蚕血液型脓病发病因子及其病原分子系统发育分析
王霞 黄旭华 蒋满贵 唐亮 董桂清 黄深惠 石美宁 潘志新


摘要:【目的】明确病原[家蚕核型多角体病毒(BmNPV)]、寄主(家蚕品种)和环境条件(温湿度)的相关性并掌握BmNPV的感染力差异及传播规律,为蚕业生产上有效防控家蚕血液型脓病提供科学依据。【方法】测定从广西不同蚕区和不同季节收集的BmNPV毒株在不同温湿度条件下对不同家蚕品种的半数致死浓度(LC50),调查病原、寄主和环境条件三者对家蚕血液型脓病发生的影响;并基于bro-a和bro-c基因序列构建不同来源BmNPV毒株的系统发育进化树及进行相似性和遗传距离分析。【结果】15株不同来源BmNPV毒株对家蚕品种两广二号的LC50为2.1×106~4.2×106多角体/mL,毒株间的差异不显著(P>0.05);不同BmNPV毒株在不同环境条件[春季(温度25 ℃和湿度90%)、夏季(温度35 ℃和湿度95%)、秋季(温度30 ℃和湿度85%)]下对家蚕的LC50排序均表现为春季>秋季>夏季,在夏季和秋季条件下,不同蚕品种对BmNPV的感染抵抗力排序为桂蚕N2>两广二号>桂蚕2号,桂蚕N2对BmNPV的感染抵抗力显著高于两广二号和桂蚕2号(P<0.05)。不同BmNPV毒株在基于bro-a和bro-c基因序列构建的系统发育进化树上均聚在同一分支上,不同BmNPV毒株间的bro-a基因序列相似性很高、遗传距离较小,但不同BmNPV毒株间的bro-c基因序列相似度相对低、遗传距离相对较大。【结论】温湿度条件是广西蚕区家蚕血液型脓病发生的重要因子,且血液型脓病的发生流行与家蚕品种抗性也有密切关系。
关键词: 家蚕;家蚕核型多角体病毒(BmNPV);感染力;发病因子;bro-a基因;bro-c基因
0 引言
【研究意义】广西属于亚热带季风气候区,高温多雨,有利于种养业生产发展的同时也适宜病原微生物繁殖感染而引发病害。随着国家“东桑西移”工程的推进,广西蚕业取得了长足发展,其蚕茧产量自2005年起已成为全国第一大省(区),但在实际生产中同样面临着蚕病的严峻挑战,据统计广西蚕业生产因蠶病发生而造成的蚕茧损失在15%~20%,每年损失蚕茧数万吨,其中由家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)感染引起的血液型脓病是最普遍的传染性蚕病之一(闭立辉,2005;邵榆岚等,2017;唐芬芬等,2019)。蚕病的发生是家蚕与病原微生物在一定环境条件下相互作用的结果,因此,调查BmNPV来源、家蚕品种及环境条件对家蚕血液型脓病的影响,有利于明确引发家蚕血液型脓病发生的关键因素,对科学防控家蚕血液型脓病危害及促进蚕业持续健康发展具有重要意义。【前人研究进展】鉴于家蚕血液型脓病对蚕业生产的严重危害性,至今已有诸多学者对其病原感染力及分子特征进行深入研究(黄深惠等,2012;Xu et al.,2013;唐芬芬等,2014;董战旗和潘敏慧,2017)。孙京臣等(2001)通过调查广东 8个地区BmNPV对家蚕的致病力,结果发现不同地区的BmNPV致病力存在明显差异。白兴荣等(2010)在调查云南蚕区不同地区BmNPV对家蚕的致病力时也发现不同地区的BmNPV致病力有明显差异,其半数致死浓度(LC50)相差最高达5个数量级。黄深惠等(2012)调查广西蚕区10个地方BmNPV样品对家蚕的致病力,结果表明广西南部BmNPV的致病力普遍高于广西北部BmNPV,其LC50差异最高达9倍。有关Bm-NPV基因的研究也取得重要进展,Maeda和Majima(1990)测序获得BmNPV全基因组,并证实该基因组是一个闭合环状的超螺旋结构DNA分子。家蚕BmNPV基因组全长为128413 bp,包含136个开放阅读框(ORF)(Gomi et al.,1999;吴小峰,2006),但不同BmNPV株系的基因组核苷酸组成略有差异。此外,已有研究证明bro基因是BmNPV基因组中的一种重要基因簇,是影响病毒复制与分化的因子,在病毒侵染宿主的过程中发挥重要作用(庞敏,2007;周敬波,2012;张媛媛等,2016)。Gomi等(1999)研究发现BmNPV的bro基因存在bro-a、bro-b、bro-c和bro-d等拷贝,且基因拷贝数及片段大小因病毒毒株不同而有所差异。王霞(2005)通过比较BmNPV的T3株系和SC7株系,发现T3株系中存在bro-a、bro-b、bro-c、bro-d和bro-e等5个拷贝,而SC7株系的相应区域仅有1个bro拷贝。张媛媛等(2016)利用Red重组技术敲除bro-d基因,发现bro-d基因缺失导致BmNPV基因组复制水平下降。Fujimoto等(2020)对比不同BmNPV株系的bro基因发现,La株系仅存在bro-a、bro-c、bro-d和bro-e等4个拷贝,与T3株系的同源性分别为98.7%、96.5%、95.4%和90.4%。【本研究切入点】广西是我国的新兴蚕区,但针对其主要蚕病病原特征及其流行规律的研究较少,尤其是有关家蚕血液型脓病发生影响因子及BmNPV的分子遗传特征至今未见报道。【拟解决的关键问题】基于病害发生的三要素(寄主、病原和环境条件),调查广西蚕区不同来源BmNPV毒株的感染力、不同蚕品种对BmNPV的抵抗力及不同环境条件下家蚕血液型脓病的发生情况,并研究不同来源BmNPV毒株的感染相关基因特性,旨在明确病原(BmNPV)、寄主(家蚕品种)和环境条件(温湿度)的相关性并掌握BmNPV毒株的感染力差异及传播规律,为蚕业生产上有效防控家蚕血液型脓病提供科学依据。
1 材料与方法
1. 1 试验材料
在广西南宁(Nn)、河池(Hc)、贵港(Gg)、百色(Bs)和来宾(Lb)5个蚕区,根据春、夏、秋不同养蚕季节分别收集BmNPV样品,样品具体信息见表1。将收集的家蚕血液型脓病病蚕样品研磨、过滤(300目筛)和离心(2000 r/min,10 min)后配制成1×107多角体/mL的病毒液,均匀涂抹于桑叶表面,给四龄起蚕添食,待家蚕发病后收集病蚕血液,2000 r/min离心10 min,纯化各BmNPV样品,4.0 ℃保存备用。供试家蚕品种为两广二号、桂蚕2号和桂蚕N2。2×Pfu PCR MasterMix购自天根生化科技(北京)有限公司,DNA Marker、pMD18-T载体和大肠杆菌DH5α感受态细胞购自宝生物工程(大连)有限公司,琼脂糖凝胶纯化回收试剂盒(HDP202-1)购自上海惠凌生物技术有限公司;SDS、EDTA,NaCl和RaseA及无水乙醇等试剂均为国产分析纯。
1. 2 不同BmNPV毒株对家蚕感染力的测定
将不同BmNPV毒株配制成1.0×107多角体/mL的病毒液,并10倍梯度稀释成三级浓度,分别为1.0×107、1.0×106和1.0×105多角体/mL。将各级浓度病毒液分别添食给两广二号二龄起蚕,每个浓度设3个区,每区30头家蚕,添食方法为每区用3张桑叶(3 cm×4 cm),取0.6 mL病毒液均匀涂抹在桑叶表面上,给二龄起蚕添食。空白对照组桑叶表面均匀涂抹蒸馏水。24 h后待家蚕食完桑叶后,用新鲜石灰粉进行蚕体蚕座消毒,清理、更换蚕座及垫纸,并更换普通桑叶喂饲。每天上午以新鲜石灰粉进行蚕体蚕座消毒及清洁,并更新蚕座和垫纸一次,防止蚕座内二次感染。至添毒96 h后家蚕开始发病,调查发病蚕头数,连续调查4 d,计算各区家蚕血液型脓病发病率,并使用GraphPad Prism 6.0的直线内插法计算不同BmNPV毒株对家蚕的LC50。
1. 3 不同BmNPV毒株在不同环境条件下对家蚕感染力的测定
模拟广西蚕区春、夏、秋的气候条件,在设置的3种环境条件[春季(温度25 ℃和湿度90%)、夏季(温度35 ℃和湿度95%)、秋季(温度30 ℃和湿度85%)]下收蚁、饲养两广二号至二龄起蚕;取广西南宁、河池、来宾、百色和贵港蚕区不同季节(春、夏、秋)的BmNPV毒株进行梯度浓度感染家蚕,感染和调查方式同1.2,计算各区的发病率及LC50。
1. 4 不同BmNPV毒株对不同家蚕品种感染力的测定
取家蚕两广二号、桂蚕2号和桂蚕N2分别在设置的3种环境条件(春、夏、秋)下进行收蚁、饲养至二龄起蚕,再取广西南宁、河池和百色3个蚕区不同季节(春、夏、秋)的BmNPV毒株进行梯度浓度感染家蚕,感染和调查方式同1.2,计算各区的发病率及LC50。
1. 5 不同BmNPV毒株分子系统发育分析
1. 5. 1 DNA提取 将纯化后的300.0 μL BmNPV加入300.0 μL提取液(100 mmol/L Tris-HCl,10 mmol/L EDTA,2.0 mol/L NaCl,0.1 mol/L Na2CO3,1% SDS,0.1 mg/mL RnaseA,pH 8.0)中,50 ℃孵育20 min,加入300.0 μL NaAC(3 mol/L,pH 5.2),12000 r/min離心10 min,将上清液转入灭菌的1.5 mL离心管中,向离心管加入0.35倍的无水乙醇。室温放置10 min,12000 r/min离心15 min,弃上清液;加入1.0 mL 70%乙醇洗涤,12000 r/min离心3 min,弃上清液;沉淀重复用70%乙醇洗涤一次,弃上清液,保留沉淀,室温放置2 min后加入100.0 μL 1×TE溶解沉淀,-20 ℃保存备用。
1. 5. 2 bro-a和bro-c基因扩增 参考已知BmNPV(登录号FJ882854.1)中的bro-a和bro-c基因序列,通过DNASTAR设计引物bro-aF(5'-ATGGCTCAAGTT AAAATTGGAG-3')/bro-aR(5'-GGCTTACAAGTTA AAATTGTTATTC-3')和bro-cF(5'-GCATGGCTC AAGTTAAAATTGGAG-3')/bro-cR(5'-TTATTGCGC
GTTGCGCAAACTG-3'),并委托生工生物工程(上海)股份有限公司合成。以提取的BmNPV DNA为模板进行PCR扩增,PCR反应体系:2×Pfu PCR MasterMix 25.0 μL,bro-aF/bro-aR(10 μmol/L)或bro-cF/bro-cR(10 μmol/L)各2.5 μL,DNA模板0.5 μL,ddH2O 19.5 μL。扩增程序:95 ℃预变性4 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸5 min。以1.0%琼脂糖凝胶电泳检测PCR扩增产物,120 V下电泳20 min,凝胶成像系统成像并进行观察。按照琼脂糖凝胶纯化回收试剂盒说明对PCR扩增产物进行切胶回收,连接至pMD18-T载体后转化DH5α感受态细胞,阳性菌落送至生工生物工程(上海)股份有限公司测序,并拼接获得完整的bro-a和bro-c基因序列。
1. 5. 3 系统发育进化分析 以舞毒蛾核型多角体病毒(LdMNPV)的bro-a和bro-c基因为外源对照,利用ClustalX和DNAMAN对测序获得的15份BmNPV样品的bro-a和bro-c基因序列进行比对分析并构建系统发育进化树。利用GraphPad Prism 6.0对试验数据进行统计分析。
2 结果与分析
2. 1 不同蚕区和季节BmNPV毒株对家蚕的感染情况
由图1可看出,从不同蚕区和季节采集到的15株BmNPV毒株对家蚕均有一定的感染力,对家蚕的LC50在2.1×106~4.2×106多角体/mL。以在百色蚕区收集的BmNPV感染力相对较弱,其LC50为4.2×106多角体/mL;在来宾蚕区收集的BmNPV感染力最强,其LC50为2.1×106多角体/mL,二者相差2倍。对不同蚕区的BmNPV感染力(LC50)进行方差分析,结果发现均未达显著差异水平(P>0.05,下同),说明广西不同蚕区的BmNPV感染力差异不显著;同时对同一蚕区不同季节的BmNPV感染力(LC50)进行方差分析,其结果也表明未达显著差异水平,说明在广西蚕区不同季节(春、夏、秋)采集的BmNPV在相同环境条件下其感染力虽有一定差异,但差异不显著。
2. 2 不同BmNPV毒株在不同环境条件下对家蚕的感染情况
由图2可看出,不同BmNPV毒株在不同环境条件下对家蚕的感染力存在一定差异,不同蚕区BmNPV毒株对家蚕的LC50排序均表现为春季(4.8×106~11.4×106多角体/mL)>秋季(3.1×106~3.9×106多角体/mL)>夏季(1.4×106~3.1×106多角体/mL),其中,Lb-BmNPV毒株在春季的LC50显著高于其在夏季和秋季的LC50(P<0.05,下同),Hc-BmNPV毒株在春季的LC50显著高于其在夏季的LC50。说明在夏季的环境条件下,BmNPV的感染力更强,与蚕业生产上高温多湿的5—8月家蚕血液型脓病发病率较高相吻合。
2. 3 不同BmNPV毒株对不同家蚕品种的感染情况
由图3可看出,不同BmNPV毒株对不同家蚕品种的感染力也存在明显差异,在夏季和秋季的条件下,不同蚕品种对BmNPV的感染抵抗力排序为桂蚕N2>两广二号>桂蚕2号,桂蚕N2对BmNPV的感染抵抗力显著高于两广二号和桂蚕2号,而两广二号与桂蚕2号间的差异不显著;在春季的条件下,不同家蚕品种对BmNPV的感染抵抗力差异不显著。可见,在高温多湿季节不同家蚕品种对BmNPV的感染抵抗力存在明显差异,因此在高温多湿季节及家蚕血液型脓病高发地区应选用高抗BmNPV家蚕品种饲养。
2. 4 不同BmNPV毒株分子系统发育分析结果
通过PCR扩增及测序分析,获得15株BmNPV毒株的bro-a和bro-c基因序列,序列长度约951 bp,不同毒株间存在1~3个核苷酸差异。经序列比对分析后,分别基于bro-a和bro-c基因序列構建系统发育进化树。由图4可知,不同蚕区和季节的15株BmNPV毒株在基于bro-a基因序列构建的系统发育进化树上聚在同一分支上,与LdMNPV的亲缘关系较远;综合相似性和遗传距离分析结果(表2)发现,15株BmNPV毒株间的bro-a基因序列相似性为88.2%~100.0%,大部分大于95.0%,其中Bs2毒株与Bs3毒株的相似度达100.0%;15株BmNPV毒株的遗传距离为0~9.3,其中,Bs2毒株与Bs3毒株的遗传距离为0,而Nn1毒株与Hc3毒株的遗传距离为9.3。说明BmNPV的bro-a基因遗传进化较保守,也证实15株BmNPV毒株间具有很近的亲缘关系。
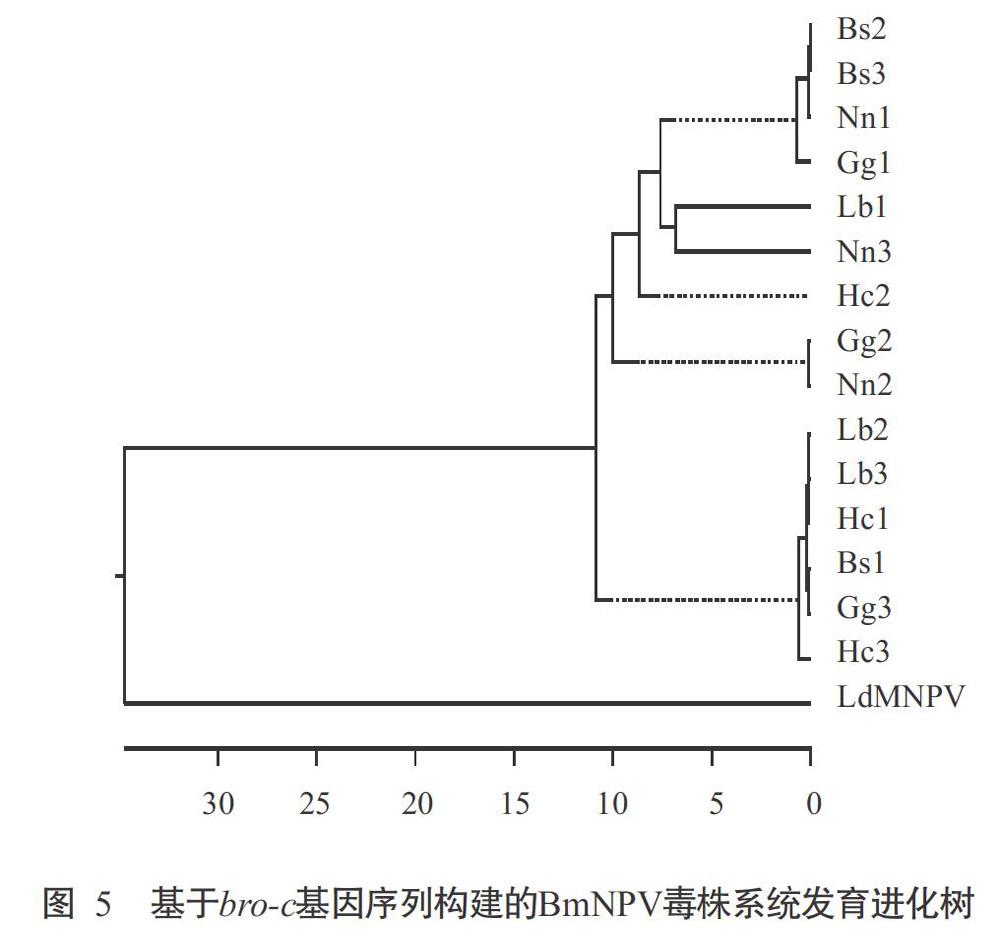
基于bro-c基因序列构建的系统发育进化树也显示,15株BmNPV毒株聚在同一分支上(图 5),但不同蚕区不同季节的BmNPV毒株分散于不同小分支上。综合相似性和遗传距离分析结果(表3)发现,虽然Bs2毒株与Bs3毒株的相似性最高(100.0%)、遗传距离最小(0),但大部分毒株间的bro-c基因序列相似性低于bro-a基因序列相似性,而bro-c基因序列的遗传距离大于bro-a基因序列,如Lb1毒株与Nn3毒株的相似性最低(80.5%)、遗传距离最大(13.6)。说明15株BmNPV毒株间的bro-c基因遗传进化差异较bro-a基因明显。
3 讨论
家蚕血液型脓病是蚕业生产中危害最严重的一种蚕病。本研究通过综合分析BmNPV、家蚕品种和环境条件三者相互作用影响家蚕血液型脓病发生及流行的规律,经测定广西不同蚕区和季节BmNPV对家蚕的感染力,发现不同蚕区的BmNPV感染力虽存在一定差异,但未达显著水平;在广西蚕区不同季节(春、夏、秋)采集的BmNPV在相同环境条件下其感染力虽有一定差异,但差异也不显著。这可能与广西不同蚕区、不同季节BmNPV毒株的bro-a基因序列在系统发育进化树上聚在同一个分支上,其遗传进化较保守及毒株间的亲缘关系很近有关,与孙京臣等(2001)、白兴荣等(2010)、黄深惠等(2012)的研究结果存在一定差异,但具体原因有待进一步探究。
蚕业生产中,温湿度条件对家蚕生长及病原微生物繁殖有明显影响。本研究测定不同季节(春、夏、秋)条件下BmNPV对家蚕的感染力,结果发现不同蚕区BmNPV毒株对家蚕的LC50排序均表现为春季>秋季>夏季,其中,Lb-BmNPV毒株在春季的LC50显著高于其在夏季和秋季的LC50,Hc-BmNPV毒株在春季的LC50显著高于其在夏季的LC50。说明不同季节条件下,BmNPV的感染力存在明显差异,即温湿度条件是广西蚕区家蚕血液型脓病发生的重要因子,且越是高温多湿条件其发病概率越高,与广西蚕区在高温多湿的5—8月家蚕血液型脓病发病率较高相吻合。因此,在高温多湿季节加强消毒和通风排湿措施,有利于控制家蚕血液型脓病发生。
不同蚕品种由于基因上的差异,对BmNPV的感染抵抗力也存在明显差异。本研究通过测定广西蚕区现行主推3个家蚕品种(两广二号、桂蚕2号和桂蚕N2)对BmNPV的感染抵抗力,发现在夏季和秋季的条件下,不同蚕品种对BmNPV的感染抵抗力排序为桂蚕N2>两广二号>桂蚕2号,桂蚕N2对BmNPV的感染抵抗力显著高于两广二号和桂蚕2号,而两广二号与桂蚕2号间的差异不显著;在春季的条件下3个家蚕品种对BmNPV的感染抵抗力差异不显著。说明在高温多湿季节不同家蚕品种对BmNPV的感染抵抗力存在显著差异,即家蚕血液型脓病的发生流行与蚕品种抗性也有密切关系,与陆瑞好等(2007)、石美宁等(2012)、刘昌文等(2016)的研究结果基本一致。因此,在高温多湿季节及家蚕血液型脓病高发地区应选用高抗BmNPV家蚕品种,可有效降低家蚕血液型脓病发生。
唐芬芬等(2014)研究报道,BmNPV的bro家族基因是一种相对保守的基因簇,适合作为BmNPV株系的分子鉴定依据。本研究基于bro-a和bro-c基因序列对不同蚕区和季节的BmNPV毒株进行系统发育分析,发现不同BmNPV毒株在基于bro-a和bro-c基因序列构建的系统发育进化树上均聚在同一分支上,且不同BmNPV毒株间的bro-a基因序列相似性很高、遗传距离较小,说明广西蚕区不同BmNPV毒株的血缘关系密切;但不同BmNPV毒株间的bro-c基因序列相似度相对低、遗传距离相对较大,广西蚕区不同BmNPV毒株的感染力存在差异性,可能与bro-c基因的功能和遗传相关。
4 结论
广西不同蚕区和季节的BmNPV亲缘关系密切,对家蚕的感染力无显著差异,但在不同季节条件下存在显著差异,说明温湿度条件是广西蚕区家蚕血液型脓病发生的重要因子。在高温多湿季节,不同家蚕品种对BmNPV的感染抵抗力存在显著差异,即家蚕血液型脓病的发生流行与蚕品种抗性也有密切关系。因此,蚕业生产中为有效防控家蚕血液型脓病发生,在高温多湿季节应重点采取以下措施:一是加强蚕室、蚕具及周边环境的消毒,把BmNPV分布降低至最低限度;二是推广应用高抗BmNPV蚕品种,如桂蚕N2等以降低家蚕血液型脓病发生;三是蚕室配备温湿度控制设备以加强通风排湿,促进家蚕生长发育以提高其免疫力和抵抗力。
参考文献:
白兴荣,冉瑞法,董占鹏,董家红,黄平. 2010. 云南不同地区BmNPV对家蚕致病力的研究[J]. 西南农业学报,23(6):2019-2101. [Bai X R,Ran R F,Dong Z P,Dong J H,Huang P. 2010. Study on virulence of BmNPV to Bombyx mori in different areas of Yunnan[J]. Southwest China Journal of Agricultural Sciences,23(6):2019-2101.]
闭立辉. 2005. 广西当前主要蚕病与防治[J]. 广西蚕业,42(4):10-14. [Bi L H. 2005. Sillkworm diseases and control in Guangxi[J]. Guangxi Sericulture,42(4):10-14.]
董戰旗,潘敏慧. 2017. 对家蚕抗核型多角体病毒的研究策略及研究进展[J]. 蚕业科学,43(1):139-146. [Dong Z Q,Pan M H. 2017. Research strategy and progress on resistance of Bombyx mori to nucleopolyhedrovirus[J]. Science of Sericulture,43(1):139-146.]
黄深惠,石美宁,唐亮,黄旭华. 2012. 广西不同蚕区家蚕核型多角体病毒对家蚕致病力的研究[J]. 广西蚕业,49(2):17-19. [Huang S H,Shi M N,Tang L,Huang X H. 2012. Study on virulence of Bombyx mori nuclearpolyhedrovirus to silkworm in different areas of Guangxi[J]. Guangxi Sericulture,49(2):17-19.]
刘昌文,艾均文,薛宏,何行健,郑颖,刘勇. 2016. 湖南省主要家蚕品种资源及现行一代杂交种对血液型脓病的抗性[J]. 中国蚕业,37(3):12-16. [Liu C W,Ai J W,Xue H,He X J,Zheng Y,Liu Y. 2016. Resistance of main kinds of silkworm and the first generation hybrids to BmNPV in Hunan[J]. China Sericulture,37(3):12-16.]
陆瑞好,石美宁,闭立辉,顾家栋,黄君霆. 2007. 广西地区家蚕品种资源对BmNPV抵抗性的初步调查[J]. 蚕业科学,33(1):117-120. [Lu R H,Shi M N,Bi L H,Gu J D,Huang J T. 2007. A preliminary investigation on the resistance of the silkworm variety resources in Guangxi to BmNPV[J]. Science of Sericulture,33(1):117-120.]
庞敏. 2007. 家蚕核型多角体病毒广东分离株空斑克隆株系的建立及其bro基因家族的分析[D]. 重庆:西南大学. [Pang M. 2007. Establishment of Bombyx mori nucleopolyhedrovirus of plaque-purified GD strain and analysis of its bro genes[D]. Chongqing:Southeast Agriculture University.]
邵榆岚,唐芬芬,张一川,张永红,朱峰,白兴荣. 2017. 云南蚕区家蚕品种资源对家蚕核型多角体病毒的抗性评价分析[J]. 南方农业学报,48(3):517-523. [Shao Y L,Tang F F,Zhang Y C,Zhang Y H,Zhu F,Bai X R. 2017. Resistance of silkworm variety resources from Yunnan sericultural areas to Bombyx mori nucleopolyhedrovirus(BmNPV)[J]. Journal of Southern Agriculture,48(3):517-523.]
石美宁,闭立辉,顾家栋,费美华,祁广军,韦博尤,黄君霆,黄玲莉,苏红梅,蒙艺英,张桂征,张雨丽,黄旭华,黄文功. 2012. 家蚕抗血液型脓病新品种桂蚕N2的选育[J]. 广西蚕业,49(4):1-12. [Shi M N,Bi L H,Gu J D,Fei M H,Qi G J,Wei B Y,Huang J T,Huang L L,Su H M,Meng Y Y,Zhang G Z,Zhang Y L,Huang X H,Huang W G. 2012. Breeding of new highly resistant nuclear polyhedrosis disease silkworm variety Guican N2[J]. Guangxi Sericulture,49(4):1-12.]
孙京臣,金丰良,徐兴耀,谭佩婵. 2001. 不同地区BmNPV对家蚕致死中量的比较研究[J]. 广东蚕业,35(4):35-37. [Sun J C,Jing F L,Xu X Y,Tan P C. 2001. Comparative study of BmNPV LC50 in different regions[J]. Guangdong Sericulture,35(4):35-37.]
唐芬芬,邵榆岚,钟健,张永红,黄平,董占鹏,廖鹏飞,白兴荣. 2014. 家蚕核型多角体病毒株系的分子鉴定初探[J]. 蚕业科学,40(6):1030-1035. [Tang F F,Shao Y L,Zhong J,Zhang Y H,Huang P,Dong Z P,Liao P F,Bai X R. 2014. A preliminary study on molecular identification of Bombyx mori nucleopolyhedrovirus strains[J]. Science of Sericulture,40(6):1030-1035.]
唐芬芬,杨伟克,朱峰,邵榆岚,张永红,白兴荣. 2019. BmNPV对家蚕抗氧化酶基因表達及其酶活性的影响[J]. 南方农业学报,50(10):2308-2313. [Tang F F,Yang W K,Zhu F,Shao Y L,Zhang Y H,Bai X R. 2019. Effects of BmNPV on the antioxidant enzyme gene expression and enzyme activity of Bombyx mori[J]. Journal of Southern Agriculture,50(10):2308-2315.]
王霞. 2005. 家蚕核型多角体病毒(BmNPV)bro基因的遗传多样性和进化分析[D]. 重庆:西南大学. [Wang X. 2005. Genetic diversity and evolution about bro genes in Bombyx mori Nucleopolyhedrovirus[D]. Chongqing:Sou-theast Agriculture University.]
吴小峰. 2006. 家蚕核型多角体病毒的基因组结构及其表达模式[J]. 病毒学报,22(4):324-328. [Wu X F. 2006. Genome structure and expression pattern of Bombyx mori nuclear polyhedrosis virus[J]. Chinese Journal of Virology,22(4):324-328.]
张媛媛,魏铭,李俊,张婷,全滟平,舒特俊,于威. 2016. 家蚕杆状病毒bro-d基因缺失对病毒基因转录和细胞凋亡的影响[J]. 农业生物技术学报,24(7):1073-1082. [Zhang Y Y,Wei M,Li J,Zhang T,Quan Y P,Shu T J,Yu W. 2016. Effect of bro-d deletion on the viral transcription and cell apoptosis in silkworm(Bombyx mori)[J]. Journal of Agricultural Biotechnology,24(7):1073-1082.]
周敬波. 2012. 家蚕核型多角体病毒泰国株的鉴定及其bro基因家族分析[D]. 合肥:安徽农业大学. [Zhou J B. 2012. Indentification of a new Bombyx mori nucleopolyhedrovirus and analysis of its bro gene family[D]. Hefei:Anhui Agricultural University.]
Fujimoto S,Kawamoto M,Shoji K,Suzuki Y,Katsuma S,Iwanaga M. 2020. Whole-genome sequencing and comparative transcriptome analysis of Bombyx mori nucleopolyhedrovirus La strain[J]. Virus Genes,56(2):249-259.
Gomi S,Majima K,Maeda S. 1999. Sequence analysis of the genome of Bombyx mori nucleopolyhedrovirus[J]. The Journal of General Virology,80(5):1323-1337.
Maeda S,Majima K. 1990. Molecular cloning and physical mapping of the genome of Bombyx mori nuclear polyhedrosis virus[J]. The Journal of General Virology,71(8):1851-1855.
Xu Y P,Cheng R L,Xi Y,Zhang C X.2013. Genomic diversity of Bombyx mori nucleopolyhedrovirus strains[J].Genomics,102(1):63-71.
(责任编辑 兰宗宝)

