肝小静脉闭塞症与布-加综合征的CT鉴别诊断
张茜,张禹,朱友志,骆祥伟
中国人民解放军联勤保障部队第九〇一医院影像科,安徽合肥 230031;
肝小静脉闭塞症(hepatic veno-occlusive disease,HVOD)又称为肝窦阻塞综合征,指肝小叶下静脉、肝小叶中央静脉出现闭塞及狭窄导致肝内窦后出现的门静脉高压症[1-2]。临床以肝区胀痛、胸水伴腹水及高胆红素血症等为特点。布-加综合征(Budd-Chiari syndrome,BCS)指由肝静脉和(或)下腔静脉梗阻引起的腹痛、肝功能障碍、腹水、下肢水肿及门静脉高压等病变。主要病理改变为肝后或肝上段下腔静脉和(或)肝静脉的膜性或节段性狭窄或闭塞,及由此导致的肝静脉和下腔静脉系统回流障碍[3]。
由于HVOD 及BCS对肝损伤和对肝窦压力增加的机制相同,两者临床表现及影像学特征相似,但治疗方案不同,故对HVOD 的准确诊断及其与BCS 的鉴别诊断具有重要的临床意义。目前对HVOD 和BCS的鉴别诊断鲜有报道。本研究回顾性分析HVOD 及BCS 患者的CT特征,并对两者进行鉴别,以提高对 两者的诊断准确性。
1 资料与方法
1.1 研究对象 回顾性分析2013年1月—2018年6月联勤保障部队第901 医院收治的20例HVOD 及20例BCS 患者的临床资料。所有患者入院后均接受多层螺旋CT平扫和三期增强扫描。HVOD 及BCS 患者临床资料见表1。两组患者下肢水肿发生率及服用“土三七”等中药史情况比较,差异有统计学意义(P<0.05);性别、年龄、腹痛、腹胀、黄疸等发生率比较,差异均无统计学意义(P>0.05,表1)。
HVOD 纳入标准:①其他原因无法解释的胆红素增高(胆红素≥34.2 μmol/L);②疼痛性肝脏肿大、腹水;③不明原因的体重增加>2%;④肝穿刺活检病理。符合条件①及②~④项中至少2项者诊断为HVOD[4]。排除治疗前CT 资料不全或图像质量较差者。BCS 纳入标准:①经彩色多普勒超声、CT血管造影或DSA等检查确诊为原发性BCS;②患者均为首次入院,此前未行介入、手术等治疗[5]。排除标准:①治疗前影像资料不全或图像质量较差;②患者已针对BCS 进行介入或手术治疗。
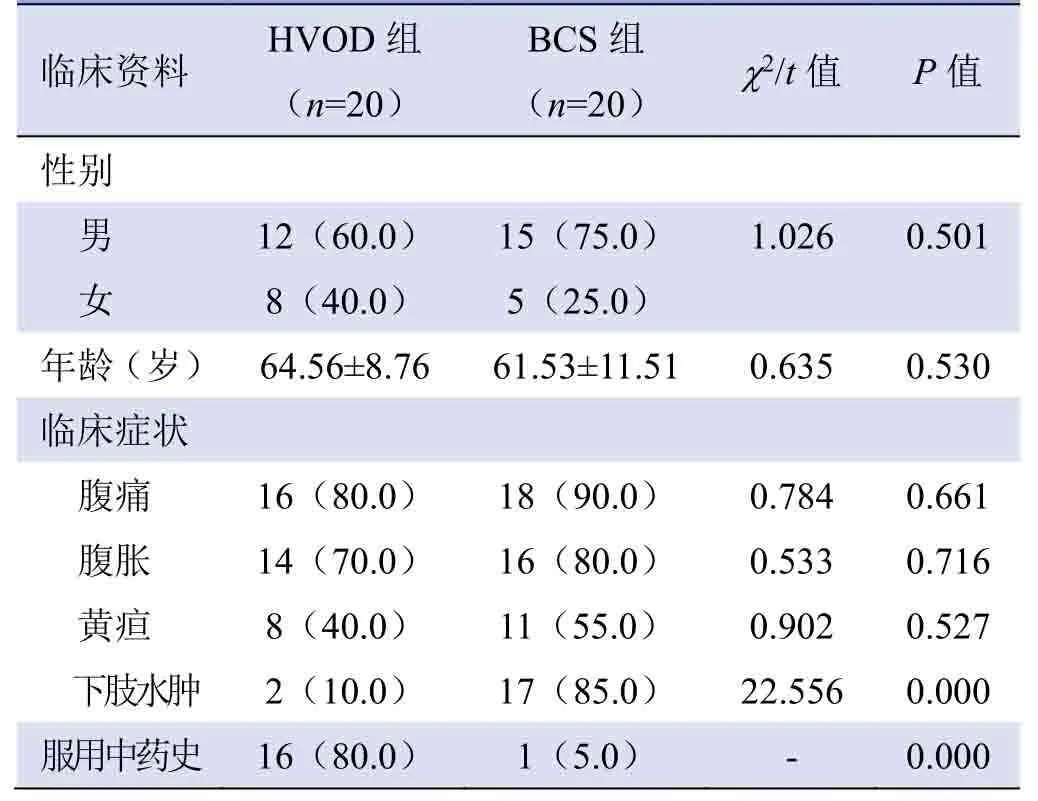
表1 HVOD 及BCS 患者临床资料比较[例(%)]
1.2 扫描方法 采用Siemens Somatom Definition 双源CT 机扫描,检查前患者禁食4~6 h。扫描参数:管电压120 kV,管电流210 mA,层厚5 mm,螺距1,重建间隔5 mm,球管旋转时间0.5 s/圈,准直器64×0.6 mm。开启实时动态曝光剂量调节(CAREDose4D)模式,触发阈值设置为100 Hu,动脉期后延迟20 s 行静脉期扫描,300 s 行延迟期扫描,并采用静脉期数据进行多平面重组,观察肝静脉及侧支情况。造影剂采用300 mg/ml 碘海醇90~110 ml,注射速度2.5~3.0 ml/s。
1.3 影像学分析 所有CT图像均由2名高年资放射科主治医师采用双盲法在图像存储与传输系统进行观察,包括:①肝脏肿大;②腹水;③胆囊壁增厚(>3 mm);④肝静脉狭窄(肝右静脉为3 支主肝静脉中最大的1 支,且肝左及肝中静脉形成共干,故选择肝右静脉测量,直径<4.5 mm 定为肝静脉狭窄);⑤下腔静脉狭窄或闭塞;⑥侧支循环数目;⑦平扫及三期增强肝脏异常密度范围(异常密度分布区域的范围分为3级:1级为少数肝段可见轻度斑片状低密度区;2级为大多数肝段成片斑片状低密度区;3级为全肝可见弥漫性斑片状低密度区)。最终结果由2位医师达成共识。意见不同时由具有高级职称的第3 人进行判别。
1.4 统计学方法 采用SPSS 19.0软件,计量资料以表示,组间比较采用独立样本t检验;计数资料组间比较采用χ2检验或Fisher 确切概率法。P<0.05 表示差异有统计学意义。
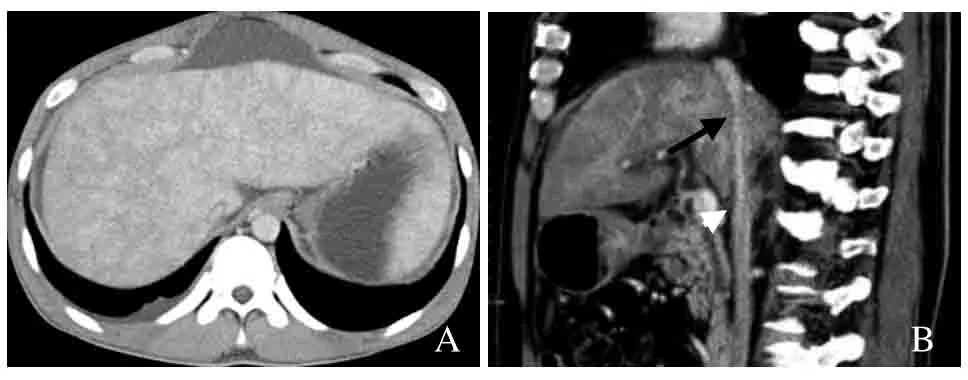
图1 男,55岁,HVOD。肝静脉狭窄(A);下腔静脉肝段狭窄(箭),但无肝静脉闭塞远端的下腔静脉扩张(箭头)及侧支循环(B)

图2 男,63岁,BCS。肝静脉狭窄,且侧支循环数增多(箭,A);下腔静脉肝段狭窄,同时出现肝静脉闭塞远端的下腔静脉扩张(箭,B)
2 结果
2.1 CT表现 BCS组患者侧支循环数显著多于HVOD组,差异有统计学意义(P<0.05);两组均可出现肝静脉狭窄;但BCS组患者更易出现肝静脉闭塞及其远端下腔静脉扩张(图1、2)。BCS组与HVOD组间肝静脉闭塞、下腔静脉扩张发生率及侧支循环数比较,差异均有统计学意义(P<0.05,表2)。
2.2 CT强化特征 HVOD组患者CT平扫时肝实质多可见少许斑片状稍低密度。动脉期不均匀强化,低密度范围较平扫时范围增大。静脉期低密度范围进一步增大,斑片状强化区与低密度无强化区相间分布,呈“地图样”强化,部分病例呈弥漫分布累及全肝。延迟期时肝脏强化程度较门静脉期减低,低密度范围减小(图3)。BCS组患者上述平扫及三期强化表现类似,即肝脏三期不均匀强化范围差异无统计学意义(P>0.05,表2)。17例HVOD 患者表现为3 支肝静脉周围正常肝实质强化(“三叶草”样强化);而BCS组无一例出现“三叶草”样强化。HVOD组及BCS组均可出现“地图样”强化(图4、5)。
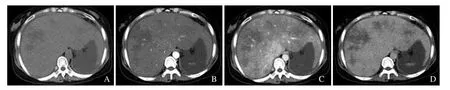
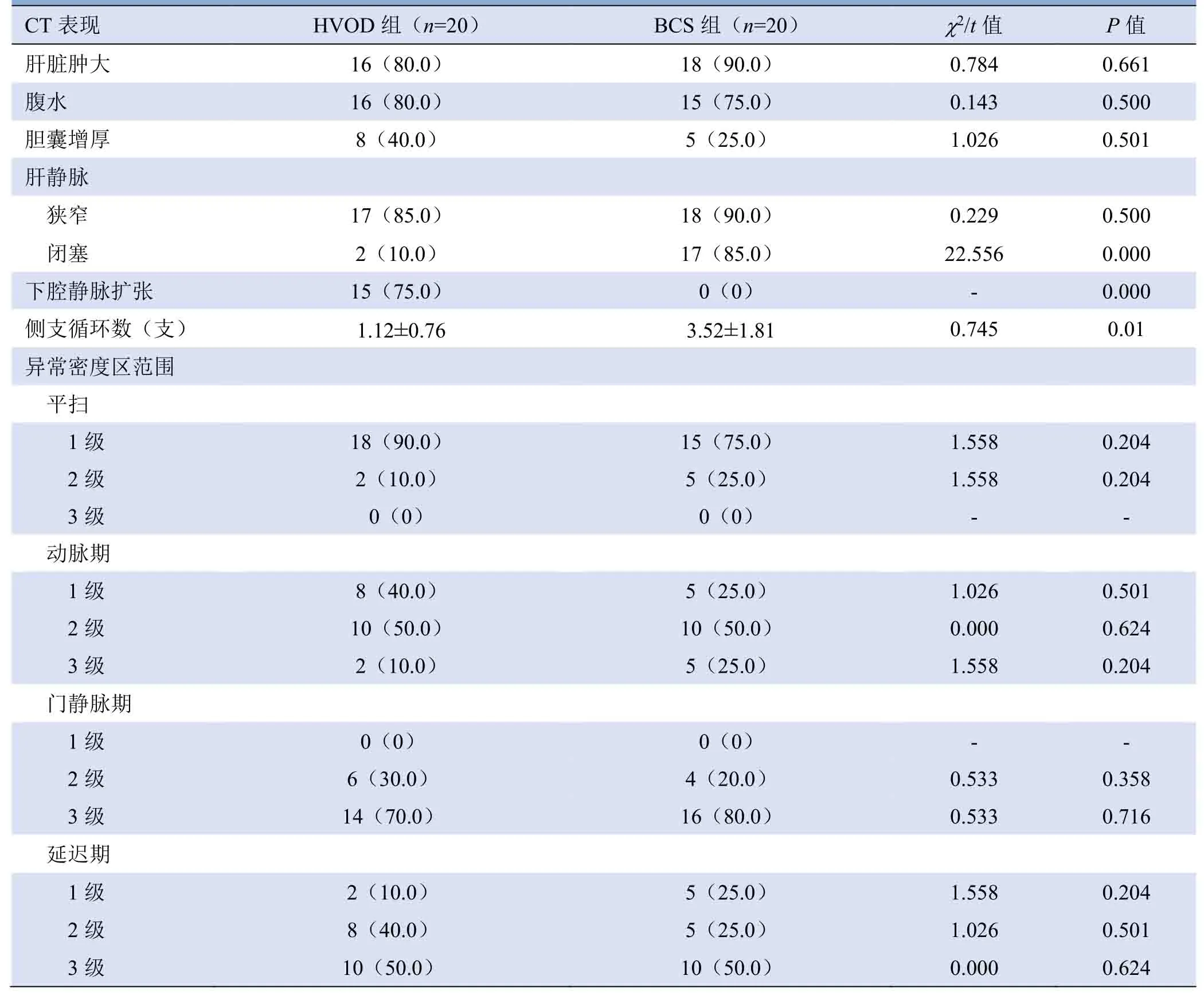
表2 HVOD组及BCS组的CT表现比较[例(%)]
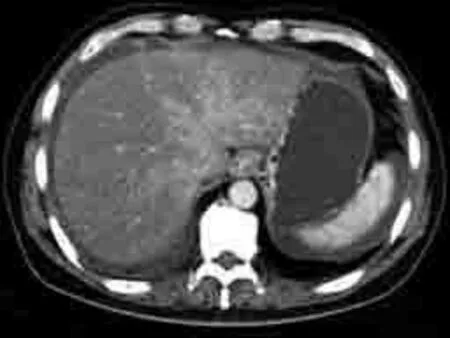
图4 女,49岁,HVOD。CT示“三叶草”强化

图5 男,66岁,BCS。CT示“地图样”强化
3 讨论
HVOD是由于肝小静脉纤维化,管腔狭窄、闭塞,从而导致其非血栓性阻塞,引起肝血流循环受阻,造成肝窦明显扩张淤血,致中央区肝细胞受压引起萎缩、变性、出血和坏死[6]。HVOD 临床少见,目前其发病机制尚未完全阐明,近年相关报道逐渐增多[7]。本病目前尚无特效疗法,早期诊断和及时治疗非常重要,临床首选对症治疗,多采取去除病因,对症、支持治疗,如立即停止服用“土三七”等药物、保肝、利尿、预防感染、改善微循环、促进肝细胞再生等。但若早期未能明确诊断而延误治疗,病情发展严重时可危及生命。
BCS是由于主肝静脉和(或)下腔静脉梗阻,造成肝后性静脉高压和下腔静脉回流障碍,导致肝脏损害[8]。由于缺乏特异性临床表现,临床漏诊、误诊较多。近年,随着影像学检查的迅速发展和CT 的普及,BCS 的检出率得到明显提高[9-10]。目前介入治疗是其首选方法。HVOD 和BCS 的发病机制相似,故临床表现类似;但治疗方案完全不同,因此对两者的准确鉴别具有重要意义。
本研究中,HVOD组16例患者有“土三七”或成分不明的中药史,对诊断具有重要的提示作用,与既往研究结论一致[11]。HVOD 目前已明确的病因为服用含吡咯里西啶类生物(pyrrolozidine alkaloids,PAs)的中草药植物,或应用抗肿瘤化疗药物和免疫抑制剂。在我国以服用中药“土三七”后出现症状为主。这是由于“土三七”中含有PAs 及分解产物,具有肝脏毒性作用,可损害肝功能。
本研究中,BCS组患者多伴有下肢水肿及下腔静脉梗阻的表现;而HVOD组则很少出现以上表现。此外,BCS组可发现肝静脉闭塞、下腔静脉管腔狭窄或闭锁梗阻远端下腔静脉扩张,下腔静脉压力明显增高,故侧支循环形成的数目较多;而HVOD组则无肝静脉或下腔静脉肝段梗阻,肝静脉可存在狭窄,但较少闭塞。这可能是由于肝窦阻塞和阻塞静脉回流及肝窦受阻以致肝实质肿胀压迫,故而形成侧支血管数量少于BCS组[6]。
由于HVOD 及BCS对肝损伤和肝窦压力增加的机制相同,主要原因为肝静脉狭窄、肝窦纤维化,导致肝窦血流受阻,窦内滤过压增高。同时,淋巴液生成过多、低蛋白血症等均可引起肝脏肿胀增大、腹水、黄疸、胆囊壁增厚等。本研究结果显示,以上征象在BCS 和HVOD组中差异均无统计学意义,与既往研究一致[12-13]。
BSC 增强扫描示动脉期以尾状叶为中心的区域强化比较明显。外周肝实质呈低密度,以后逐渐性均匀强化,逐渐成为等密度,此征象具有特征性,称为“中心扇样强化”[14]。但本研究中BCS组患者中该征象并不明显,推测与BCS 不同分型或病程有关。本研究发现“三叶草”样强化是HVOD 患者的特异性强化表现。这种强化指以第二肝门为中心,环绕三支肝静脉的强化。推测由于肝静脉周围有较多的细小引流静脉,使得血流动力学受影响较小而呈现出相对病变肝组织正常的强化。
本研究中,HVOD组及BCS组CT平扫肝实质均呈弥漫性或不规则的密度减低,动脉期开始出现不均匀强化,静脉期肝实质不均匀强化范围扩大,呈“地图状”增强改变,而3 支肝静脉变细或显示不清。延迟期强化范围较静脉期扩大,低密度区有一定的填充。Shulman 等[15]总结HVOD 患者肝组织标本的病理学特点发现,病变早期发生肝细胞缺血和损伤,中晚期发生肝细胞坏死,推测延期可填充的低密度区为早期仅发生肝细胞缺血和损伤的区域;而延迟期一直无法填充的区域可能已发生肝细胞坏死。本研究并未对此作深入探讨。此外,本研究中部分征象缺乏准确数值,主观因素明显,均有待扩大样本量进一步研究。
总之,HVOD 的诸多临床表现与BCS 相同,特别是均以门静脉高压为主要表现,患者性别、年龄、有无腹痛、腹胀、黄疸、临床表现以及三期强化范围变化均无鉴别价值,但有无服用“土三七”或中药史、下肢水肿需特别关注。此外,侧支循环数目、出现肝静脉闭塞、出现下腔静脉闭塞或狭窄的CT表现对两者的鉴别诊断具有重要价值。

