利多卡因抑制基质金属蛋白酶活性改善脂多糖诱导的小鼠急性肺损伤的机制研究
郑彬彬,张嘉男,范轶鑫,胡 亮,刘文涛,王雪融
(南京医科大学基础医学院,南京 210029)
脓毒症是一种由感染引起的全身性炎症反应综合征,可导致多器官损害并危及生命。而脂多糖(lipopolysaccharide,LPS)作为革兰阴性菌细胞壁外壁的组成成分,是诱导脓毒症产生的关键因素之一[1]。其中,急性肺损伤(acute lung injury,ALI)是脓毒症患者最常见的并发症及主要死亡原因[2],病死率高达30%~50%[3],是ALI患者需要重症监护住院和死亡的主要原因[4]。因此,寻找有效的治疗策略具有重要临床意义。
目前ALI的发病机制因其复杂性还未完全阐明。研究发现,ALI在分子水平上表现为多种炎性因子和炎症介质的过度释放、促炎-抗炎反应失衡,导致全身过度失控的炎症反应聚集在肺部[5]。研究证实,基质金属蛋白酶(matrix metalloproteinases,MMPs)在肺损伤的发病过程中发挥了重要的作用[6]。
MMPs是一类锌依赖的肽链内切酶,可由多种细胞产生并参与一系列生理过程,其中MMP-2和MMP-9是研究最多的两种。MMP-2和MMP-9目前已被发现在ALI、急性呼吸窘迫综合征(ARDS)、肺纤维化、疼痛和心肌间质重构中发挥重要作用[7-11]。有研究报道,脓毒性休克继发ARDS的患者支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中MMP-9水平高于正常对照组[12]。此外多篇研究还发现,MMPs抑制剂在肺损伤的实验模型中具有保护作用。例如,在LPS诱发的ALI动物实验中,多西环素可通过减弱MMP-9和MMP-2的活性改善肺损伤[13]。Carney等[14]在内毒素诱发ARDS的猪模型中也发现,预防性使用一种强效的MMPs抑制剂——化学修饰的四环素3(COL-3),通过降低LPS诱导的BALF中MMP-9和MMP-2浓度的增加减轻肺损伤。因此,MMP-9和MMP-2成为极具吸引力的靶标。但目前MMPs抑制剂的研究还处于发展阶段,其不良反应限制了它们的应用,尚无安全的MMPs抑制剂可以用于临床。
利多卡因是临床上常用的局麻药,广泛应用于局部神经阻滞和抗心律失常,价格便宜,安全度高。许多研究表明,利多卡因具有显著的抗炎作用。多项研究提示,利多卡因在ALI的动物模型中具有较好的组织保护作用,能够减轻高浓度氧和内毒素引起的肺损伤[15],但是机制不明。因此,本研究拟探讨利多卡因通过抑制血浆中MMP-9和MMP-2的活性而改善LPS诱导的ALI的可能性和作用机制。
1 材 料
1.1 药品与试剂
LPS(美国Sigma公司);盐酸利多卡因注射液(湖北天药药业股份有限公司);β-actin抗体(鼠源,1∶1 000稀释)(美国Santa Cruz公司);兔源p-p38 抗体(1∶1 000稀释);羊抗兔二抗(1∶4 000稀释)、羊抗鼠二抗(1∶4 000稀释)(美国Cell Signaling Technology公司);一次性使用抗凝管(含EDTA·K2,江苏新康医疗器械有限公司);其他化学试剂均来源于上海沪试公司。
1.2 仪 器
MiniProtean 4电泳仪、Quantity One 4.6.5分析软件、ChemiDoc XRS+化学发光仪(美国Bio-Rad公司);超纯水机(UPH-IV-10T,成都超纯科技有限公司)。
1.3 动 物
健康成年雄性ICR小鼠,清洁级,体质量(20±2)g,8~9周龄,由上海西普尔-必凯实验动物有限公司提供,合格证号:20180006007607,使用许可证号:SCXK(沪)2018-0006。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 动物分组及给药
将雄性ICR小鼠随机分为空白对照组、急性肺损伤模型组、模型利多卡因治疗组(2、4和8 mg/kg 3种剂量)、单独给予利多卡因组(8 mg/kg,iv),每组8只。空白对照组不作任何处理。急性肺损伤模型组:腹腔注射LPS 10 mg/kg;模型利多卡因治疗组:造模前30 min分别尾静脉注射2、4和8 mg/kg 3种剂量的利多卡因,每12小时1次,连续注射3 d;单独给予利多卡因组:在基础情况下尾静脉注射8 mg/kg利多卡因,每12小时1次,连续注射3 d。按照实验需求,分别观察小鼠7 d生存率。
2.2 肺的湿重/干重比
为了进一步研究利多卡因在ALI中作用,取18只ICR小鼠,分组同上,尾静脉注射不同剂量的利多卡因(2、4和8 mg/kg)预处理30 min后,再腹腔注射LPS刺激12 h诱导ALI[16]。小鼠经颈动脉采血处死后,开胸取左右两肺,吸干表面水分,去除支气管后称湿重,再置60 ℃烘箱中干燥72 h至重量不再变化,称干重,计算肺组织湿重/干重比,估计肺组织的水肿程度。
2.3 Western blot 法检测p-p38蛋白的变化情况
提前30 min尾静脉注射不同剂量的利多卡因(2、4和8 mg/kg)后,给予小鼠LPS造模12 h,使用1%戊巴比妥腹腔注射麻醉(100 mg/kg),左肺上部切取一小块组织。按每20 mg肺组织加入RIPA强裂解液150 μL,处理样品,采用 BCA蛋白浓度测定试剂盒测定蛋白浓度。经聚丙烯酰胺凝胶电泳分离蛋白,并转移至PVDF膜上,5% BSA封闭液室温封闭2 h,加入抗p-p38的一抗(1∶1 000),4 ℃摇晃过夜,TBST洗3次,每次10 min,加入二抗,室温孵育2 h,TBST洗3次,每次10 min,显色。以β-actin(1∶5 000)为内参。采用Quantity One软件进行数据分析。
2.4 明胶酶谱法检测MMP-9和MMP-2的活力
利多卡因(2、4和8 mg/kg,iv)提前0.5 h给药后,小鼠腹腔注射LPS,经12 h后,眼眶取血,3 000 r/min,4 ℃,离心10 min取上层血浆。用超纯水稀释30倍后,加上样缓冲液,涡旋混匀,在分离胶中加入0.1%明胶,进行聚丙烯酰胺凝胶电泳,并对分离胶进行洗脱、孵育,用1%考马斯亮蓝染色,经脱色后,使用化学发光仪采集图像。
2.5 数据统计

3 结 果
3.1 利多卡因对LPS介导的小鼠急性肺损伤生存率的影响
如图1所示,利多卡因能有效提高ALI小鼠生存率。LPS组和LPS+2 mg/kg利多卡因组小鼠4 d内全部死亡。但当小鼠分别接受4和8 mg/kg利多卡因处理时,7 d生存率显著提高。其中8 mg/kg剂量组7 d生存率达到37.5%,而单独给予利多卡因则不会引起小鼠死亡。

Figure1 Effects of lidocaine on survival rate of acute lung injury (ALI) mice.Pretreatment with lidocaine could significantly increase the survival rate of ALI mice (n=8)
LPS:Lipopolysaccharide
3.2 利多卡因对肺组织湿/干重比的影响
各组小鼠72 h肺组织湿/干重比(W/D)变化如图2所示。与对照组相比,LPS组小鼠的肺组织湿/干重比明显增大。与LPS组相比,利多卡因给药组的肺组织湿/干重比减小,其中利多卡因8 mg/kg 剂量组的肺组织湿/干重比与LPS组相比显著降低(P<0.05)。

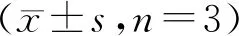
*P<0.05vscontrol group;#P<0.05vsLPS group
3.3 利多卡因对ALI小鼠肺组织p38磷酸化水平的影响
如图3所示,与对照组相比,LPS(给药后12 h)能够显著增加p38的磷酸化水平,而利多卡因能够剂量依赖性地抑制急性肺损伤后小鼠肺部p-p38的高表达(与LPS组相比,P<0.05),其中8 mg/kg利多卡因抑制作用最为显著。
3.4 利多卡因对ALI小鼠血浆中MMP-9和MMP-2活性的影响
由图4可知,LPS组小鼠血浆中MMP-9和MMP-2的活性显著升高(与空白对照组相比,P<0.05)。而尾静脉注射8 mg/kg利多卡因能够显著抑制小鼠血浆中MMP-9和MMP-2的活性(与LPS组相比,P<0.05),其对MMP-9和MMP-2的抑制率分别为74%和30%。

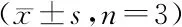
***P<0.001vscontrol group;##P<0.01vsmodel group

Figure4 Effects of lidocaine on MMP-9 and MMP-2 activity in plasma.
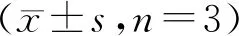
***P<0.001vscontrol group;#P<0.05,##P<0.01,###P<0.001vsmodel group
4 讨 论
ALI是脓毒症发病时出现最早、发生率最高的并发症,可导致威胁生命的呼吸衰竭,病死率极高。目前针对脓毒症肺损伤的主要治疗措施包括早期目标治疗、肺保护性通气治疗、小剂量糖皮质激素治疗、抗凝治疗、吸入一氧化氮等血管扩张剂治疗等,但其病死率仍居高不下。有研究表明,利多卡因预先给药能够减轻内毒素性急性肺损伤[15],但机制不明。在本研究中,使用腹腔内注射LPS诱导ALI小鼠模型来研究利多卡因对ALI的影响。结果发现利多卡因显著提高了小鼠存活率,减轻了肺水肿,并剂量依赖性地下调p-p38、MMP-9和MMP-2等促炎性介质的水平。结果表明,利多卡因对LPS诱导的ALI小鼠具有保护作用。
过去的研究发现,在脓毒症诱导的肺损伤中,中性粒细胞大量浸润,并显著激活MMP-9[17]。在本实验中,给予LPS后能够显著提高小鼠血浆中MMP-9和MMP-2的活性。前期的研究表明,MMP-9在肺组织中浓度越高,肺损伤度也越严重,而MMPs抑制剂在肺损伤的实验模型中具有保护作用[13-14]。本课题组已经证明,给予MMP-9抑制剂多西环素可以改善百草枯导致的急性肺损伤[7]。这些研究均说明MMP-9和MMP-2与ALI/ARDS的发病机制密切相关。
本研究还发现,利多卡因能够显著抑制LPS诱导的MMP-9和MMP-2的活性上升,并且对MMP-9的抑制效果要优于MMP-2。根据实验室之前的研究[7],推测MMP-9可能主要参与了LPS诱导的急性肺损伤期,而MMP-2主要参与了之后的修复和纤维化期。以往的研究也发现,利多卡因能够负性调节LPS介导的Toll样受体4(Toll-like receptors 4,TLR4)信号的激活,而TLR4信号的激活是给予LPS后快速诱导p-p38表达水平增加的核心机制[18]。本研究结果发现,利多卡因能够剂量依赖性抑制LPS诱导的肺组织中p-p38的激活。提示利多卡因可能通过抑制TLR4信号,进而抑制MMP-9和MMP-2的激活从而改善脓毒症诱导的急性肺损伤。
利多卡因属于酰胺类局部麻醉药,在种类繁多的抗心律失常药物分类中属于轻度阻滞Na离子通道的Ⅰb类药物。近年来由于对其药理作用的深入研究,使其在临床许多学科中的应用有了新进展。例如治疗哮喘持续状态、癫痫、惊厥、脑缺血与脑保护、呃逆等。目前临床应用利多卡因抗心律失常的推荐剂量为首次剂量1.0~1.5 mg/kg静脉注射,若需第2次给药,剂量为0.50~0.75 mg/kg[19]。经过换算,最高给药剂量在临床给药范围内,具有较好的安全性。
综上所述,利多卡因能够通过抑制血浆中MMP-9和MMP-2的活性减轻LPS诱导的小鼠急性肺损伤,提示其在临床上可能具有抗急性肺损伤的作用,为临床预防和治疗ALI提供了新的思路。

