美洲型猪繁殖与呼吸综合征病毒实时荧光RT-PCR 定量检测试剂盒测量不确定度研究
(北京市动物疫病预防控制中心,北京 102629)
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的,以母猪繁殖障碍和各生长阶段猪群呼吸道疾病为特征的,严重影响全球养猪业的病毒性传染病[1],在我国俗称“猪蓝耳病”。该病最初在北美和欧洲暴发,至今已有近30 年的流行历史,且在许多养猪国家呈地方性流行[2]。每年给全世界养猪业造成的损失高达几十亿美元,成为世界兽医学界近年来重点关注的疫病之一[3]。目前,实验室中的PRRSV 病原学检测通常采用实时荧光RT-PCR 方法进行,但不同厂家试剂盒的结果判定标准不一,被检样品判定为可疑的区间跨度较大,如被检样品在可疑区间出现特定的扩增曲线,就需重新取样提取RNA,扩增后再进行结果判定,如仍是可疑,则可判定为阳性,由此导致的不确定度因素太大,给实验室工作人员造成了不必要的重复与对结果判定的困扰。因此,亟需建立一种更为客观、准确的判定方法,对可疑区域进行精确判定。
测量不确定度是与测量结果关联的一个参数,用于表征合理赋予被测量值的分散性[4]。它既可以用于“不确定度”方式,也可以作为一个标准偏差(或其给定的倍数)或给定置信度区间的半宽度。测量不确定结果的表达应包括不确定度U,置信概率P(或包含因子)、自由度、包含因子K以及被测量的最佳估计值(或约定真值)。即X=±U,P,K[5]。《检验检测机构资质认定能力评价检验检测机构通用要求》(RB/T 214—2017)[6]指出:检验检测机构应根据需要,建立和保持应用评定测量不确定的程序;检验检测机构申请资质认定的检验检测项目中,相关检验检测方法有测量不确定度的要求时,检验检测机构应建立和保持应用评定测量不确定度的程序,应建立相应数学模型,给出相应检验检测能力的评定测量不确定度案例;鼓励检验检测机构在测试出现临界值,进行内部质量控制或客户有要求时,采用测量不确定度方法。为填补测量不确定度在兽医领域的空白,本研究通过对市售的3 种美洲型PRRSV 实时荧光定量RT-PCR 检测试剂盒进行测量不确定度分析,建立3 种试剂盒的测量不确定度评估模型[7],以期为动物疫病检测实验室出具更加客观的检测结果提供支持。
1 材料与方法
1.1 试验材料
3 种美洲型PRRSV 实时荧光定量RT-PCR 检测试剂盒(A、B、C),购自北京市市场;4 种核酸提取试剂盒(D、E、F、G),购自北京市市场,其中D、E 为磁珠法机提试剂盒,F、G 为柱式手提试剂盒;RNase-free Water,购自北京全式金生物技术有限公司;反转录试剂盒,购自宝日医生物技术(北京)有限公司;美洲型PRRSV变异株(JXA1)核酸标准物质,购自北京世纪元亨动物防疫技术有限公司,证书编号GBW(E)090929。
1.2 仪器设备
荧光定量PCR 仪,购自ABI 公司;TGuide S32 全自动核酸提取纯化仪,购自天根生化科技有限公司;移液器,购自德国Eppendorf 公司;Nano Drop 微量核酸蛋白浓度测定仪,购自赛默飞世尔科技(中国)有限公司。
1.3 试验方法
1.3.1 标准曲线建立 将美洲型PRRSV 变异株(JXA1)核酸标准物质(105copies/μL)按1:10倍比稀释至1:106。根据3 种试剂盒说明书进行实时荧光定量RT-PCR 检测,每个稀释度做6 个平行,记录最低检出限所对应的Ct 值;以DNA 拷贝数为横坐标,Ct 值为纵坐标,绘制标准曲线。
1.3.2 测量不确定度模型建立 移液器校准(C)产生的测量不确定度为u(C),根据移液器校准证书与3 种试剂盒说明书中使用的液体体积计算;温度效应(T)产生的测量不确定度为u(T),根据实验室温度与水的膨胀系数计算;重复性测量引入的测量不确定度为u(S),根据公式(1),对3 种试剂盒最低检出限的6 个重复性检测结果进行计算。
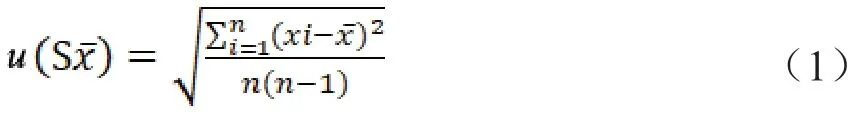
1.3.3 核酸提取试剂盒的选择与性能评估 对不同厂家的核酸提取试剂盒进行科学评估,利用PRRSV JXA1 株核酸标准物质1:10 倍比稀释至1:104;每个稀释度做2 个重复,分别利用4 种核酸提取试剂盒,对每个稀释度标准物质进行核酸提取,然后进行PRRSV 荧光定量PCR 检测,比对Ct 值与扩增曲线。
1.3.4 使用RNA 反转录试剂对检测结果的影响评估 由于购买的3 种荧光定量RT-PCR 检测试剂盒都是一步法操作,即可直接以提取的PRRSV RNA 为模板进行体系扩增,且在试剂盒反应试剂中包含反转录成分,因此本研究使用反转录试剂盒,对提取的PRRSV RNA 先反转录成cDNA,再利用3 种荧光定量RT-PCR 检测试剂盒进行扩增,比对两种方法对检测结果产生的差异。利用3 种核酸提取试剂盒,对每个稀释度标准物质进行核酸提取,反转录成cDNA,然后进行PRRSV 荧光定量RT-PCR 检测,比对Ct 值与扩增曲线。反转录体系如下:在1.5 mL 离心管中,加入8 μL RNA、1 μL DNTP、1 μL Oligo(dT)。65 ℃ 5 min,冰浴3 min;加入4.5 μL ddH2O、4 μL 5×Buffer、1 μL M-mlv、0.5 μL RNase Inhibitor;42 ℃ 1 h,70 ℃15 min;收集cDNA 并保存于-20 ℃冰箱。
2 结果
2.1 试剂盒标准曲线
将美洲型PRRSV 变异株(JXA1)核酸标准物质(105copies/μL)进行1:10 倍比稀释,用3 种美洲型PRRSV 实时荧光定量RT-PCR 检测试剂盒进行PCR 扩增,绘制标准曲线。从图1 可以看出,试剂盒A 的标准曲线为y=-3.936 2x+33.195(R²=0.999 0);从图2 可以看出,试剂盒A 扩增曲线良好,可以检测到10 copies/μL,在1 copies/μL 有典型扩增曲线,但试剂盒判定为可疑区域,标准物质最低检出限为1 copies/μL。从图3 可以看出,试剂盒B 的标准曲线为y=-5.048 3x+40.140(R²=0.993 4)。从图4 可以看出,试剂盒B 的扩增曲线良好,可以检测到102copies/μL,在10 copies/μL 有典型扩增曲线,但试剂盒判定为可疑,标准物质最低检出限为10 copies/μL。从图5 可以看出,试剂盒C 的标准曲线为y=-9.951 8x+60.365(R²=0.997 5)。从图6 可以看出,试剂盒C 的扩增曲线良好,可以检测到103copies/μL,标准物质最低检出限为103copies/μL 。
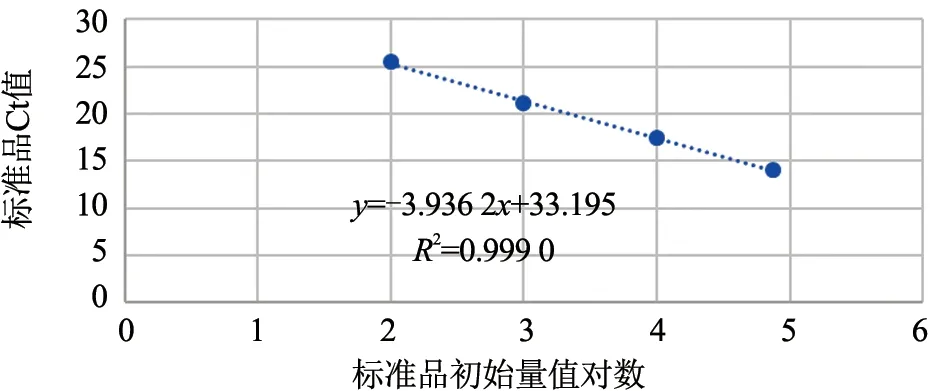
图1 试剂盒A 标准曲线
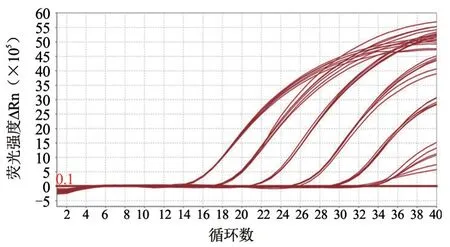
图2 试剂盒A 扩增曲线
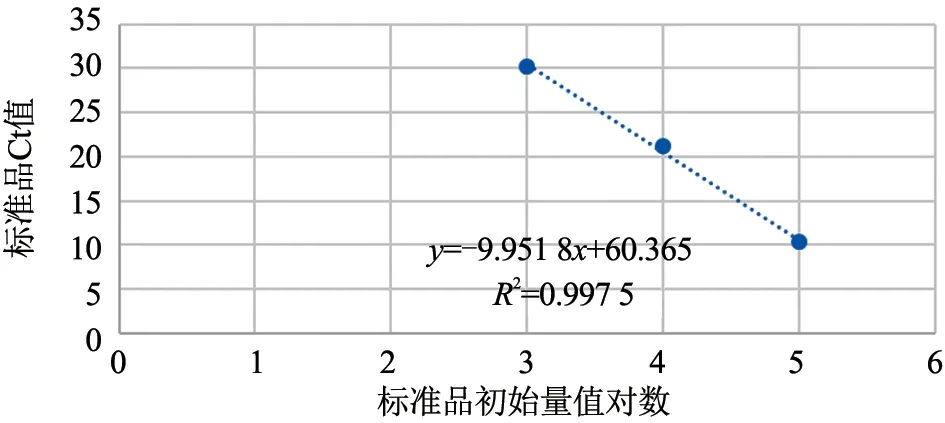
图5 试剂盒C 标准曲线
2.2 3 种试剂盒测量不确定度评估模型
2.2.1 移液器校准(C)产生的测量不确定度u(C)试剂盒A 与试剂盒B 均使用23 μL 扩增反应液加2 μL 模板(共25 μL)体系。移液器校准证书指出,使用23 μL 量程移液器的最大容许误差为±0.8 μL,按矩形分布处理,校准引入的标准不确定度为;使用2 μL 量程移液器最大容许误差为±0.24 μL,按矩形分布处理,校准引入的标准不确定度为。试剂盒C 使用20 μL 扩增反应液加5 μL 模板(共25 μL)体系。移液器校准证书指出,使用20 μL 量程移液器最大容许误差为±0.8 μL,按矩形分布处理,校准引入的标准不确定度为,使用5 μL 量程移液器最大容许误差为±0.4 μL,按矩形分布处理,校准引入的标准不确定度为u(C)。
2.2.2 温度效应(T)产生的测量不确定度u(T)考虑实验室温度对移液器加液体积的影响,测定实验室的温度在(20±4)℃之间波动,水的膨胀系数为2.1×10-4/℃,按矩形分布,使用23 μL 量程移液器由温度效应引入的标准不确定度u(T)=23×4×2.1×10-4=0.019 μL;同理,使用2 μL 量程移液器的u(T)=0.001 68 μL,使用20 μL 量程移液器的u(T)=0.016 8 μL,使用5 μL 量程移液器的u(T)=0.004 2 μL。
2.2.3 重复性测量引入的测量不确定度u(S)对3 种试剂盒最低检出限的6 个重复性检测结果代入公式(1),计算重复性测量引入的不确定度。试剂盒A 最低检出限Ct 平均值,代入公式得到;试剂盒B 最低检出限Ct平均值,代入公式得到;试剂盒C 最低检出限Ct 平均值,代入公式得到。
2.2.4 合成标准测量不确定度 由于移液器校准和温度效应是2 个相互独立的分量,因此23 μL反应体系引起的标准合成不确定度u(V1)=,2 μL 模板引起的标准合成不确定度u(V2)=,移液器与温度产生的合成不确定度。试剂盒A 重复性测量引入的测量不确定度=0.2443,试剂盒A 的合成标准测量不确定度=0.5403;取k=2,UA=2×uA=1.080 6(置信水平P=0.95),。同理,试剂盒B 的合成标准测量不确定度=0.540 5;取k=2,UB=2×uB=1.081(置信水平P=0.95),。试剂盒C 的合成标准测量不确定度uC==0.540 5;取k=2,UB=2×uB=1.081(置信水平P=0.95),。20 μL 反应体系引起的标准合成不确定度u(V1)=,5 μL 模板引起的标准合成不确定度u(V2)=,移液器与温度产生的合成不确定度u(V3)=。试剂盒C 重复性测量引入的测量不确定度=0.277,试剂盒C 的合成标准测量不确定度;取k=2,Uc=2×uC=1.171(置信水平P=0.95),。
2.3 核酸提取试剂盒选择与评估
筛选不同厂家的核酸提取试剂盒,将美洲型PRRSV 变异株(JXA1)核酸标准物质(105copies/μL)1:10 倍比稀释至1:104后进行核酸提取,并用微量核酸蛋白浓度测定仪,对PRRSV 原液RNA 浓度进行测定:核酸提取试剂D 提取的RNA 浓度为40.16 ng/μL,核酸提取试剂E 为20.54 ng/μL,核酸提取试剂F 为35.76 ng/μL,核酸提取试剂G 为33.08 ng/μL。使用试剂盒A 进行PCR 扩增反应,结果见表1。核酸提取试剂D 提取RNA 可检测到1:104浓度,且Ct 值较其他厂家提取试剂盒靠前,效果最佳。核酸提取试剂D 提取RNA 效率最高,4 个厂家核酸提取试剂盒PCR 扩增曲线见图7。
2.4 使用RNA 反转录试剂对检测结果的影响
使用TAKARA 反转录试剂盒,对核酸提取试剂D、E、F、G提取的PRRSV RNA进行反转录反应,反转录成cDNA,并用微量核酸蛋白浓度测定仪,对反转录后PRRSV 原液cDNA 浓度进行测定,发现核酸提取试剂D 提取的cDNA 浓度为40.08 ng/μL,核酸提取试剂E 为20.28 ng/μL,核酸提取试剂F为32.88 ng/μL,核酸提取试剂G 为32.96 ng/μL。使用试剂盒A 进行PCR 扩增反应,结果见表2。核酸提取试剂D 提取cDNA 的效率最高,PCR 扩增曲线见图8。
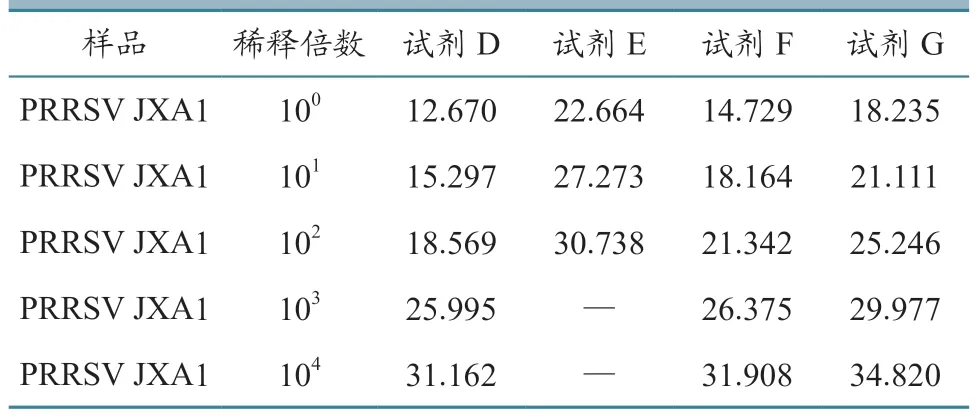
表1 不同核酸提取试剂的核酸qPCR Ct 值

图7 4 种核酸提取试剂盒扩增曲线

图8 4 种核酸提取试剂盒反转录后扩增曲线
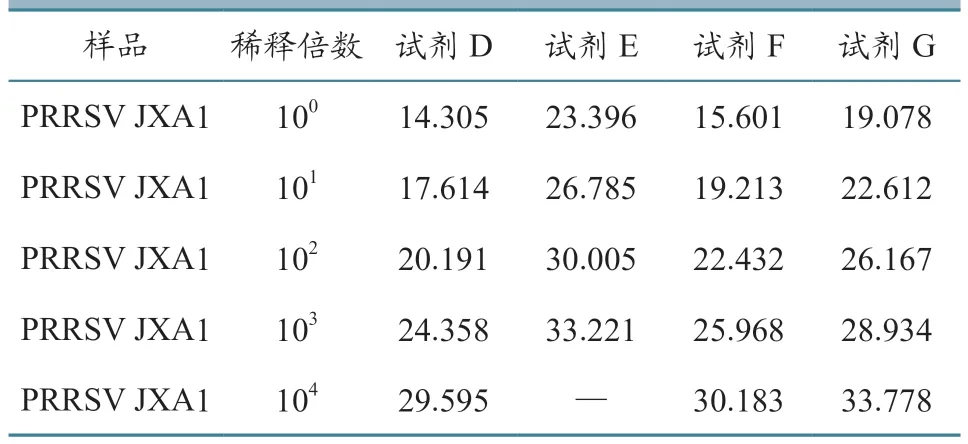
表2 不同核酸提取试剂反转录后的核酸qPCR Ct 值
3 讨论
测量不确定度评估是兽医领域实验室认可质量提升的制约因素。兽医实验室评估测量不确定度,重在应用[8]。本研究的PRRSV RT-PCR 定量检测试剂盒测量不确定度评估结果可以作为实验室控制检测结果质量的一种手段,当样品落在临界值时,可以用已建立的模型进行辅助判断。
本研究填补了兽医领域在动物疫病检测过程中出具测量不确定度报告的空白,利用美洲型PRRSV 变异株(JXA1)核酸标准物质,对市售的3种PRRSV检测试剂盒分别测量了不确定度评估,发现3 种试剂盒存在敏感性差异:试剂盒A 可以检测到10 copies/μL,在1 copies/μL 判定为可疑;试剂盒B 可以检测到102copies/μL,在10 copies/μL判定为可疑;试剂盒C 可以检测到103copies/μL。3 种试剂盒对样品可疑区域判读存在差异:试剂盒A 在30 <Ct <37 判为可疑,建立的测量不确定度模型为;试剂盒B 在30 <Ct <37 判为可疑,建立的测量不确定度模型为;试剂盒C 在30 <Ct <35 判为可疑,建立的测量不确定度模型为。可以看出,虽然3 种试剂盒自身存在敏感性差异,但本研究根据每个试剂盒建立了测量不确定度模型,缩小了试剂盒判定为可疑的区域,实现了对样品的精准判读。
移液器引入的测量不确定度大小与移液器的检定校准与加样体积有关,按照《移液器检定规程》(JJG 646—2006),实验室每年应定期对移液器进行检定校准[9]。本研究对3 种试剂盒2 种反应体系中移液器引入的测量不确定度进行了评估,发现23 μL+2 μL 体系移液器引入的测量不确定度=0.482 μL,20 μL+5 μL 体系移液器引入的测量不确定度u(20 μL+5 μL)=0.517 μL。因此,在实验室检测过程中,加样体积与Ct 值存在一定关系,需要考虑移液器带来的测量不确定度影响。
本研究探究了使用反转录试剂将RNA 反转录为cDNA 进行试剂盒扩增反应,与直接核酸提取RNA 进行试剂盒扩增对比。购入的3 种PRRSV荧光RT-PCR 检测试剂盒均为一步法提取,逆转录酶与PCR 反应体系在同一反应液中[10]。PRRSV JXA1 株标准物质依次稀释至1:1、1:10、1:100 倍时,未进行反转录试剂盒的核酸比进行反转录试剂盒反应的核酸扩增Ct 值小,出峰时间提前,但稀释到1:103与1:104浓度时,未进行反转录试剂盒的核酸比进行反转录试剂盒反应的核酸Ct 值大,出峰时间靠后。核酸提取试剂提取效率越高,荧光定量PCR Ct 值越靠前。分析原因可能为进行二次逆转录反应使逆转录效率变高[11],因而增加了标准物质稀释到1:103与1:104浓度的cDNA扩增效率。该结果为今后实验室的检测结果判读奠定了基础。
4 结论
本研究对市售的3 个厂家的PRRSV 实时荧光定量RT-PCR 检测试剂盒建立了测量不确定度评估模型,计算出试剂盒A 的测量不确定度模型为=33.218±1.080 6(P=0.95),试剂盒B 为=37.73±1.081(P=0.95),试剂盒C 为=30.22±1.171(P=0.95)。本研究利用建立的测量不确定度模型,对试验过程中移液器、温度、重复性测量环节进行了不确定度分析,认为移液器与重复性测量对试验结果产生的不确定度影响较大,在今后的实验室检测中应引起重视,需规范操作。同时,缩小了试剂盒对可疑样品的判定区域,对于样品临界参考值的检测结果判定具有实际意义。通过比对不同厂家核酸提取试剂,筛选出提取效率最高的试剂盒,使病毒核酸吸取更加均匀,试验结果更加稳定。本研究建立的病原学检测测量不确定度模型为兽医实验室检测结果不确定度评估及应用奠定了基础。

