氢分子对高脂饮食C57BL/6小鼠肝脏保护作用及其分子机制的研究
骆莹莹,袁点,骆倩倩,吴秀秀,王大新
(1.江苏省苏北人民医院 a.心功能检查科,b.实验中心,江苏 扬州 225009;2.滨州医学院实验教学管理中心,山东 烟台 264003)
21世纪以来,随着生存环境及人们生活方式的变化,全球肥胖的发生率呈上升趋势,与肥胖相关疾病(动脉粥样硬化、脂肪肝、2型糖尿病、高血压、胆石症等)的患病率也急剧升高,成为严重危害人类健康的重大公共卫生问题[1]。肥胖主要表现为体内脂肪堆积过多和(或)分布异常、体重增加和能量代谢平衡失调,肝脏是机体调控糖脂代谢的主要器官,在肥胖症的发生、发展过程中具有重要作用[2]。研究发现,大约80%的肥胖症患者存在非酒精性脂肪肝[3]。肝脏通过多种途径和多种反应通路调节脂代谢,机体脂质含量过多时引起肝脂代谢紊乱,脂肪在肝脏堆积,损害肝脏的抗氧化系统,导致脂质过氧化,引起氧化应激损伤和炎症因子的释放,进一步加重肝脏的损伤和与其相关疾病的发生,形成恶性循环,即目前的“二次打击学说”机制[4-5]。
氢分子被认为是一种新型抗氧化剂,与维生素C或维生素E等其他抗氧化剂相比,氢分子呈电中性,且更小,迅速扩散到组织和细胞,并且能够选择性减少氧化应激中具有细胞毒性化学物质,如羟基自由基和过氧亚硝基阴离子[6]。研究表明,氢分子作为一种抗氧化剂,不仅可以减少氧化应激,还可通过调脂、抗炎、抗凋亡等多种途径发挥生物效应[7]。本研究主要探讨氢分子对高脂饮食C57BL/6小鼠肝脏的保护作用及其分子机制。
1 材料与方法
1.1实验动物和仪器 清洁级4周龄健康雄性C57BL/6小鼠50只,体重(13.2±0.9)g,由扬州大学农学院提供[合格证号scxk(苏2012-0004)]。富氢水购自北京活力氢源生物科技有限公司,4 ℃保存。Tecan Infinite F200/M200型多功能酶标仪(瑞士TECAN公司);电子天平PL-203[梅特勒-托利多仪器(上海)有限公司];超声细胞粉碎机JY92-IIn(宁波新芝生物);台式高速冷冻离心机Neofuge 15R[力康生物医疗科技控股有限公司力新仪器(上海)有限公司];纯水仪FBZ2001-UP-P(青岛富勒姆科技);涡旋混合器TYXH-II(南京天悦电子技术有限公司);超低温冰箱DW-86L626(海尔集团公司);水浴锅TL-420D(姜堰市天力医疗器械厂有限公司);微量紫外分光光度计GENE QUANT 100(美国GE公司);莱卡烤片机RM2145型(德国莱卡设备有限公司);石蜡切片机RM2145型(德国莱卡设备有限公司);光学显微镜BX51型(日本Olympus公司)。
1.2方法
1.2.1模型制备与实验分组 4周龄C57BL/6健康雄性小鼠50只,放置23 ℃、通风条件良好、50%湿度及12 h昼夜交替照明时间的动物房内,分笼喂养、给予高脂饮食适应喂养1周,剔除体重增长不明显的小鼠,选取平均体重增长率一致的小鼠20只,依据随机数字法分为富氢水组和对照组,每组10只,并继续给予高脂饮食。每日下午17:00 富氢水组腹腔注射富氢水10 mL/(kg·d),对照组注射0.9%氯化钠溶液10 mL/(kg·d),共计8周,每周更换一次新的玉米芯垫料,固定时间称量小鼠体重。处死小鼠前12 h禁食,自由饮水,更换新垫料。内眦取血,离心后取上清得到小鼠血浆,分装保存;取小鼠肝脏,应用预冷0.9%氯化钠溶液清洗杂物,平均取三份放于冻存管内迅速置于液氮中速冻,剩余一份用4%多聚甲醛固定。
1.2.2小鼠体重增长率的测定 小鼠体重增长率=(实验结束时体重-实验前体重)/实验前体重。
1.2.3小鼠血脂指标测定 采用酶比色法检测两组小鼠血浆总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平。操作过程严格参照TC、TG、LDL-C和HDL-C试剂盒(南京中生北控生物科技有限公司)说明书进行。
1.2.4小鼠氧化指标测定 采用黄嘌呤氧化酶法测定两组超氧化物歧化酶(superoxide orgotein dismutase,SOD)的活力;采用硫代巴比妥酸比色法测定丙二醛(malondialdehyde,MDA)水平。操作过程严格参照MDA和SOD试剂盒(南京建成生物科技有限公司)说明书进行。
1.2.5肝脏细胞学形态观察 取小鼠肝组织,行4%多聚甲醛固定,常规包埋、切片后进行苏木精-伊红染色(hematoxylin and eosin staining,HE),各组随机选取5只小鼠的玻片于100倍和400倍倒置显微镜下随机选取3~5个视野,观察肝脏细胞学形态变化。
1.2.6小鼠肝组织炎症因子蛋白含量测定 采用酶联免疫吸附试验法测定两组小鼠肝组织中白细胞介素(interleukin,IL)-6、IL-8、IL-10及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的蛋白含量,严格参照组织IL-10酶联免疫吸附试验试剂盒(上海朗顿生物科技有限公司),IL-6、IL-8、和TNF-α酶联免疫吸附试验试剂盒(上海丰翔生物科技有限公司)进行操作。
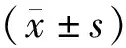
2 结 果
2.1两组小鼠体重增长率的比较 富氢水组小鼠体重增长率低于对照组[(0.73±0.06)%比(1.06±0.09)%](t=9.638,P<0.001)。
2.2两组小鼠血脂指标比较 富氢水组TC、TG、LDL-C水平低于对照组(P<0.05),HDL-C水平高于对照组(P<0.001),见表1。
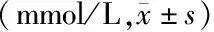

组别只数TCTGLDL-CHDL-C对照组 104.61±0.791.13±0.204.45±0.863.71±0.30富氢水组103.11±0.340.92±0.233.07±0.466.74±0.96t值4.3672.2164.0756.437P值0.0010.0400.001<0.001
TC:总胆固醇;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;对照组:高脂饮食+腹腔注射0.9%氯化钠溶液10 mL/(kg·d);富氢水组:高脂饮食+腹腔注射富氢水10 mL/(kg·d)
2.3两组小鼠氧化指标比较 富氢水组MDA低于对照组,SOD显著高于对照组(P<0.001),见表2。
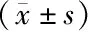
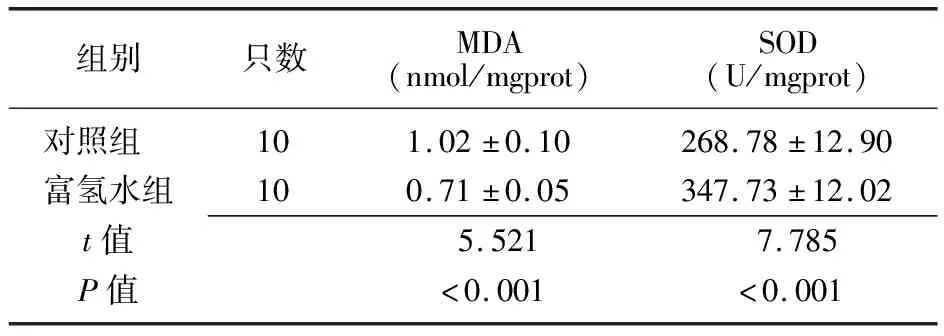
组别只数MDA(nmol/mgprot)SOD(U/mgprot)对照组 101.02±0.10268.78±12.90富氢水组100.71±0.05347.73±12.02t值5.5217.785P值<0.001<0.001
MDA:丙二醛;SOD:超氧化物歧化酶;对照组:高脂饮食+腹腔注射0.9%氯化钠溶液10 mL/(kg·d);富氢水组:高脂饮食+腹腔注射富氢水10 mL/(kg·d)
2.4肝脏HE染色 HE染色结果显示,富氢水组小鼠肝组织完整,肝索排列整齐,肝窦正常,肝细胞未有明显损伤,核结构非常清晰;对照组小鼠肝索排列较为紊乱,一半以上区域有脂肪浸润现象,并有明显的脂肪滴显现,肝细胞体积增大,细胞核被推向周边。见图1。
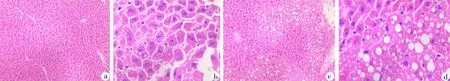
HE:苏木精-伊红染色;a.富氢水组小鼠脂肪组织HE染色图片(100×);b.富氢水组小鼠脂肪组织HE染色图片(400×);c.对照组小鼠脂肪组织HE染色图片(100×);d.对照组小鼠脂肪组织HE染色图片(400×)
图1 富氢水组和对照组小鼠脂肪组织HE染色图片
2.5两组小鼠炎症因子蛋白含量的比较 富氢水组IL-6、IL-8、TNF-α低于对照组,IL-10高于对照组(P<0.05),见表3。
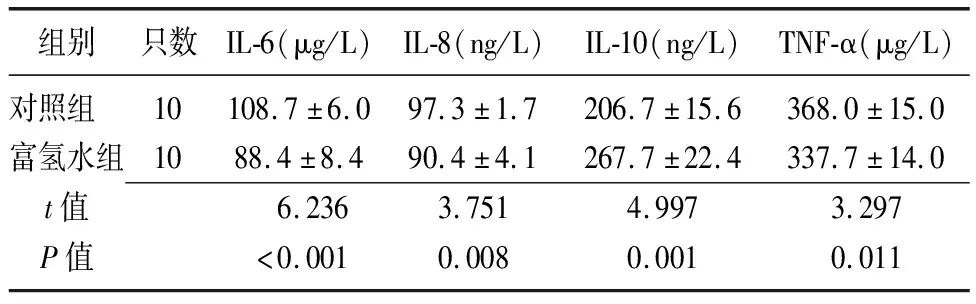
组别只数IL-6(μg/L)IL-8(ng/L)IL-10(ng/L)TNF-α(μg/L)对照组 10108.7±6.097.3±1.7206.7±15.6368.0±15.0富氢水组1088.4±8.490.4±4.1267.7±22.4337.7±14.0t值6.2363.7514.9973.297P值<0.0010.0080.0010.011
IL:白细胞介素;TNF-α:肿瘤坏死因子-α;对照组:高脂饮食+腹腔注射0.9%氯化钠溶液10 mL/(kg·d);富氢水组:高脂饮食+腹腔注射富氢水10 mL/(kg·d)
3 讨 论
肥胖是全球最常见的流行病之一,其病理生理机制与氧化应激、脂代谢紊乱及胰岛素抵抗和炎症反应等密切相关[8]。自2007年Ohsawa等[6]发现吸入2%的氢气能够治疗大鼠脑缺血再灌注损伤以来,氢分子被证明对多种疾病有很好的治疗作用[9],但其分子机制目前尚未明确。
高脂饮食引起的肥胖尤其是内脏型肥胖,是引发胰岛素抵抗的主要因素,胰岛素抵抗导致血浆中非酯化脂肪酸增高,线粒体β氧化速度增快,活性氧类物质产出增加。当超过肝脏抗氧化物质的清除能力时则导致活性氧类物质蓄积,过多的活性氧类物质可直接损害线粒体膜DNA,也可与膜磷脂不饱和脂肪酸发生反应,产生脂质过氧化产物,生成酮、醛、醚等,通过作用于线粒体 DNA,抑制呼吸链的电子传递,进一步加速了反应性氧化产物和脂质过氧化产物的产生,形成恶性循环[10]。MDA是体内自由基作用于脂质,衡量脂质过氧化的可靠指标[11]。SOD以氧自由基为底物,能有效地清除负氧离子,阻断细胞毒性更强的羟自由基产生,减轻氧自由基对细胞的损伤[12]。Shingu等[13]通过对MDA、8-轻基脱氧鸟苷、SOD和谷胱甘肽过氧化物酶的水平进行检测证明了氢气通过减轻氧化应激水平使得肾脏缺血再灌注损伤得到明显改善。本研究结果显示,富氢水组小鼠肝脏MDA水平低于对照组,SOD的活性高于对照组,说明富氢水通过抗氧化作用减轻高脂饮食小鼠肝脏的氧化应激反应。
高脂饮食时,由于摄入能量增加,不仅使血浆中非酯化脂肪酸增多,肝脏摄取的非酯化脂肪酸也增加,进而导致极低密度脂蛋白中TG水平增加和肝脏脂肪沉积,富含TG的极低密度脂蛋白在肝脂肪酶的作用下分解,产生小而致密的LDL,这种脂蛋白较易氧化形成氧化型低密度脂蛋白。高三酰甘油血症又会引发其他脂蛋白代谢紊乱。正常生理状态下,各种血浆脂蛋白之间由胆固醇脂转运蛋白和脂质转运蛋白介导胆固醇脂与TG的平衡。当血清中TG升高,胆固醇脂转运蛋白的水平也升高,胆固醇脂转运蛋白介导的胆固醇脂优先从HDL转运到更大的极低密度脂蛋白胆固醇颗粒中,并交换其中的TG,使HDL-C水平下降[14]。HDL-C具有抗动脉粥样硬化的生物特性,其作用包括抗氧化、抗炎、减少细胞胆固醇流出等活性,其中提高细胞胆固醇流出是HDL-C的重要保护机制之一,同时它还可减轻炎症、氧化应激等反应对LDL的损害[15]。本研究通过检测小鼠血脂水平发现,富氢水组小鼠血浆中TC、TG和LDL-C水平低于对照组,HDL-C高于对照组,说明氢分子能够调控高脂饮食诱导的小鼠血浆脂质含量。为了进一步观察肝脏中脂质含量,对肝脏组织进行HE染色,结果显示富氢水组小鼠较对照组肝组织完整,肝索排列整齐,肝窦正常,肝细胞未有明显损伤,核结构非常清晰,脂滴含量明显减少,说明氢分子可减轻脂肪在肝脏中的沉积。Zong等[16]证明氢分子能够显著降低LDL中载脂蛋白B100、载脂蛋白B48和极低密度脂蛋白中主要载脂蛋白E的水平,并且保护HDL颗粒的功能,包括刺激巨噬泡沫细胞胆固醇流出及防止LDL氧化的能力,可能从分子层面更深入的解释本研究结果。
高脂饮食引起的单纯性脂肪肝是一种以低浓度全身炎症为特征的炎症紊乱状态[17]。有研究结果显示,单纯性脂肪肝患者外周血中的炎症因子(IL-6、TNF-α、C反应蛋白等)显著增加,这些患者常伴有脂肪组织和肝脏的轻度炎症[18]。有研究发现,利用结扎左冠状动脉前降支血管制作的心肌梗死模型大鼠在腹腔注射富氢盐水后,可显著减少缺血再灌注所致的心肌梗死面积,证实了富氢盐水对心肌的保护作用与降低心脏组织炎症因子水平、氧化应激损伤相关[19]。为阐明氢分子对高脂饮食引起的小鼠肝脏炎症反应的影响,本研究检测炎症因子IL-6、IL-8、IL-10和TNF-α发现,富氢水组肝脏IL-6、IL-8和TNF-α低于对照组,抗炎因子IL-10高于对照组,说明富氢水具有减轻高脂饮食小鼠肝脏炎症反应的作用。目前尚无氢分子在有效浓度范围内具有毒性的报道,过量的氢分子可通过肺呼出体外[20]。氢分子分子量较小,可快速扩散进入组织并到达如线粒体和细胞核等重要的靶向亚细胞结构,可保护DNA免于氧化损伤[21]。
综上所述,氢分子作为一个重要的糖脂代谢调控子,可调节高脂饮食小鼠血脂水平,并且减少肝脏脂质沉积,其分子机制可能与抑制氧化应激反应及炎症反应密切相关。与传统药物相比,富氢水制备方便,且花费较低,因此有可观的应用前景。

