CARMA3和MMP-9在乳腺癌细胞增殖侵袭中的作用
温媛媛,杨志强,徐勇飞,钱立勇
(舟山医院,浙江 舟山 316021)
含半胱天冬酶募集结构域的膜相关鸟苷酸激酶蛋白(CARMA)家族包括 CARMA1、CARMA2 和CARMA3(又称“CARD10”)三个成员,CARMA 家族蛋白成员在人核转录因子(NF-κB)激活中发挥重要的生物学作用[1]。CARMA蛋白在不同组织中表达各异,在病理状态下CARMA3在卵巢癌等恶性肿瘤中呈高表达,且与肿瘤细胞增殖、侵袭关系密切[2]。金属蛋白酶家族-9(MMP-9)的表达与许多肿瘤的恶性进展、细胞转移和不良预后相关[3]。本研究检测乳腺浸润性导管细胞癌中CARMA3与MMP-9的表达,同时在乳腺癌细胞中转染CARMA3表达质粒后观察CARMA3与MMP-9的表达情况,并分析转染后对乳腺癌细胞增殖、侵袭的影响。
1 材料与方法
1.1 材料 选取本院2018年1-12月收治的90例乳腺浸润性导管癌组织石蜡标本,并选取其癌旁正常乳腺组织作为对照。实验用细胞系:人正常乳腺上皮细胞系MCF-10A,人乳腺癌细胞系MCF-7与MDA-MB-435,均为贴壁生长细胞系,且均接种在DMEM培养液 (含10%胎牛血清、100U/mL青霉素和100μg/mL链霉素)中,于37℃含5% CO2湿润空气的培养箱中培养。SP免疫组织化学检测试剂盒(中国福州迈新生物技术公司);CARMA3抗体(Sigma),MMP-9 抗体(Cell Signaling),β-actin 抗体(北京中杉金桥生物技术有限公司);CARMA3表达质粒 pCMV6-CARMA3 购于 OriGene (Rockville);Lipofectamine 2000(Invitrogen);RNA PCR Kit(AMV)Ver.3.0试剂盒(TaKaRa),PCR引物合成与测序委托大连TaKaRa公司进行。
1.2 方法
1.2.1 免疫组织化学染色 组织标本经10%中性福尔马林溶液固定、石蜡包埋,制成4μm厚度切片。采用链霉素抗生物素蛋白-过氧化物酶SP法,按试剂盒说明书步骤进行抗 CARMA3(1:200)、MMP-9(1:500)抗体免疫组织化学染色,PBS代替一抗作为阴性对照,用已知阳性切片作为阳性对照,观察CARMA3与MMP-9蛋白在乳腺组织中的表达。用半定量法评价CARMA3与MMP-9在肿瘤区域的免疫染色。各切片在光镜下随机选取5个视野,每个视野计数100个细胞,计算阳性细胞的百分比。CARMA3与MMP-9均以细胞质中出现棕黄色颗粒为阳性显色,两者染色强度分为三个等级:0级为阴性,1级为中等着色,2级为强着色;染色百分率分为4个等级:1级为1%~25%,2级为26%~50%,3级为51%~75%,4级为76%~100%。积分=染色强度等级×染色百分率等级,积分<4判定为阴性或低表达,积分≥4为阳性或高表达。
1.2.2 细胞转染 采用细胞转染实验将pCMV6-CARMA3质粒导入乳腺癌细胞MCF-7构建CARMA3过表达细胞系。具体步骤:对乳腺癌MCF-7细胞以5×105每孔的密度接种于6孔板中进行转染,阴性对照为空载体组,将20μg pCMV6-CARMA3、20μg空载体、10μg MMP-9 siRNA、10μg control siRNA分别于1.5mL双无培养基室温下混匀,取60μL脂质体于1.5mL双无培养基混匀,室温孵育5分钟,将稀释后的质粒与Lipofectamine2000混匀,室温孵育30分钟,将上述混合液加入待转染细胞MCF-7中,6小时后换正常培养基,转染48小时后收集细胞,进行下一步检测。共转染pCMV6-CARMA3+MMP-9 siRNA,方法按上述步骤转染pCMV6-CARMA3,36小时后收集细胞检测。实验分为pCMV6-CARMA3组、空载体组、control siRNA组、MMP-9 siRNA组和共转染pCMV6-CARMA3+MMP-9 siRNA组。
1.2.3 CARMA3与MMP-9蛋白的表达 采用Western blot法对比乳腺癌细胞系与乳腺正常上皮细胞系中CARMA3与MMP-9蛋白的表达。收集乳腺癌及乳腺正常上皮细胞,提取总蛋白,加样,上样蛋白量为60μg。聚丙烯酰胺琼脂糖凝胶电泳,转膜,室温下5%正常小牛血清封闭2小时,加入一抗,一抗分别为兔抗人 CARMA3(1:200),山羊抗人MMP-9(1:1000)和鼠抗人 β-actin(1:200),4℃孵育过夜。然后加入二抗(1:2000)中,室温孵育2小时,ECL发光。
1.2.4 CARMA3与MMP-9mRNA的表达 采用RT-PCR法检测乳腺癌细胞与乳腺正常上皮细胞系中CARMA3与MMP-9 mRNA的表达。使用Trizol试剂提取细胞总RNA后逆转录获得cDNA,进行PCR反应。PCR引物经在GeneBank上Blast比对后合成,以β-actin为内对照。PCR引物分别为:(1)CARMA3:上游:5′-CCCCTAAGAGATCCTTCAGCAG-3′, 下游:5′-CCACACGCTGTCAGAGGATG-3′;(2)MMP-9:上游:5′-ACTTTGACAGCGACAAGAAGTG-3′,下游:5′-GGCACTGAGGAATGATCTAAGC-3′;(3)β-actin:上游:5′-AAATCGTGCGTGACATTAA-3′,下游:5′-CTCGTCATACTCCTGCTTG-3′。 扩增产物经1.5%琼脂糖凝胶电泳后成像分析。
1.2.5 细胞增殖能力检测 采用MTT法检测各组细胞增殖能力。将各组细胞悬液分別接种于96孔培养板中,每孔含1×104个细胞,培养24小时,每孔加入MTT溶液继续培养4小时,加入DMSO,490nm波长下测定各孔吸收值,以不含细胞的等体积培养基作对照,绘制细胞生长曲线。
1.2.6 细胞侵袭能力检测 利用基质胶侵袭实验(Transwell法)分析各组细胞的侵袭能力。在孔径为8mm的24孔Transwell小室,上室中加入100μL预冷Matrigel基质胶,下室中加入600μL含10%胎牛血清DMEM培养基,将转染后24小时的细胞接种到人工基底膜室上部培养32小时,PBS清洗,甲醇固定,苏木素染色,室温干燥过夜。取下微孔膜,置载玻片上,显微镜下计数侵袭至滤膜下表面的细胞数,每张滤膜随机计数10个视野(×400),取平均值。实验重复3次,取平均值。
1.3 统计学处理 采用SPSS13.0统计学软件分析数据,计量资料用(±s)表示,采用 Spearman 等级相关分析CARMA3和MMP-9表达的关系,RTPCR、Western blot及细胞凋亡实验结果均采用配对t检验。
2 结果
2.1 免疫组化表现 SP染色后可见CARMA3、MMP-9在乳腺正常组织中呈低表达或不表达,但两者在乳腺浸润性导管癌中呈高表达,均定位于细胞质。详见图1-4。

图1 CARMA3在乳腺正常组织中呈低表达或不表达(SP×200)

图2 MMP-9在乳腺正常组织中呈低表达或不表达(SP×200)

图3 CARMA3在乳腺浸润性导管癌中呈高表达,定位于细胞质(SP×200)。

图4 MMP-9在乳腺浸润性导管癌中呈高表达,定位于细胞质(SP×200)。
2.2 乳腺癌细胞转染后CARMA3和MMP-9的表达 CARMA3 mRNA与蛋白在MDA-MB-435与MCF-7中表达均明显高于乳腺正常上皮细胞系MCF-10A,差异有统计学意义(P<0.05),详见表 1、图5。与空载体组相比,在MCF-7中转染pCMV6-CARMA3 48小时后,CARMA3、MMP-9的 mRNA与蛋白表达增加,差异有统计学意义(P<0.05),详见表 2、图 5。
表1 CARMA3在不同乳腺细胞系的相对表达量(±s)

表1 CARMA3在不同乳腺细胞系的相对表达量(±s)
与MCF-10A细胞系比较*P<0.05
细胞系 CARMA3 mRNA CARMA3蛋白MCF-10A 0.56±0.05 0.47±0.04 MCF-7 1.28±0.10* 1.06±0.09*MDA-MB-435 1.73±0.15* 1.48±0.13*
表2 MCF-7细胞转染pCMV6-CARMA3后CARMA3与MMP-9 的相对表达(±s)

表2 MCF-7细胞转染pCMV6-CARMA3后CARMA3与MMP-9 的相对表达(±s)
与空载体组比较*P<0.05
M M P-9蛋白空载体组 0.9 5±0.1 1 1.0 8±0.1 0 1.1 5±0.4 3 1.0 8±0.3 8 p C M V 6-C A R M A 3 组 4.0 2±0.9 7*3.5 4±0.8 2*2.8 4±0.6 8*2.4 9±0.5 5*转染分组 C A R M A 3 m R N A C A R M A 3蛋白M M P-9 m R N A
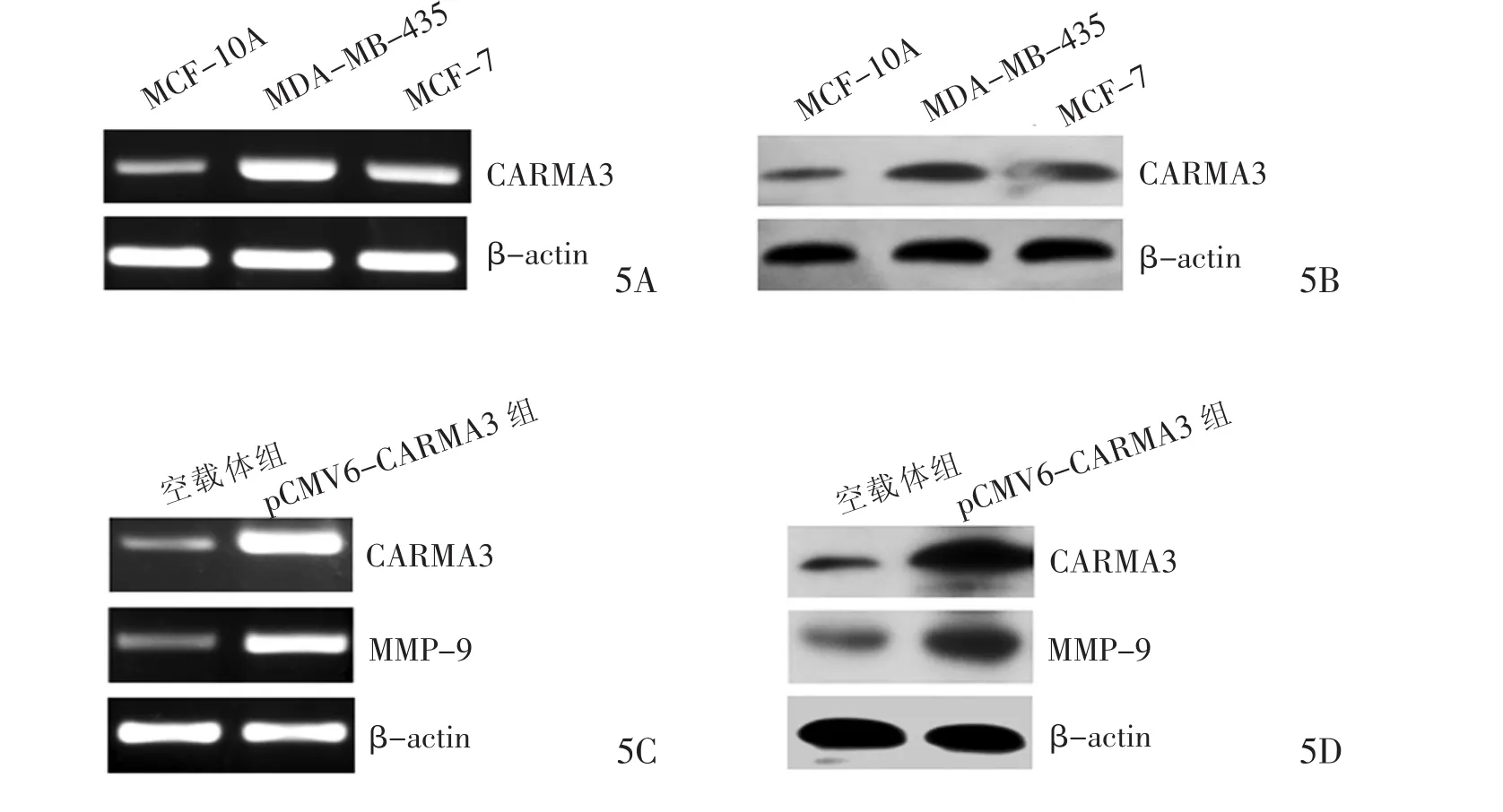
图5 乳腺癌细胞系MCF-7中过表达CARMA3可上调MMP-9表达。5A:CARMA3 mRNA在乳腺癌细胞系MCF-7与MDA-MB-435中表达高于乳腺正常上皮细胞系MCF-10A;5B:CARMA3蛋白在乳腺癌细胞系MCF-7与MDAMB-435中表达高于乳腺正常上皮细胞系MCF-10A;5C:与转染空载体组相比,乳腺癌细胞系MCF-7中转染pCMV6-CARMA3质粒后CARMA3与MMP-9 mRNA表达均增加;5D:与转染空载体组相比,乳腺癌细胞系MCF-7中转染pCMV6-CARMA3质粒后,CARMA3与MMP-9蛋白表达增加。
2.3 CARMA3、MMP-9表达与乳腺癌细胞增殖的关系 在乳腺癌细胞系MCF-7中采用MMP-9 siRNA沉默MMP-9的表达,瞬时转染MMP-9 siRNA 48小时后,MMP-9 mRNA与蛋白表达在MMP-9 siRNA组表达较control siRNA组下调,差异有统计学意义(P<0.05),详见表 3、图 6A-6B。 将MCF-7细胞分成两组,一组共转染pCMV6-CARMA3与MMP-9 siRNA,一组单独转染pCMV6-CARMA3,共转染pCMV6-CARMA3+MMP-9 siRNA组MMP-9 mRNA与蛋白表达下调,差异有统计学意义(P<0.05),详见表 4、图 6C-6D。 与空载体组相比,MCF-7细胞转染pCMV6-CARMA3 3-5天后其增殖能力增加;MCF-7细胞共转染pCMV6-CARMA3与MMP-9 siRNA 3-5天后,与转染pCMV6-CARMA3组相比细胞增殖能力下降;与control siRNA组、MMP-9 siRNA组相比增殖能力无明显差别,详见图6E。

图6 乳腺癌细胞系MCF-7中过表达CARMA3可促进乳腺癌细胞增殖。6A:与control siRNA组相比,MCF-7中转染MMP-9 siRNA后MMP-9 mRNA表达减弱;6B:与control siRNA组相比,MCF-7中转染MMP-9 siRNA后MMP-9蛋白表达减弱;6C:与单独转染pCMV6-CARMA3质粒相比,MCF-7中共转染pCMV6-CARMA3与MMP-9 siRNA后,MMP-9 mRNA表达减弱;6D:与单独转染pCMV6-CARMA3质粒相比,MCF-7中共转染pCMV6-CARMA3与MMP-9 siRNA后,MMP-9蛋白表达减弱;6E:与单独转染pCMV6-CARMA3质粒相比,乳腺癌细胞系MCF-7中共转染pCMV6-CARMA3与MMP-9 siRNA 3-5天后,乳腺癌细胞增殖能力减弱。
表3 MMP-9 mRNA与蛋白的相对表达量(±s)

表3 MMP-9 mRNA与蛋白的相对表达量(±s)
与control siRNA组比较*P<0.05
组别 MMP-9 mRNA MMP-9蛋白control siRNA 组 1.78±0.48 1.56±0.43 MMP-9 siRNA 组 0.31±0.05* 0.28±0.06*
表4 CARMA3、MMP-9的mRNA与蛋白在MCF-7各转染组中的相对表达量(±s)

表4 CARMA3、MMP-9的mRNA与蛋白在MCF-7各转染组中的相对表达量(±s)
与pCMV6-CARMA3组比较*P<0.05
M M P-9蛋白p C M V 6-C A R M A 3 组4.5 6±0.9 1 4.0 5±0.6 8 2.6 4±0.4 3 2.0 4±0.4 0 p C M V 6-C A R M A 3+M M P-9 s i R N A组 3.9 2±0.9 5 3.6 7±0.5 9 0.5 9±0.0 9*0.5 5±0.0 5*转染组别 C A R M A 3 m R N A C A R M A 3蛋白M M P-9 m R N A
2.4 CARMA3、MMP-9表达与乳腺癌细胞侵袭能力的关系 转染pCMV6-CARMA3组与空载体组比较,通过基质胶的细胞数明显增加,差异有统计学意义(P<0.01)。与转染pCMV6-CARMA3组相比,共转染pCMV6-CARMA3与MMP-9 siRNA后通过基质胶的细胞数目减少,差异有统计学意义(P<0.01)。与control siRNA组比较,转染MMP-9 siRNA后通过基质胶的细胞数减少,差异有统计学意义(P<0.01)。 详见表 5、图 7-8。
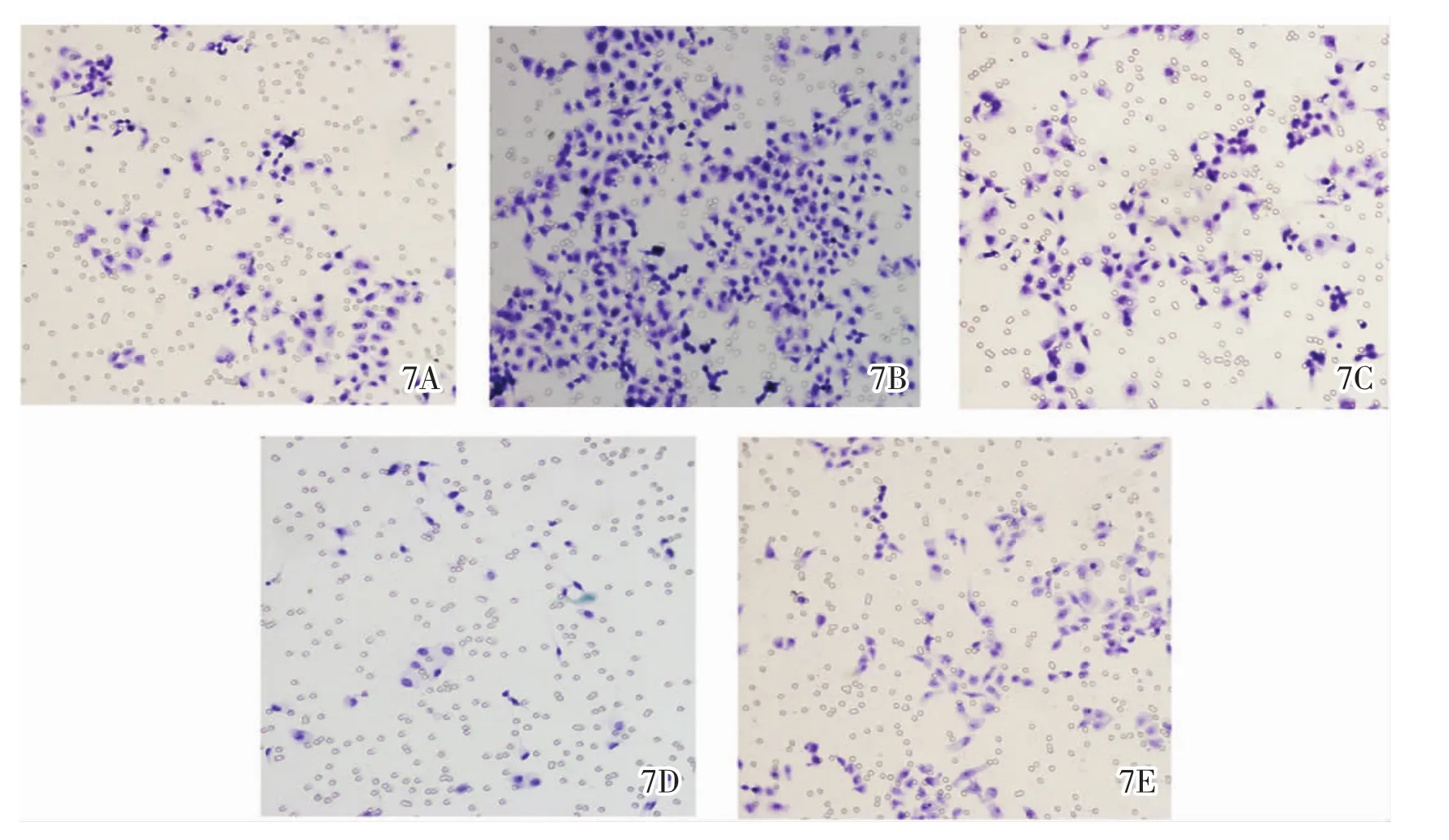
图7 显微镜下各组侵袭的乳腺癌细胞数(×400)。7A:空载体组;7B:pCMV6-CARMA3组;7C:pCMV6-CARMA3+MMP-9 siRNA 组;7D:MMP-9 siRNA 组;7E:control siRNA 组。

图8 各组侵袭的乳腺癌细胞数比较
表5 各组穿透基质胶细胞个数(±s)

表5 各组穿透基质胶细胞个数(±s)
与空载体组比较△P<0.01;与pCMV6-CARMA3组比较#P<0.01;与 control siRNA 组比较 *P<0.05。
穿透个数空载体组 1 4 5.0±1 9.0 p C M V 6-C A R M A 3 组 3 8 9.0±2 8.0△p C M V 6-C A R M A 3+M M P-9 s i R N A 组 1 6 4.0±1 6.0#M M P-9 s i R N A 组 3 4.0±8.0*c o n t r o l s i R N A 组 1 5 2.0±1 7.0组别
3 讨论
研究发现,CARMA3在许多肿瘤发生中起重要作用,且CARMA3高表达与肿瘤高TNM分期、淋巴结转移和Ki67增殖指数密切相关,CARMA3可通过NF-κB调控Cyclin D1来促进细胞增殖[4]。CARMA3在肾细胞癌中表达高于配对的癌旁正常肾脏组织,且CARMA3高表达与肿瘤的高分期和低分化呈正相关、与肾细胞癌患者的不良预后相关[5]。本组免疫组化结果发现,CARMA3在乳腺浸润性导管癌中呈高表达,在乳腺正常组织中不表达或低表达,在乳腺癌细胞中CARMA3蛋白和mRNA表达均高于乳腺正常上皮细胞。有研究发现,在非小细胞肺癌[6]与胰腺癌[7]中沉默CARMA3表达可抑制非小细胞肺癌细胞与胰腺癌细胞增殖与侵袭。在胆管细胞癌中抑制CARMA3表达可诱导细胞凋亡、抑制细胞增殖和侵袭[8]。本研究在乳腺癌细胞中转染CARMA3表达质粒后发现乳腺癌侵袭能力增强,同时观察到过表达CARMA3后乳腺癌细胞生长增殖能力均明显提高。这些结果提示,CARMA3作为癌基因在乳腺癌恶性表型中发挥一定的作用。
MMP-9属于基质金属蛋白酶(MMPs)家族成员,能降解细胞外基质中的Ⅳ型胶原,在肿瘤的生长、侵袭和转移中发挥重要作用[9]。CARMA3可通过G protein-coupled受体来诱导NF-κB激活,参与调控MMP-9表达来促进细胞侵袭[10]。NF-κB转录因子家族参与了肿瘤进展和转移,NF-κB可通过上调一系列细胞增殖因子如Cyclin D1、c-myc和细胞凋亡抑制因子来促进细胞增殖、抑制细胞凋亡[11]。另外,NF-κB激活可通过上调MMP家族蛋白表达来促进肿瘤细胞侵袭[12]。本研究免疫组化发现,MMP-9蛋白在乳腺浸润性导管癌中呈高表达。转染CARMA3表达质粒pCMV6-CARMA3后发现,过表达CARMA3可上调MMP-9表达。本研究采用MMP-9 siRNA干扰MMP-9表达,与单独转染pCMV6-CARMA3相比,乳腺癌细胞共转染pCMV6-CARMA3与MMP-9 siRNA,其细胞增殖和侵袭力明显减弱,这些结果提示CARMA3可通过上调MMP-9表达来促进乳腺癌细胞增殖和细胞侵袭。
综上,CARMA3在乳腺癌恶性进程中发挥一定作用,CARMA3可能通过调控MMP-9表达来影响乳腺癌的生物学行为。

