金属改性13X分子筛及对石脑油吸附脱氯研究
崔世强,闫 锋,邵文君,王新东,张柏慧
(1.辽宁石油化工大学化学化工与环境学部,辽宁抚顺113001;2.山东京博石油化工有限公司,山东滨州256500;3.中国石油抚顺石化公司石油三厂,辽宁抚顺113001)
由于原油储量减少,开采难度变大,为了提高采油率,常加入一些含氯代烃的采油助剂,导致了石脑油中有机氯的含量明显增加,对石油炼制过程产生重大危害[1-2]。一些有机氯化物通过化学反应形成HCl,若反应系统中氯离子过多,则会导致设备腐蚀速度加快[3-4]。同时,氯具有极高的流动性和电子亲和性,极易同金属离子发生反应,对于奥氏体钢来说其对氯比较敏感,氯化物过多会对钢体的腐蚀进一步加快,导致装置提前损坏[5]。
国内外正在积极研究与开发有效的脱氯技术,吸附脱氯技术是近年来应用最多的技术之一。吸附脱氯主要是将自然界存在的铝土以及沸石等作为吸附剂,用来进行吸附实验的方法[6]。吸附脱氯的优点是反应迅速、操作简单、成本较低,为了更好地脱除有机氯,对分子筛进行改性,制备新的脱氯吸附剂是目前主要研究方向[7]。J.Y.Li等[8]采用浸渍法进行制备吸附剂,在Al2O3上负载CuO进行脱氯,可以达到59.93%的脱氯率。R.L.Li等[9]研究发现,由金属Ce改性的Y分子筛在反应温度为150℃时脱氯率可达80%左右,且脱除过程主要为化学吸附。文献研究表明[10-11],13X分子筛可用于去除氯化物,且具有良好的脱氯效果,在水中对有机氯的脱除可达74.1%。J.Q.Chen等[12]研究可知,Ag-13X对有机氯化物吸附脱除的效果远优于Ni-13X和Co-13X。在剂油比为1∶40(指每克吸附剂相对于每毫升油而言),温度为20℃,吸附时间为3 h的条件下脱氯效果最佳。刘政等[13]研究二氯乙烷裂解反应,并探究了采用不同前驱体制备的催化剂对二氯乙烷热裂解反应的影响规律,结果显示C3N4/AC催化剂的热裂解效果最好。
本文主要针对石脑油中有机氯脱除进行研究。选用改性13X分子筛作为吸附剂,以Mg离子和Fe离子为活性组分,制备新型改性吸附剂,来提高对氯化物的脱除能力,并分别对制备条件和反应条件进行了考察。
1 实验部分
1.1 原料和试剂
硝酸镁、硝酸铁、冰乙酸,以上试剂均为分析纯,天津市大茂化学试剂厂;13X分子筛,天津市光复精细化工研究所,工业品;去离子水,实验室自制;氯含量标样,石油化工科学研究院,分析纯。
1.2 吸附剂的制备
首先取一些13X分子筛进行烘干待用,称取硝酸镁,用去离子水配成溶液A,分为两份,其中一份中加入5 g的13X分子筛进行浸渍,之后再经干燥、焙烧等过程制备成xMgO/13X吸附剂(x为MgO的负载量(质量分数,下同))。同理可制备yFe2O3/13X吸附剂(y为Fe2O3的负载量)。向装有另一份溶液A的烧杯中缓慢滴入硝酸铁的水溶液,搅拌反应2 h。待水分充分挥发后,在105℃烘箱里干燥12 h。将样品放入马弗炉中进行焙烧,制得xMgO-yFe2O3/13X吸附剂。
1.3 脱氯实验过程
用电子天平分别称取含有不同金属离子的吸附剂,将吸附剂放入三口烧瓶中,按照不同剂油体积比加入原料石脑油,将三口烧瓶放入磁性搅拌装置中进行充分搅拌,再将温度调至60℃,反应时间为2 h。之后将连接冷凝管的三口烧瓶拿出静置,经冷却后收集脱氯后的石脑油,利用微库仑综合分析仪测定其氯含量,通过式(1)计算脱氯率η。

式中,C0表示反应前油中氯质量浓度,mg/L,Ce表示反应后油中的氯质量浓度,mg/L。
1.4 吸附剂的表征
XRD测试在XRD-7000型X射线衍射仪上进行,以 5°~70°进行扫描实验,以 8(°)/min的速度进行扫描,扫描步长0.02°。BET分析用Autosorb-IQ2-MP型全自动物理静态分析仪,可计算出吸附剂的比表面积,并根据曲线上的数据来进一步计算检测样品的孔体积和孔径。TG-DTA测试使用Q600型热重-差热分析仪,升温速度为10℃/min。
2 结果与讨论
2.1 表征分析
2.1.1 X射线衍射分析 图1为吸附剂的XRD谱图。由图1可知,改性后吸附剂和13X分子筛的衍射峰几乎相同,但峰值强度有不同程度的变化。这表明,金属离子进入分子筛孔隙和骨架中,未破坏其结构。但是MgO-Fe2O3/13X显示出一点差异,在2θ=21.1°出现新的衍射峰,可以得出新的晶体衍射面出现的结论。由于两种氧化物在一起引起了晶型进一步晶化,导致衍射峰的强度变大。没有发现明显的铁离子峰,表明铁离子高度分散于载体框架中。
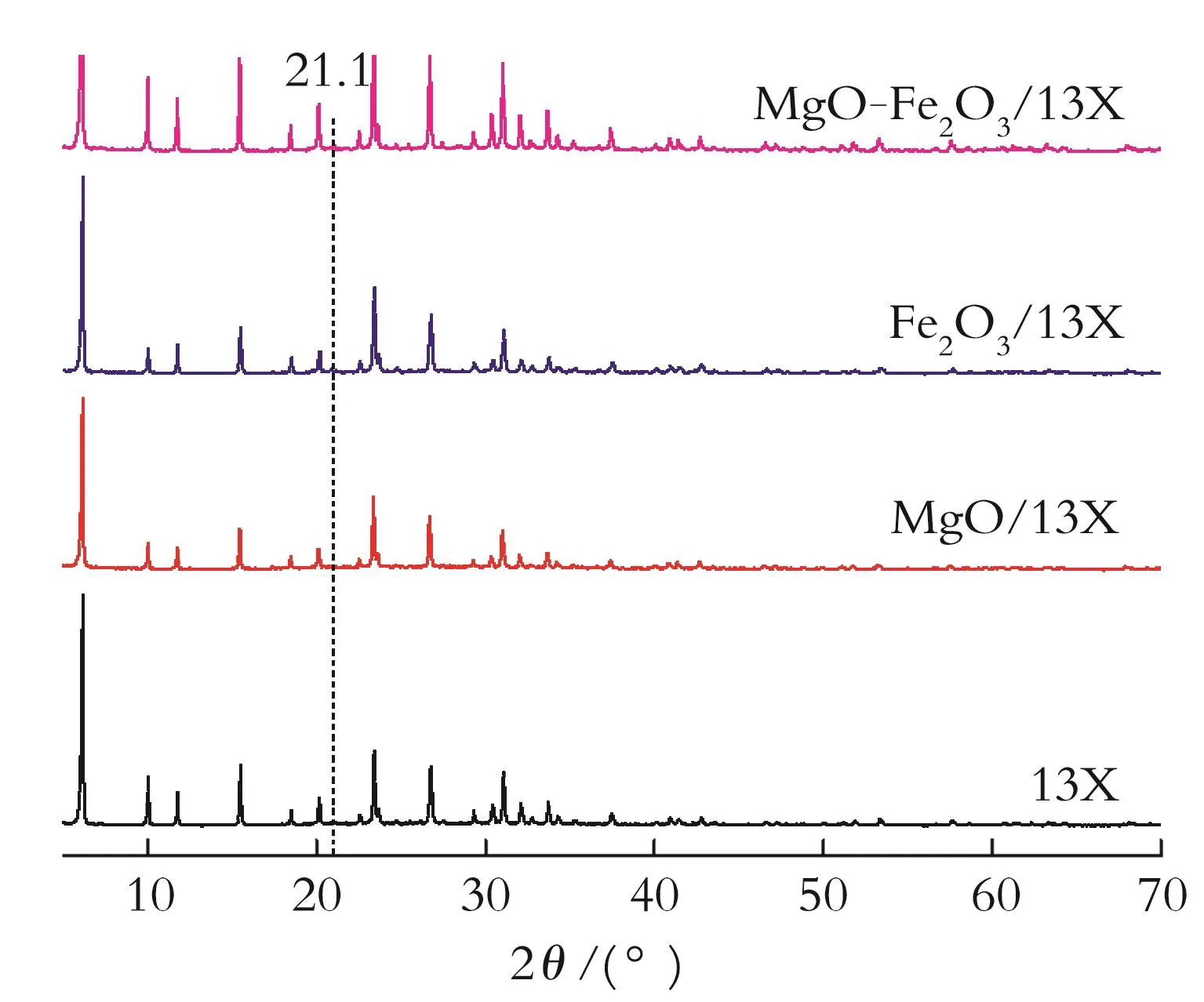
图1 不同吸附剂的XRD图谱Fig.1 XRD pattern of different adsorbents
2.1.2 BET表征分析 图2是13X分子筛和MgO-Fe2O3/13X的BET曲线。由图2可见,属于典型的第IV类等温线。并通过公式计算比表面积、孔容、孔径的数据如表1所示。由表1可知,改性吸附剂的孔容、孔径和比表面积均有所改变。这可能是由于铁和镁的氧化物部分负载于分子筛的孔道,还有一些高度分散在13X分子筛表面,占据了N2的吸附位点,造成样品孔容的减小及比表面积增大,当分子筛的孔径较小时,对氯化物吸附能力不强,当孔径扩大后,吸附能力变强,更有利于吸附脱氯。
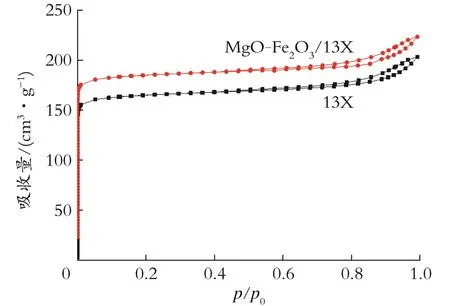
图2 吸附剂的BET曲线Fig.2 BET diagram of the adsorbent
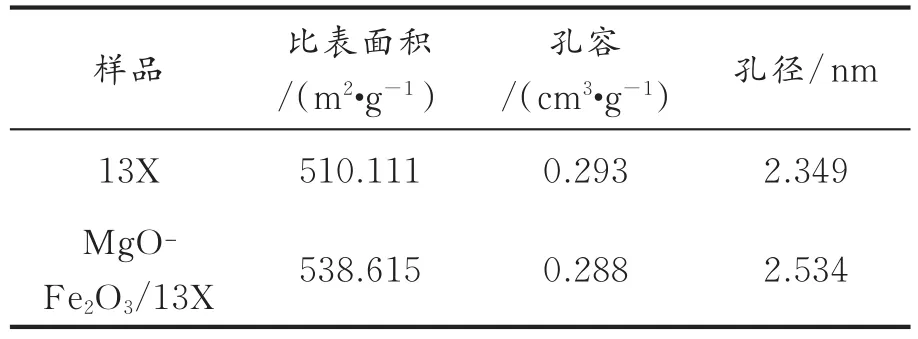
表1 不同吸附剂的BET数据Table 1 BET data of different adsorbents
2.1.3 改性吸附剂的TG-DTA表征 图3为MgO-Fe2O3/13X的TG-DTA曲线。由图3可知,吸附剂在200℃之前有一个失重峰,主要是由于脱除吸附剂中部分结晶水所产生的失重。550℃处又出现了一个失重峰,这是硝酸盐分解为氧化物的过程。可以看出,制备吸附剂必须在高温下进行,温度过低时,硝酸盐很难转化为氧化物,因此TG曲线变化比较平缓,在650℃之后不再失重,此时吸附剂结构依然完整,说明改性吸附剂比较稳定。
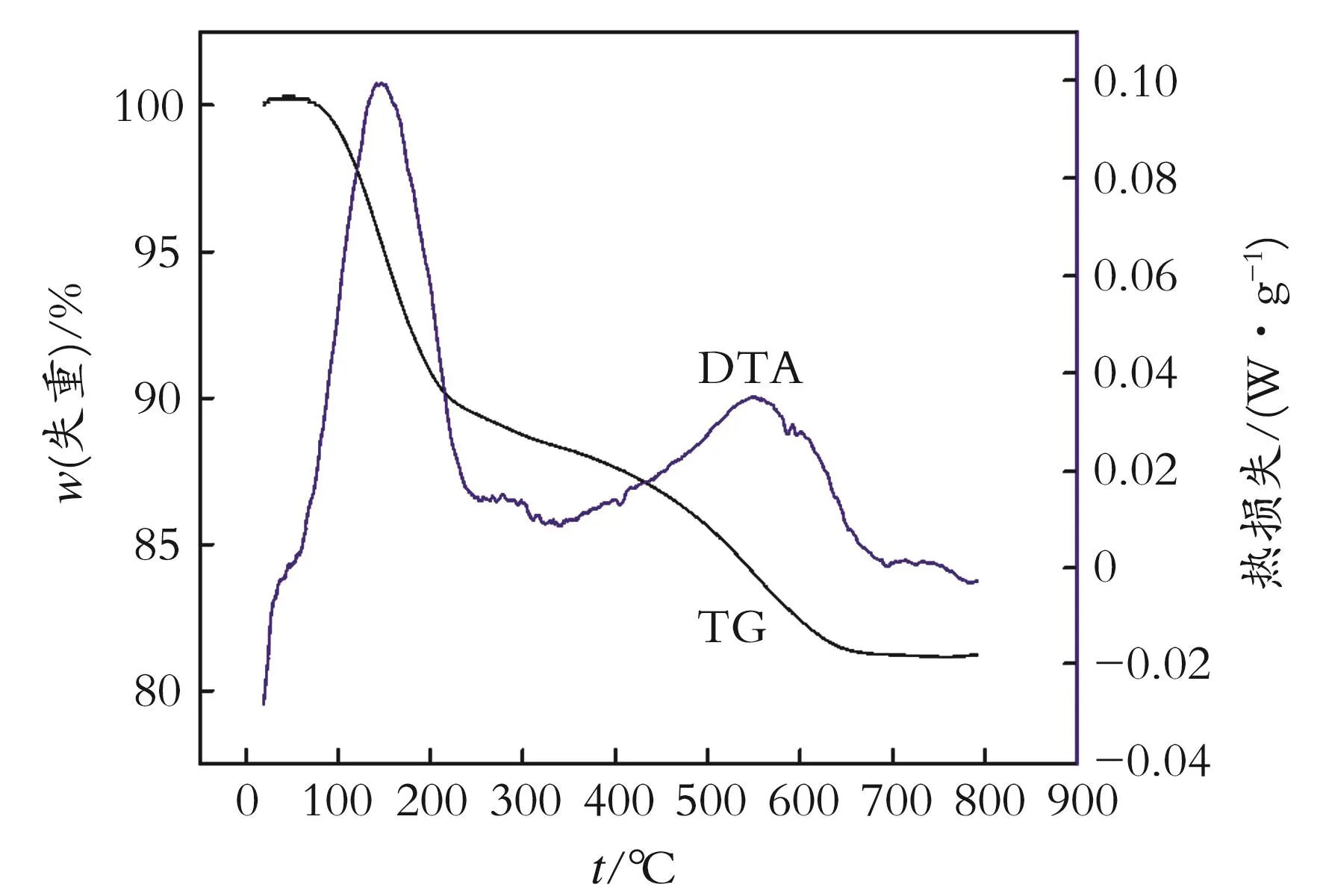
图3 MgO-Fe2O3/13X样品的TG-DTA曲线Fig.3 TG-DTA curve of MgO-Fe2O3/13X sample
2.2 吸附剂脱氯性能研究
2.2.1 改性吸附剂的选择 在剂油体积比1∶40,吸附温度60℃,吸附时间2 h的条件下,改性后各种吸附剂的脱氯能力如图4所示。由图4可知,MgOFe2O3/13X吸附剂对石脑油中有机氯脱除效果优于其它吸附剂,脱氯率达到89%。则选用MgOFe2O3/13X吸附剂进行脱氯实验。
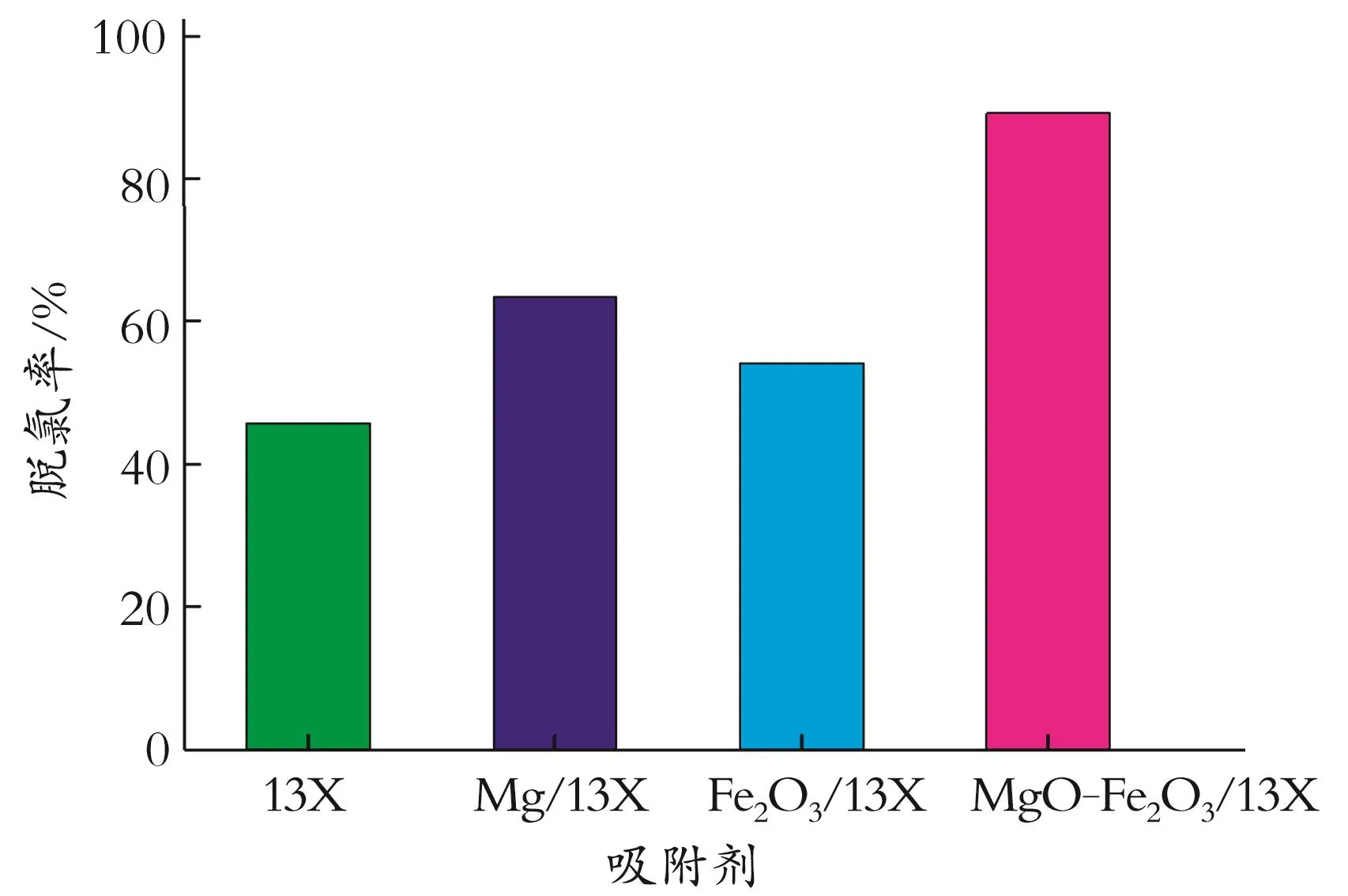
图4 不同金属改性13X分子筛的脱氯率Fig.4 Dechlorination rate of 13X molecular sieves modified with different metals
2.2.2 反应时间对脱氯效果的影响 在剂油体积比1∶40,吸附温度60℃的条件下,反应时间为0.5~2.5 h时,吸附剂的脱氯效果如图5所示。
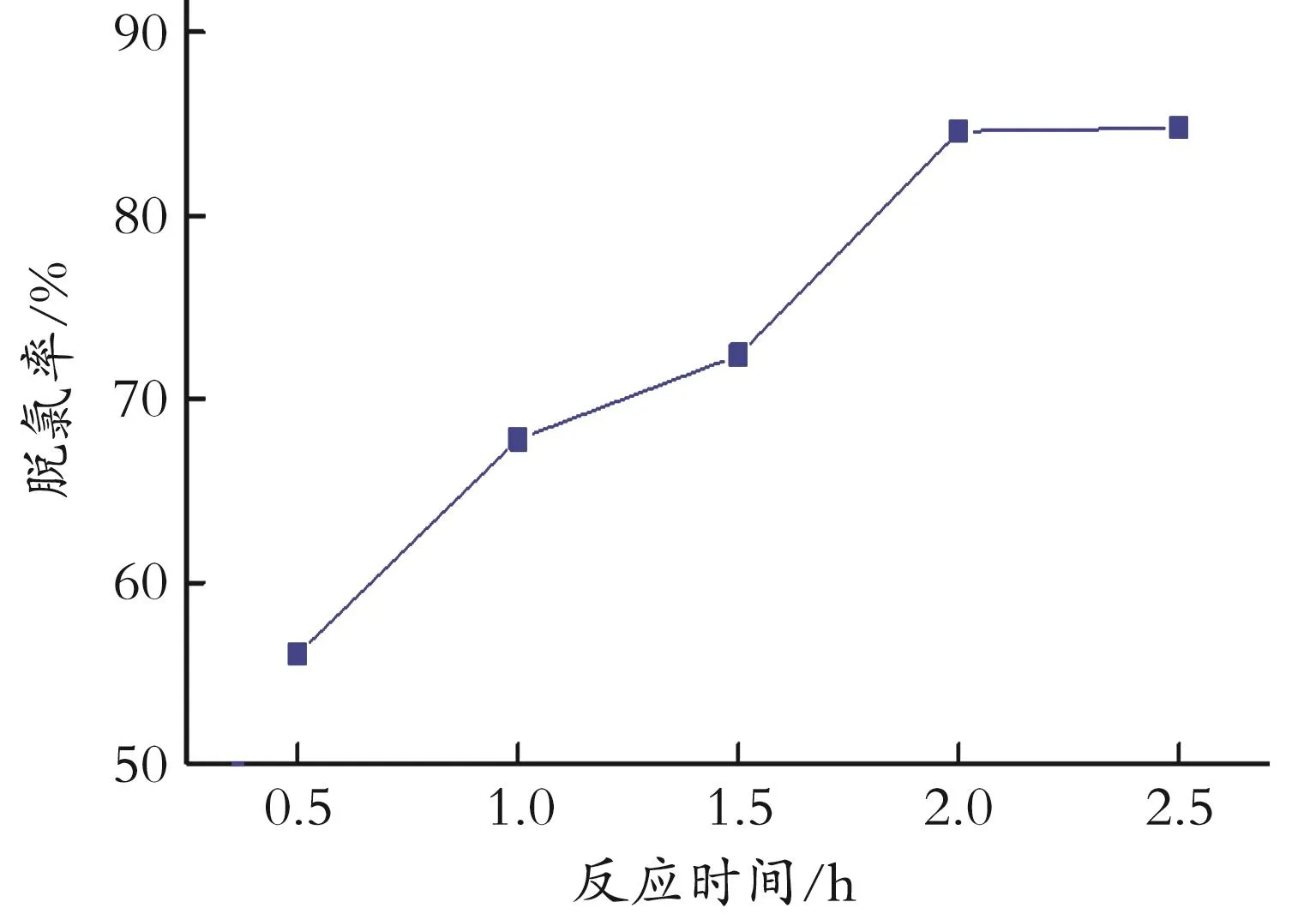
图5 不同吸附时间的脱氯效果Fig.5 Dechlorination effect at different adsorption times
由图5可见,0.5~2.0 h脱氯率呈增加趋势,2 h后不再增加。主要原因可能是吸附时间过少时,吸附进行的不完全,脱氯率偏低,吸附一定时间后,吸附剂达到了饱和吸附量,脱氯率不再变化。综合考虑,吸附剂在2 h的吸附时间下,脱氯率达到最大。
2.2.3 剂油体积比对脱氯效果的影响 在吸附温度60℃,吸附时间2 h的条件下,考察剂油体积比在1∶20~1∶100时吸附剂对石脑油中有机氯脱除效果的影响,结果见图6。由图6可见,吸附剂在剂油体积比为1∶40时,脱氯率达到最高,剂油体积比较小时,对应反应比表面积相对减少,导致脱氯率下降。而在1∶20情况下,吸附剂过多导致聚集,对脱氯效果产生影响,则较佳剂油体积比为1∶40。
2.2.4 吸附温度对脱氯效果的影响 在剂油体积比1∶40,吸附时间2 h的条件下,考察吸附温度30~70℃时,对有机氯脱除效果的影响,结果如图7所示。由图7可知,温度较低时吸附剂的活性较低,脱氯率较低。随着温度的升高,吸附剂的活性上升,脱氯率升高。当温度达到60℃时,再增加温度会导致脱附效应增加,造成负面影响,因此,对于石脑油脱氯的较佳吸附温度为60℃。
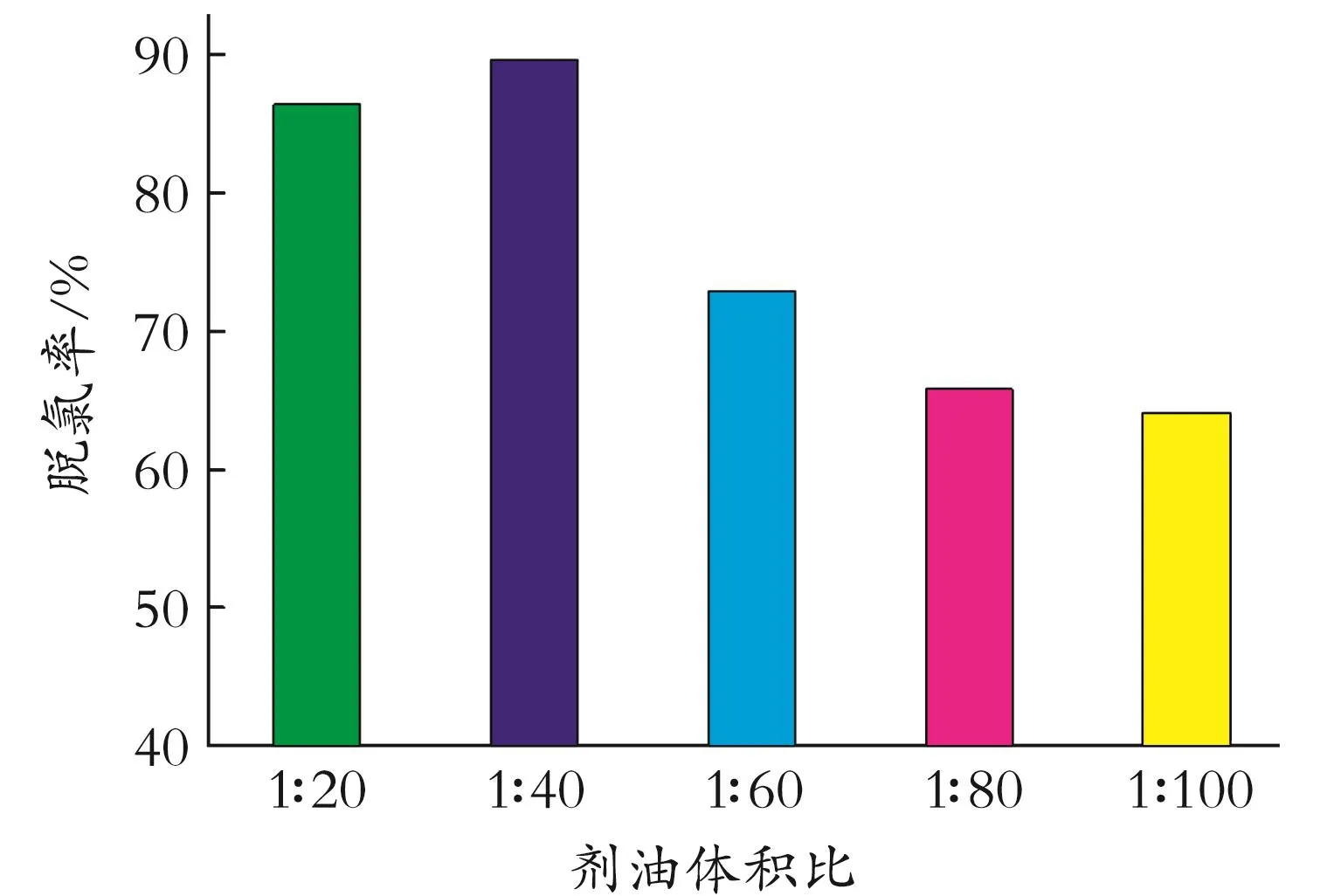
图6 不同剂油体积比的脱氯效果Fig.6 Dechlorination effect of different agent oil volume ratio
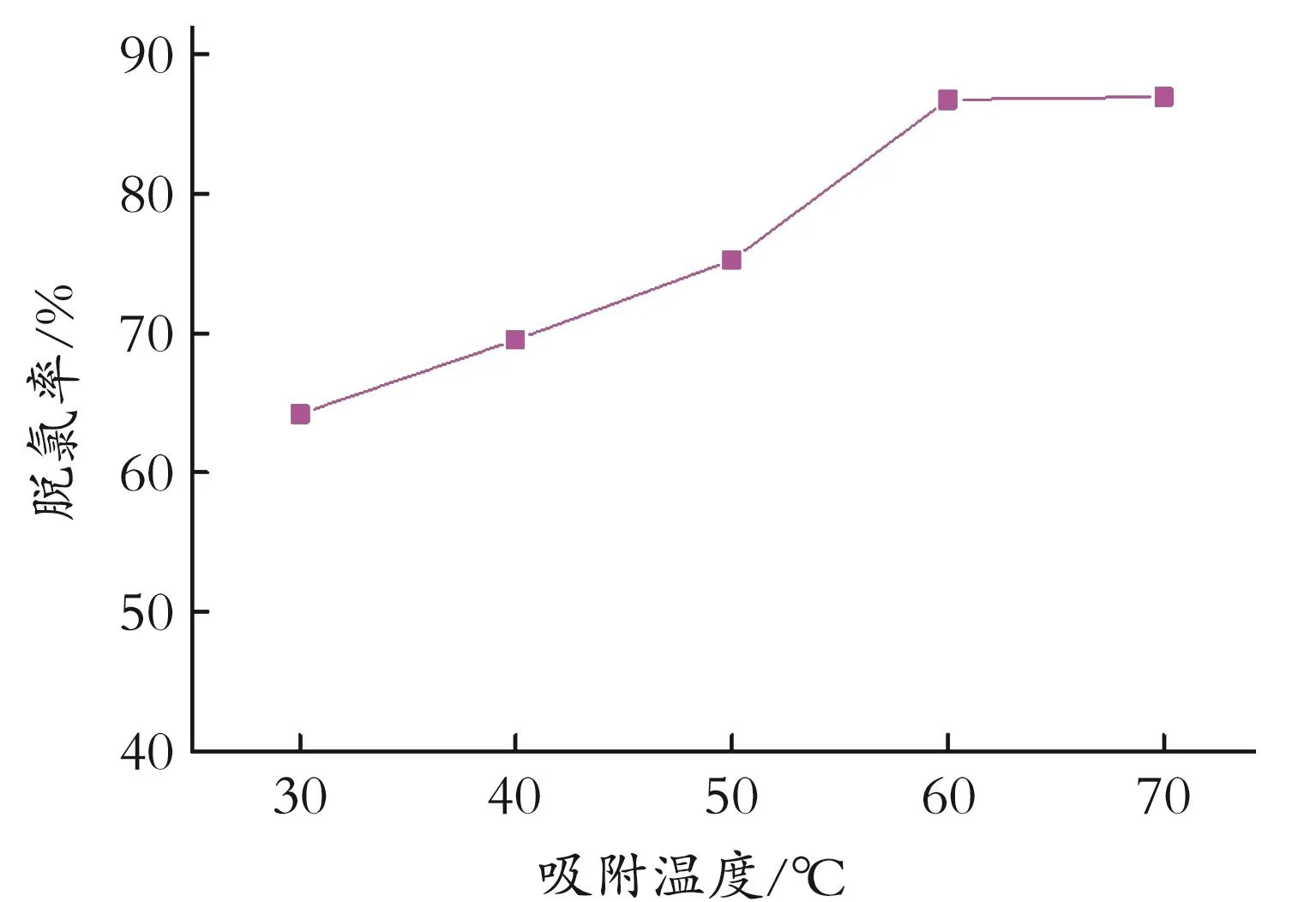
图7 不同吸附温度下的脱氯效果Fig.7 Dechlorination effect at different adsorption temperatures
2.3 吸附动力学模型研究
2.3.1 吸附动力学方程拟合 用改性后的MgOFe2O3/13X进行脱氯吸附动力学研究,对其过程进行吸附动力学拟合。假设MgO-Fe2O3/13X吸附剂对有机氯的吸附过程满足二级吸附动力学模型,根据Mckay方程有:

k为准二级吸附动力学的吸附平衡常数,g/(mg·min);qt和 qe为时间为 t时的吸附量和平衡吸附量,mg/g。
利用边界条件对式(2)积分可得:

由式(3)可知,若以t/qt和t的关系作图分析,则可计算得到k和qe,如图8所示。
由图8可知,通过二级吸附动力学方程对MgOFe2O3/13X吸附剂进行脱氯过程拟合,可根据拟合直线方程计算动力学模型参数,结果如表2所示。
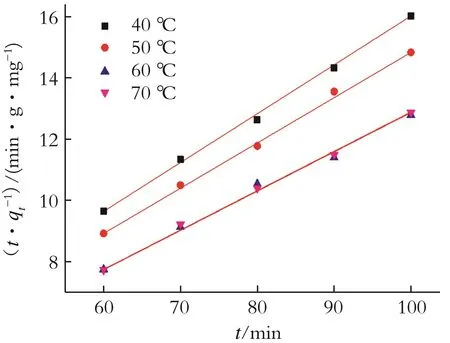
图8 有机氯在MgO-Fe2O3/13X上吸附的(t/qt)~t关系Fig.8 Relationship between(t/qt)and t adsorption of organochlorine on MgO-Fe2O3/13X
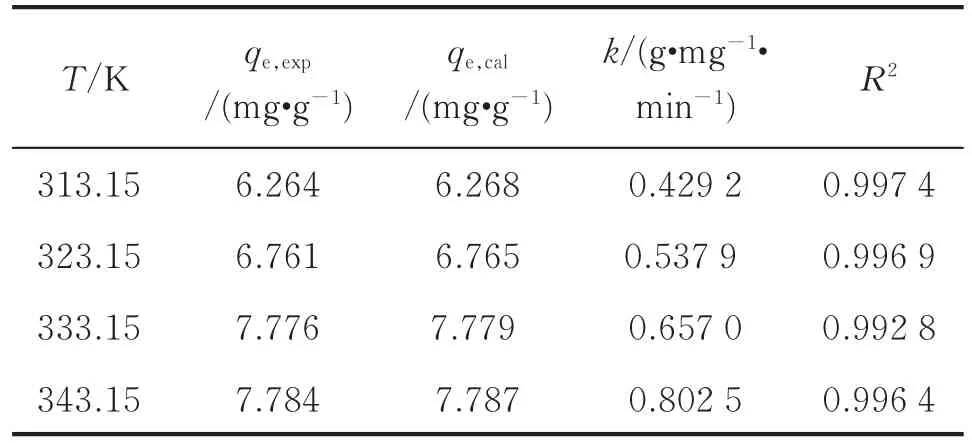
表2 准二级动力学参数Table 2 Quasi-secondary kinetic parameters
由表2可知,MgO-Fe2O3/13X吸附剂的准二级动力学模型拟合脱氯过程的相关系数较高,R2大于0.99,拟合可信度较高,且 qe,cal更接近于测定值qe,exp。因此,MgO-Fe2O3/13X 吸附剂对石脑油脱氯过程符合准二级动力学模型。
2.3.2 吸附活化能的计算 MgO-Fe2O3/13X吸附剂对石脑油脱氯的过程符合准二级动力学模型,则可以采用以下方法计算活化能。

k为二级动力学速率常数,g/(mg·min),A 表示指前因子,Ea表示吸附活化能,kJ/mol,R=8.413 J/(mol·K)。
对式(4)两端分别取对数可以得到:

以lnk与1/T的关系作图,可分别得到Ea和lnA,如图9所示。
由图9可知,通过拟合可得到直线方程,并通过直线方程计算出Ea和lnA。得到拟合方程,活化能Ea=17.751 kJ/mol,R2=0.994 2。分析可知,MgOFe2O3/13X吸附剂拟合的相关系数R2大于0.99,说明计算结果可信度比较高。物理吸附的活化能范围较低,通常为0~40 kJ/mol,而化学吸附的所需活化能较高为40~800 kJ/mol。通过活化能可知,吸附剂主要以物理吸附脱氯为主。
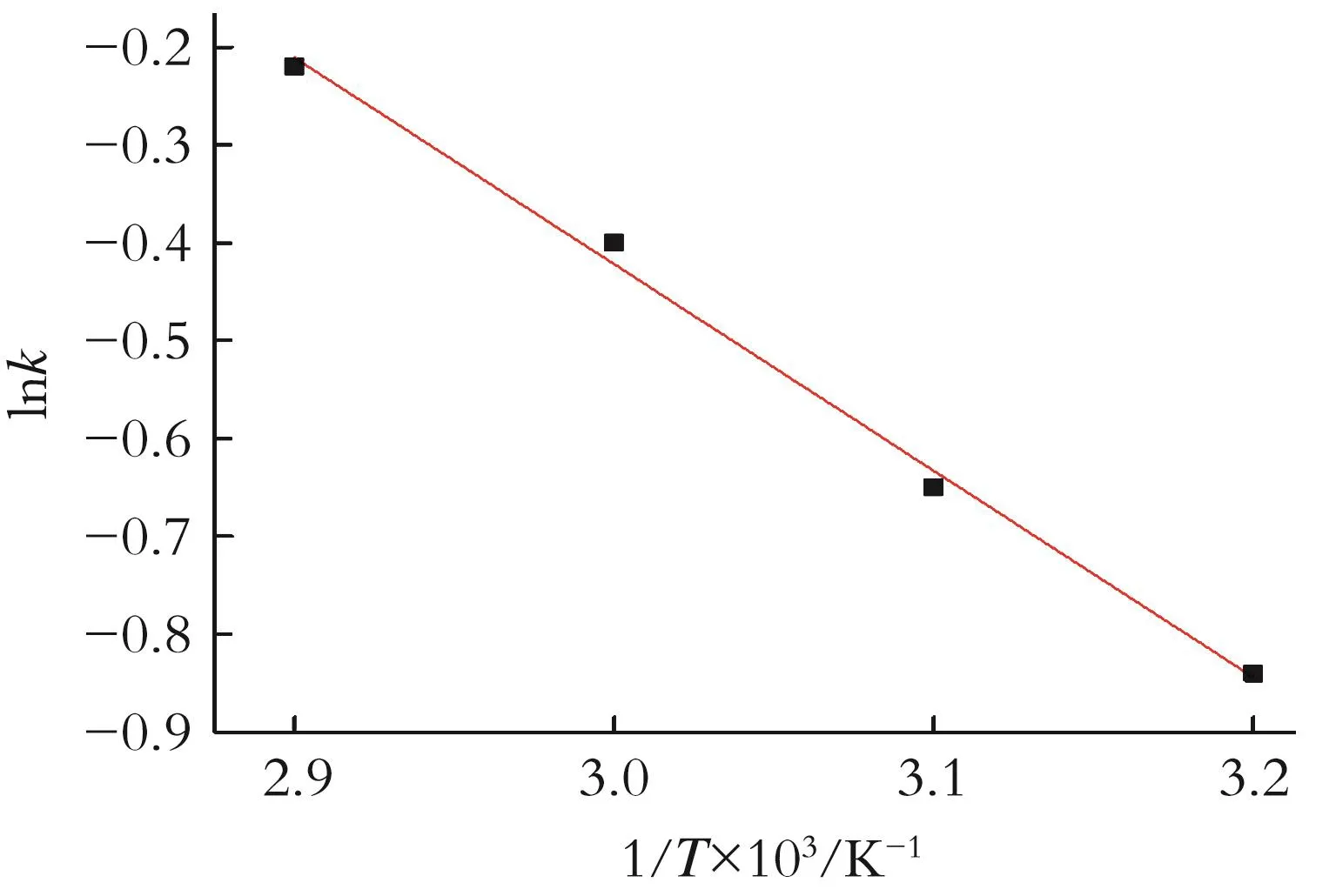
图9 MgO-Fe2O3/13X的lnk与(1/T)线性关系Fig.9 Linear relationship between lnk and(1/T)of MgO-Fe2O3/13X
3 结 论
(1)通过浸渍法对13X分子筛进行改性,分别以MgO和Fe2O3作为活性组分,制备了MgO/13X,Fe2O3/13X和MgO-Fe2O3/13X三种新型吸附剂。并通过实验对比,在相同条件下,MgO-Fe2O3/13X的脱除效果强于其它吸附剂。
(2)通过表征分析可知,负载的氧化物高度分散于载体表面,改性后吸附剂的孔径、孔容和比表面积均发生一定的改变。吸附剂的稳定性进一步有所提高。
(3)通过实验得出,MgO-Fe2O3/13X吸附剂在剂油体积比1∶40,吸附温度60℃,吸附时间 2 h的条件下对石脑油的脱氯率最高,达到89%。
(4)通过拟合方程的结果分析可知,MgOFe2O3/13X吸附剂在脱除有机氯的吸附反应符合二级吸附动力学模型。通过计算吸附活化能可知,MgO-Fe2O3/13X吸附剂主要以物理吸附为主。

