化学平衡考点例析
穆玉鹏
(山东省博兴县第一中学 256500)
一、有关反应平衡的判断

A. 1个N≡N键断裂的同时,有3个H—N键形成
B. 1个N≡N断裂的同时,有3个H—N键断裂
C. 1个N≡N断裂的同时,有6个H—N键断裂
D. 1个N≡N键断裂的同时,有6个H—N键形成
解析根据化学平衡的定义,当一个可逆反应达到平衡时v正=v逆,同时各物质的百分含量保持不变,从本质上来讲反应虽然仍在进行,但各种物质的绝对量不再变化,就称为达到平衡状态,对此题关键要分清谁表示v正谁表示v逆,例如,1个N≡N断裂,即表示要向右进行,生成NH3即为v正;而6个N—H键断裂表示向左进行,生成N2与H2,即v逆.6个N—H形成,相当于生成2 mol NH3,表示v正.根据同一反应中,用不同的物质来表示某反应的速率,若正、逆反应速率之比等于化学方程式各物质的系数之比,反应亦达到平衡,所以答案为C.
答案:C


A.a点 B.b点 C.c点 D.d点
解析此坐标的特点纵轴表示的是NO的转化率,横轴表示温度,曲线上的任一点都表示在此温度下达到平衡状态时对应的转化率,从c点作纵轴的平行线与曲线交于一点,这表示若想达到c点对应温度的平衡状态,需要转化更多的NO,表示c点未达到平衡状态,即:v正>v逆(反应向正反应方向进行)
答案:C
二、影响平衡移动的因素

A. 减少部分NH4HS固体
B. 压强温度不变充入少量Ar
C. 容积、温度一定、充入He
D. 温度、压强、容积一定充入SO2

答案:B、D

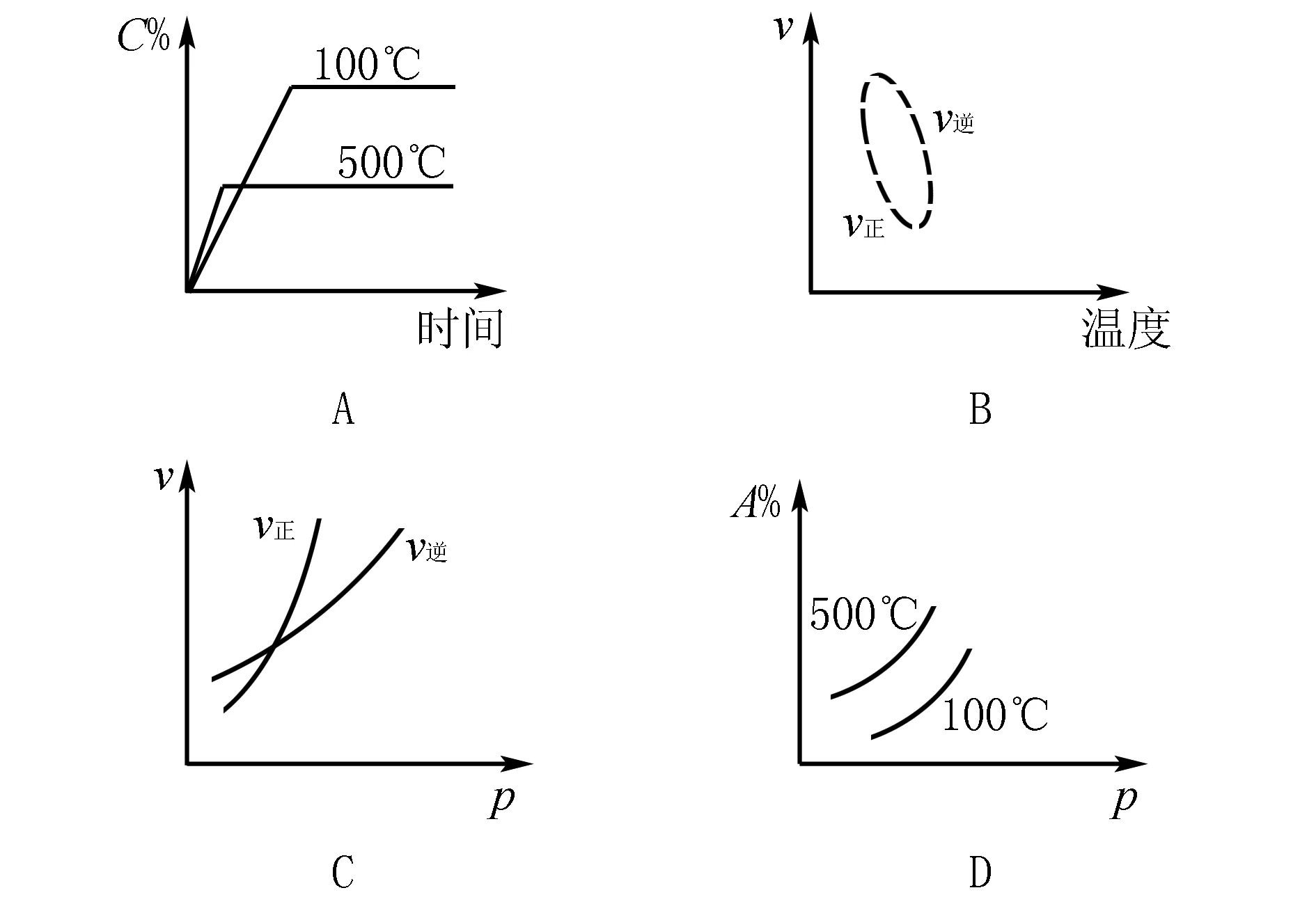
解析此反应的特点是气体总体积减小、放热的可逆反应.A中,温度越高,达到平衡的时间越短,但温度升高平衡左移,C的百分含量要降低,所以A正确.B中,表示温度与v的关系,随温度的升高,v正与v逆的总体趋势却下降,所以不正确.C中,随压强增大 ,v正、v逆都增大,但对正反应速率影响更大.D中随温度的升高A的转化率应当降低.
答案:A 、C
三、等效平衡

A.>p% B. 变式训练2:将例5中“固定容积”改为“容积可变” 变式训练3:将变式训练1中“固定容积”改为“容积可变” 解析容器体积固定,第二次填充后压强增大,平衡向气体物质的量减小的方向移动,所以例5的正确选项为A.变式训练1中压强增大平衡不移动,所以变式训练1的正确选项为C. 容器体积可变,两次填充各物质的浓度相同,为等效平衡.所以变式训练2、变式训练3的正确选项都为C. (1)该温度下反应的平衡常数. (2) NO2的转化率. 解析首先列出化学平衡的三段式: 起始(mol/L) 0.30 0 0 转化(mol/L) 0.24 0.24 0.12 平衡(mol/L) 0.06 0.24 0.12 (1)该温度下反应的平衡常数为: (2)NO2的转化率为: 解析已知:500℃时,K=9;起始时c(CO)=c(H2O)=0.02 mol·L-1. 设平衡时CO转化的物质的量浓度为x,则 起始浓度(mol·L-1) 0.02 0.02 0 0 平衡浓度(mol·L-1) 0.02-x0.02-xxx 解之得,x=0.015 mol·L-1
四、有关平衡常数,转化率的计算





