乳腺癌新辅助化疗后微钙化减少对肿瘤病理完全反应的预测
刘文佳 刘雨潇 杨正军 李君辉 曹旭晨
新辅助化疗(neoadjuvant chemotherapy,NAC)是局部晚期乳腺癌首选治疗方法,主要作用为乳腺癌降期、保乳,获得药物敏感性,指导治疗以改善患者预后。NAC后达到病理完全反应(pathological om⁃plete response,pCR)的患者有显著的生存优势[1-3]。乳腺核磁(magnetic resonance imagine,MRI)因不能准确识别微钙化(mcrocalcification,MC)导致诊断的准确性下降[4]。乳腺X线摄影(mammography,MG)检查有助于提高早期诊断率、降低死亡率,乳腺癌MG检查中最典型的特征是微钙化(mcrocalcification,MC)。NAC影响乳腺癌细胞的代谢,导致MC改变,NAC后MC的形态、分布范围、直径和密度均可发生改变。MC被认为是由细胞坏死引起,NAC后坏死细胞增加会导致NAC的MC反应。研究发现,患者的MC数量减少是NAC的主要反应[5-6]。目前,关于NAC对乳腺癌MC影响的研究较少,MC形成和改变的机制尚不清楚。本研究旨在通过探讨NAC后影响MC改变的因素和条件,分析MC减少与肿瘤病理完全反应(pathological omplete response,pCR)的相关性,评估MC减少对pCR准确性的预测。
1 材料与方法
1.1 研究对象
收集2015年1月至2018年12月天津医科大学肿瘤医院1 084例行NAC的女性乳腺癌患者的临床病理资料,均行NAC+乳腺癌切除术,MG检查显示MC(包含MC、肿块伴MC、MC伴结构扭曲等)患者行空芯针穿刺活检及术后病理学组织检查,其中869例患者因MG检查结果不准确、缺失被排除,215例纳入分析。根据MG检查中MC变化情况分为范围改变组及数量改变组,分析其临床特征。行NAC后215例患者的MC范围缩少为91例、增加为39例、不变为85例,MC数量减少为99例、增加56例、不变60例。
1.2 方法
1.2.1 MG检查 患者在NAC前后分别进行MG检查,采用标准四视图胶片方法,由放射科和乳腺外科医生评估乳腺MG图像,资深放射科医生阅片时采用相同视图评判对以上结果进行一致评估。根据乳腺影像报告及数据系统(breast imaging-reporting and data system,BI-RADS)对MC的形态、分布、范围、直径和密度等进行分类,并测量范围和计算数量。
1.2.2 乳腺癌分子分型 根据肿瘤的激素受体(hor⁃mone receptor,HR)和人表皮生长因子-2(human epi⁃dermal growth factor-2,HER-2)情况确定患者的分子分型,HR 阳性定义为雌激素受体(estrogen receptor,ER)阳性或孕激素受体(progestrogen receptor,PR)阳性;HR 阴性定义为ER 阴性和PR 阴性。将入组病例分为HR阳性/HER-2阴性、HR阳性/HER-2阳性、HR阴性/HER-2阴性、HR阴性/HER-2阳性4类。
1.2.3 NAC疗效判定 NAC后乳腺癌原发病灶pCR被定义乳腺无浸润性癌成分或者仅残存导管内癌成分。
1.3 统计学分析
采用SPSS 25.0和Med Calc 15.8软件进行统计学分析。多组数据采用单因素分析,采用受试者工作特征曲线(receiver operating characteristic curve,ROC)方法分析乳腺癌MC减少对pCR准确性的预测。P<0.05为差异具有统计学意义。
2 结果
2.1 MG检查结果
MC范围以最长直径为标准,分为直径<2 cm、直径>2 cm,行NAC后MC范围的增大定义为最大直径较前增大≥15%,缩小定义为减少≥15%,不变定义为最大直径增加或减少≤15%(图1)。MC数量分为≤20个或>20个,以MC清楚形态为1个计数单位,MC数量任意减少为减少,任意增加为增加,其余定义为不变(图2)。

图1 MG检查MC范围改变示意图
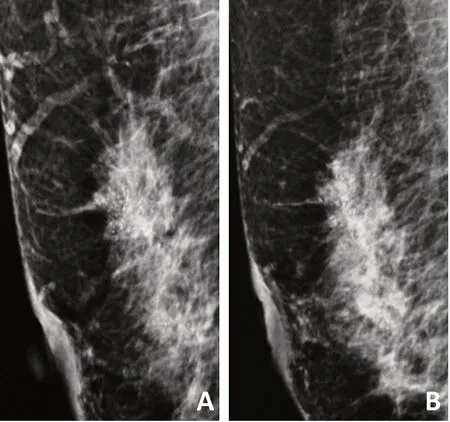
图2 MG检查MC数量改变示意图
2.2 影响MC变化的单因素分析
行NAC后,MC的分布、范围、数量与MC变化有关。患者的MC弥散分布、范围>2 cm,数量>20个更易出现MC范围缩小或数量减少,与MC形态学及病理分型相比差异具有统计学意义(表1)。
2.3 MC减少与pCR的相关性分析
根据NAC后MC数量减少或范围缩小进行分组发现,215例患者的MC范围缩小组为91例、非缩小组124例,范围缩小患者pCR的发生率高(61.7%vs.28.3%),两组比较差异具有统计学意义(P=0.022);MC数量减少组为99例、非减少组116例,数量减少组与pCR无显著性相关;分子分型不是MC范围缩小及数量减少与pCR相关性的影响因素(表2)。

表1 215例乳腺癌患者行NAC后MC的病理特征和MC变化模式
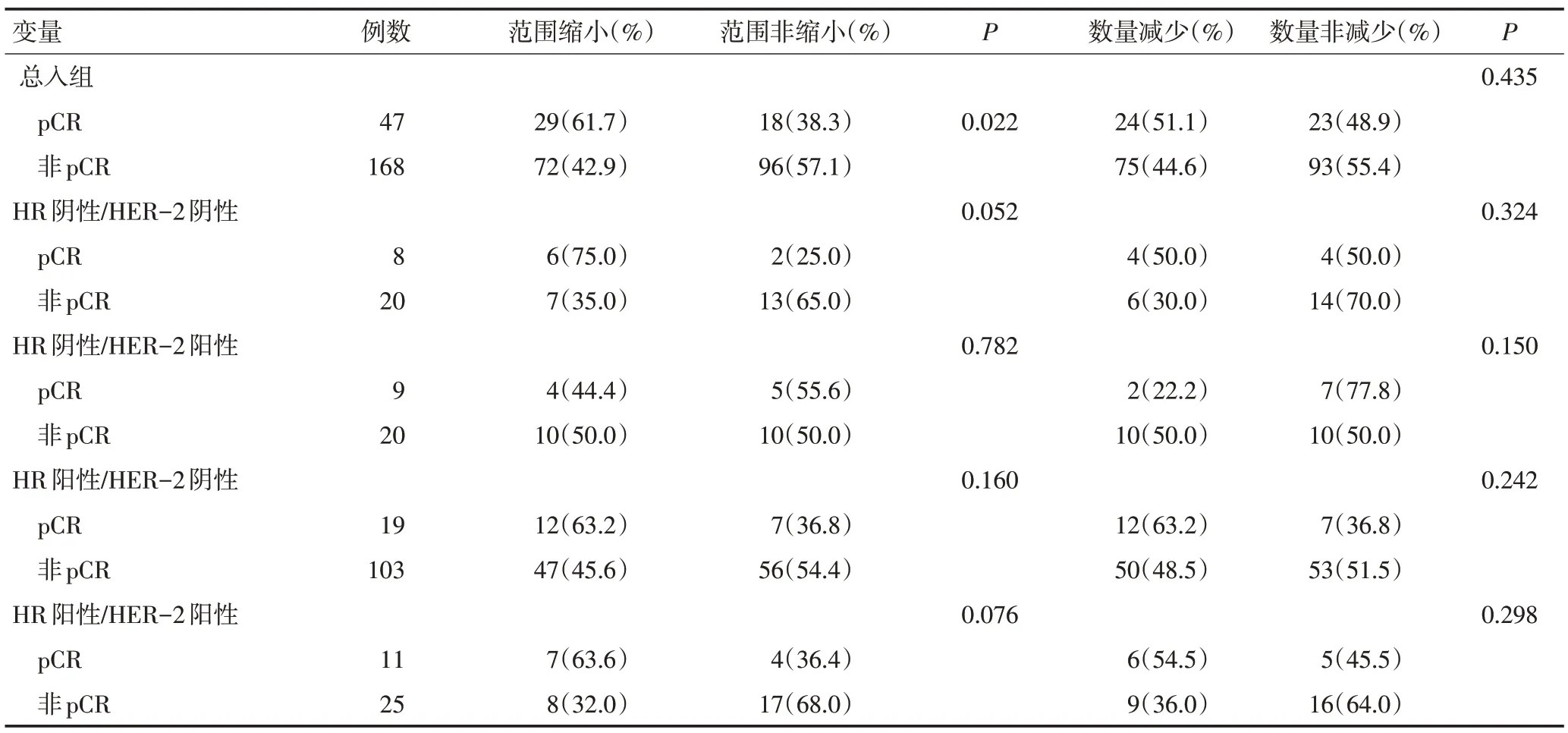
表2 MC减少与pCR的相关性分析
2.4 MG检查中MC减少对NAC预测的准确性分析
采用ROC方法对MC范围缩小和数量减少与pCR相关性的预测结果显示,MC范围缩小组预测pCR的曲线下面积(area under curve,AUC)值为0.676(95%CI为0.609~0.738),敏感度为77.78%、特异度为57.45%,差异具有统计学意义(P=0.000 1);MC数量减少组的AUC值为0.576(95%CI为0.506~0.642),敏感度为59.26%、特异度为55.85%,差异均具有统计学意义(P=0.000 1)。
3 讨论
研究表明,行NAC后乳腺癌MC范围和数量主要发生的改变是持续不变、消失甚至增加[7-8]。NAC抑制乳腺癌细胞增殖,降低癌病灶周围的多核巨细胞代谢活性,减少MC灶数量,肿瘤同心性收缩可导致MC范围缩小和密度增加[9-10]。MC改变与多种临床病理因素相关,本研究发现MC的分布状态、范围和数量与MC变化有关。
目前,对于NAC后残留的MC处理尚无共识或指南,行NAC后MG范围缩小和数量减少患者的pCR比例较高。Golan等[11]发现,与MC无改变的患者相比,行NAC后MC数量减少患者的pCR 率较高(59%vs.20%,P<0.006),但对于是否根据MC的范围缩少,认定肿瘤达到pCR减少手术的切除范围尚未统一。研究发现,MC数量减少与pCR 无显著性相关,不能反映NAC有效,MC数量增多亦不能证明无效[12-13]。导致以上结果,是因MC的范围测量及数量计算无统一方法。对于MC研究大多是自定标准,多为范围或数量两个方面[14-15]。本研究通过对MC范围缩小或数量减少与pCR 相关性评估发现,MC范围缩小组的pCR率高于非范围缩小组,但以MC范围缩小为标准来预测pCR 准确性不高。可能是因尚无对MC数量计算的精确方法,导致根据MC数量减少预测pCR的准确性较低[5]。虽然MC对乳腺癌具有较高的筛查和诊断性能,但在评价和预测NAC的pCR方面作用较差,尚不建议使用MC预测pCR。
综上所述,乳腺癌患者行NAC后MC改变因素为MC范围、数量及分布,MC范围缩小患者的pCR 率高,但MC减少对预测pCR准确性较低。本研究因存在部分数据缺失、样本量相对较小、人为测量和评估MC变化的情况,尽管可明显发现NAC引起的改变,但却降低了结果的准确性,并且主观性较强地评估MC改变,未使用图像分析软件,仅分析了MC数量和范围的改变,未评估MC形态及分布状态的改变与pCR的相关性,因此暂不推荐MG检查评估行NAC后是否达到pCR。

