细胞减灭术+腹腔热灌注化疗治疗腹膜假黏液瘤—单中心854例经验总结
夏奥 马瑞卿 翟喜超 卢一艳 蔡莺 史冠军 安鲁彪 王冰 庞少军 陈峰 许洪斌
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)主要是由黏液性肿瘤细胞通过再分布在腹腔内种植,导致黏液样腹水蓄积所引起的一种罕见的临床症候群[1-2]。肿瘤细胞几乎可来源于腹腔内任何脏器,但以阑尾为主要原发病灶,卵巢虽然常常受累但多为继发,据既往文献报道,阑尾来源的PMP约占整体的87.2%~94%[3-7],其年发病率约为2/1000 000[8]。
早期的PMP治疗以引流黏液腹水和单纯减瘤手术为主,1994年梅奥诊所对局部转移的PMP患者进行最大限度的减瘤并进行长期随访,结果显示约1/3的患者可获得长期的无瘤生存状态,10年生存率为32%[9]。随着Spratt所提出的细胞减灭术(cytoreductive surgery,CRS)联合腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)的治疗理念推广以及1995年Sugarbaker腹膜切除技术的提出[10-12],越来越多的文献报道CRS+HIPEC治疗PMP改善了预后生存。虽然缺少高质量的前瞻性研究证实,但目前CRS+HIPEC已经成为国际公认的治疗PMP最有效的手段。
航天中心医院腹膜假黏液瘤诊治中心从2008年开始致力于PMP的诊治工作,熟练掌握了CRS+HIPEC治疗技术。本文旨在通过中心数据库中PMP患者的临床资料回顾分析,对本中心治疗经验进行总结。
1 材料与方法
1.1 病例筛选
回顾分析2008年1月到2019年1月本院收治并接受手术治疗的PMP患者临床资料。其中PMP定义及病理分类以2016年腹膜表面肿瘤国际协作组(Peritoneal Surface Oncology Group International,PSOGI)专家共识为参照[2]。对既往诊断或分类不明确病例请病理科医师重新读片按最新病理标准进行分类。术前常规行腹盆腔增强CT扫描并口服对比剂检查;胃镜及肠镜检查除外胃及结肠来源肿瘤;留血清肿瘤标记物化验(CA19-9、CA125、CEA)。
研究入组患者共854例,男女比例为1:1.44,平均年龄为50岁。患者自初次诊断PMP到本院手术的平均时间间隔为454 天,就诊时中位腹膜肿瘤指数(peritoneal cancer index,PCI)为29(0~39)(表1)。0区、6 区以及7 区为PMP 最常见受累部位(表2)。其中218例患者达到完全性细胞减灭术(complete cyto⁃reductive surgery,CCRS),占25.5%。总体平均手术时间为460(80~860)分钟,平均住院天数为31 天,10.8%的患者接受造瘘治疗。
1.2 方法
1.2.1 肿瘤负荷评价 因PMP肿瘤侵袭能力差,往往附着于腹膜或脏器表面浆膜生长,不同脏器表面肿瘤初治时一般相对独立,有间隙可予分离。在手术切除过程中,肿瘤一般可与其所依附的脏器整块移除,不受腹部分区限制。我们对既往PCI 评价体系进行改良,不通过严格的腹部9分区法进行区域分割[12],改用以脏器解剖为基础的评分体系。其中0 区定义为整个大网膜区域;1区为右肝膈间腹膜;2区为肝胃间网膜及腹膜结构,横结肠及系膜腹膜;3 区为左肝膈腹膜、脾脏及周围脏壁层腹膜;4 区为降结肠周围及左侧壁层腹膜;5区为乙状结肠周围及左髂窝腹膜;6区为盆腔腹膜及直肠或子宫;7区为回盲部及右髂窝腹膜;8 区为升结肠周围及右侧腹膜。9~12 区同既往PCI 评价将小肠分为近段空肠、远段空肠、近段回肠和远段回肠4 段。各区域分数赋值为:无肉眼可见肿瘤为0分;肿瘤直径小于5 mm 记1分;5 mm~5 cm 之间记2分;5 cm 以上记3分。满分为39分(例如巨大大网膜饼覆盖整个腹腔并部分卷入肝膈或脾膈间隙,也只算0区分值,PCI仅增加3分而不记为27分,后者严重高估了手术难度)。
1.2.2 手术方式及根治程度 2016年以前,手术方式采用传统以肿瘤联合器官切除的减瘤方式尽可能切除所有肉眼可见的肿瘤组织;2016年开始应用Sugarbaker所述腹膜切除流程[11],从腹膜外解剖,采用腹膜切除联合脏器切除的手术技巧完成减瘤操作。

表1 患者基本临床特征 (n=854)

表2 就诊时各区受累情况 (n=854)
其中细胞减灭程度(completeness of cytoreduction,CC)标准如下[12]:CC-0:无肉眼可见残留;CC-1:<2.5 mm;CC-2:2.5 mm~2.5 cm;CC-3:>2.5 cm。其中CC-0/1定义为CCRS,为PMP的根治性手术;CC-2/3则为姑息性手术。
1.2.3 腹腔热灌注化疗 术中HIPEC 在CRS 后,消化道重建之前,视患者循环稳定情况实施。灌注采用封闭式:在盆腔和双侧上腹部留置乳胶引流管后,采用连续缝合方式封闭皮肤并固定乳胶引流管,取头稍高位,盆腔导管为入水口,双上腹导管出水,循环速度控制在800~1 000 mL/min,入体测温探头将人体温度控制在43.5℃,出体探头温度控制在41℃左右。药物选用丝裂霉素(mitomycin,MMC)30 mg/顺铂(cisplatin,DDP)60~80 mg,溶剂用生理盐水。术后如患者病情稳定,从术后第2天开始在病房连续行腹腔热灌注化疗,温度同术中,药物为5-FU 1 g,视耐受情况行1~5次治疗。
1.2.4 术后随访 患者手术后前5年每3~6个月进行复查,5年以后每年复查一次,内容包括腹盆CT及肿瘤标记物。随访截止至2019年4月30日。手术并发症情况以Clavien-Dindo术后并发症评级系统为标准[13]。Ⅲ、Ⅳ级为围术期主要并发症,Ⅴ级为围术期死亡。
1.3 数据分析
采用SPSS 25.0软件进行统计学分析。计量资料采用t检验和秩和检验,计数资料采用χ2检验,分类变量相关线性分析采用Logistic 回归检验分析;Ka⁃plan-Meier 方法计算总生存,生存比较采用Log-rank检验,预后多因素分析采用Cox 比例风险模型。P<0.05为差异具有统计学意义。
2 结果
2.1 手术方式对比
按手术方式变化的时间节点将患者分为传统减瘤组与腹膜切除组(表3)。两组患者中位PCI分别为28和29,差异无统计学意义,但传统减瘤组的CC-0/1比例为14.3%,明显低于腹膜切除组的36.5%(OR=0.406,P<0.001);其并发症发生率显著高于腹膜切除组(28.8%vs.16.8%,OR=1.718,P<0.001)。在PCI>20的高肿瘤负荷患者中,采用腹膜切除术的患者仍有17.2%(53/308)得以实施CCRS,而传统减瘤组中该比例仅占3.4%(11/321)。

表3 两种手术方式对比 n(%)
2.2 并发症分析
术后Ⅲ~Ⅳ级并发症发生率为21.7%,围手术期死亡率为1.1%。对各因素与Ⅲ~Ⅴ级并发症之间的关系进行单因素分析,结果提示传统减瘤、CA125异常、CEA异常、CA19-9异常、术后无灌注、术中无灌注、PCI>20、待术时间长和接受非根治性手术为影响术后主要并发症(Ⅲ~Ⅴ级)发生的因素。对各类影响因素进行Logistic回归分析,仅传统减瘤手术(OR=2.08,P=0.01)、PCI>20(OR=4.23,P=0.01)为独立危险因素。
2.3 生存分析
所有患者均顺利随访,中位随访时间22(3~129)个月,总体5年和10年总生存率(overall survival,OS)分别为52.7%、44.8%,中位OS为66个月(图1)。改良PCI为0~10、11~20、21~30、31~39的患者5年OS分别为86%、69%、50%和40%(图2)。手术达到CC-0、CC-1、CC-2及CC-3的患者5年OS分别为87%、68%、50%和42%(图3),传统减瘤手术3、5、10年OS分别为62%、48.9%、41.9%,腹膜切除手术的3年OS为75.8%(图4)。在CC-0/1的患者中,腹膜切除组3年OS为88.6%,与传统减瘤组类似(3年OS:78.7%,P=0.297);CC-2/3的患者中两者3年OS差异无统计学意义(68.8%vs.59.3%,P=0.058)。在高肿瘤负荷(PCI>20)的患者中,腹膜切除组生存优势显著(3年OS 70.7%vs.57.4%,P=0.015)。对各项临床特征进行单因素分析,结果提示血清CA125异常(P<0.001)、CEA异常(P<0.001)、CA19-9异常(P<0.001)、改良PCI(P<0.001)、病理级别(P<0.001)、术中热灌注(P<0.001)、术后热灌注(P<0.001)、是否来源阑尾(P=0.007)、根治程度(P<0.001)、手术方式(腹膜切除技术)(P<0.001)均为影响OS的因素。而灌注药物选择(P=0.165)和性别(P=0.861)未体现出与OS的明显相关性(表4)。

图1 所有PMP患者生存曲线

图2 不同改良PCI的PMP患者5年生存曲线

图3 不同细胞减灭程度的PMP患者5年生存曲线
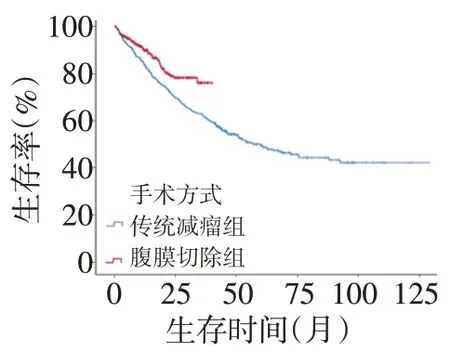
图4 不同手术方式的PMP患者5年生存曲线

表4 单因素分析结果 (n=854)
多因素分析显示改良PCI、手术方式、术中热灌注、病理级别、CA125水平为影响OS的独立危险因素(表5)。
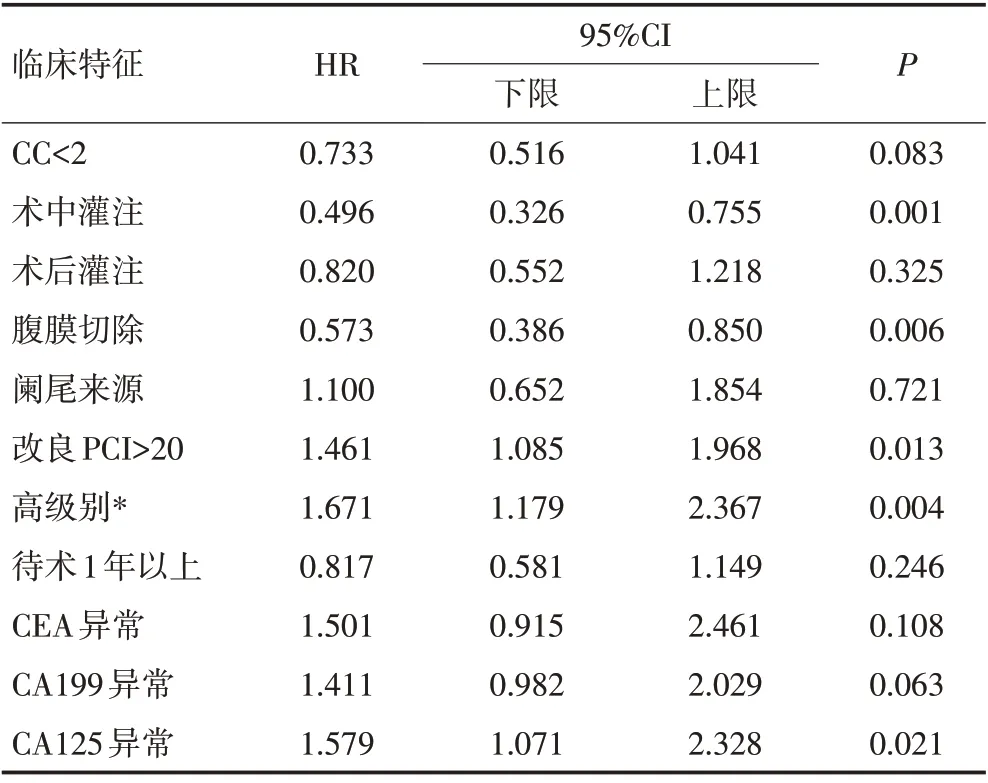
表5 多因素分析结果
3 讨论
因PMP发病率极低,目前尚无前瞻性研究发表,但基于回顾性研究所报道的生存结果,CRS+HIPEC已经成为了国际公认的PMP标准治疗方案。据既往文献报道,接受CCRS治疗后的患者10年生存率高达54%~70%,而CC-2/3的患者5年生存率为20%~39%[14-21]。本研究结果CC-0/1的5年和10年生存率分别为77%、64.3%,CC-2/3 的5年和10年生存率分别为45.8%、39.4%,与既往研究基本相当。CRS+HIPEC策略所带来的生存收益显著,且手术能否达到根治切除是PMP患者治疗的关键所在。治疗过程中围手术期并发症发生率为21.7%,死亡率仅为1.1%,CRS+HIPEC治疗PMP的安全性可以得到保证。
腹膜切除术作为CRS治疗的核心技术,由Sugar⁃baker在1995年提出,他将腹膜作为一个器官和腹腔内转移性肿瘤的天然屏障,并发表了详细的腹膜切除技术流程,而后被大家广泛应用[11]。本中心从2016年引入腹膜切除技术,虽然随访时间仅3年,但从生存曲线可以看出较既往传统的腹腔内减瘤手术,近年来患者生存情况得到了显著改善。2016年之前,本中心CC-0/1比例仅为14.3%,2016年以后该比例提升至36.5%。按根治程度分别对两种手术方式预后进行比较,两者之间的显著生存差异消失,生存优势很大程度得益于根治水平的提高。从研究数据亦可以看出,对PCI>20的患者而言,腹膜切除组生存更为明显。基于PMP 低侵袭的特性,从腹膜外正常解剖间隙可更方便地整块切除肿瘤而非在巨大黏液肿块中进行操作,大大地降低了手术切除难度,对于PCI>20的患者,腹膜切除组17.2%(53/308)的患者得以实施CCRS,而传统减瘤组仅为3.4%(11/321)。与此同时,操作的可行性增加也大大降低了术后并发症的发生几率。
在本研究之前,国外文献报道的CC-0/1 患者的比例占总体的67%~90%[15,17,19-20],与之相比本中心尚存在较大差距,考虑与患者初诊手术时间、肿瘤负荷及PCI评价方法有关。本中心为黏液瘤专科中心,并不常规诊治阑尾炎或胃肠道肿瘤的患者,就诊于本中心80%以上的患者在院外具有1 次以上的减瘤手术治疗经历,使手术难度增加。对患者腹腔内PCI评价并非基于严格的腹部九分法进行记分[22],而依据器官解剖对肿瘤负荷进行系统评价,改良后的PCI分值可能低于既往文献报道。基于中心治疗经验,PMP 肿瘤侵袭性往往较差,占据腹腔空间的往往是大网膜饼或充满黏液的巨大卵巢,这些依附于器官的肿块一般向四周呈挤压式生长而很少侵犯腹部其他分区内脏器,各器官周围局部的黏液性肿块也通常可以和器官一起整块移除。因此,按照腹部九分法的PCI指数可能高估了手术难度以及可切除性,既往研究并未体现出PCI 与预后相关性也从侧面证实了此点[23]。基于改良的PCI指数评价,本中心患者中位PCI 指数亦高达29,肿瘤负荷远远高于既往研究。不同于既往研究的是,所有在本院初次手术减瘤的患者都纳入本次研究当中,未充分行病例筛选进行手术治疗也是降低CCRS比率的主要因素之一[17]。
对整体生存数据的分析结果显示,血清肿瘤标记物水平[24-25]、根治程度[15]、术中/术后是否行腹腔热灌注化疗治疗[26-27]、病理[16,19]均为预后影响因素,与既往研究结果一致。但多因素分析结果中,仅改良PCI 指数、手术方式、术中热灌注、病理级别、CA125水平为影响预后的独立危险因素。腹膜切除术所带来的临床价值不再赘述,值得一提的是改良后的PCI指数体现出对预后的显著预测价值。虽然在多因素分析中,CC-0/1未得出统计学差异,但作为目前唯一对干预程度客观评价的指标,临床价值仍不容忽视,CCRS 治疗后患者良好的生存结局指导着外科干预的方向,此外,CC-2 和CC-3 患者间生存也存在着明显差异(P=0.006),预示着即使对于外科手术无法完全切除的PMP 患者,最大限度地减除肿瘤负荷亦可提高患者的远期生存率。既往也有研究试图证实最大耐受剂量(maximum tolerated dose,MTD)对PMP 患者的临床价值,但局限于单组生存分析且无对照设置,均提示MTDS 并不会增加围手术期并发症风险[28-30]。
总体而言,PMP 患者虽然腹膜广泛转移,但因为低侵袭性及缺乏远处转移能力,不同于其他种类的恶性肿瘤,即使对于改良PCI>20 或高级别肿瘤的患者,外科干预以后仍能获得良好的远期生存,不应该将其与其他恶性肿瘤腹膜转移一概而论。对于PMP患者来说,手术充分探查腹腔并对瘤体负荷充分评价并进行记录尤为必要,而腹膜切除术为达到根治切除提供了更高的可行性。
作为回顾性研究,本文仍存在一些局限性。首先,因为本中心的特殊性,就诊患者在全国各地经过层层筛选,导致总体肿瘤负荷偏高。其次,随访过程中影像学资料缺失,无法对复发、生存数据进行评价也是本研究的缺陷。最后,化疗相关资料不全,术中不常规对淋巴结进行清扫导致无法对相关因素进行临床分析。
因疾病罕见,目前国内外对于PMP 基础及临床研究仍处在起步阶段,亟需前瞻性的研究以提供更高质量的证据支持,同时也期待更高质量的研究结果发表。
PMP患者在接受CRS+HIPEC治疗后可获得良好的预后,对于无法达到根治切除的患者,外科干预也可延长患者生存时间,其中改良的PCI 指数、手术方式、术中热灌注、病理级别、血清CA125 水平为影响预后的独立危险因素。其次,腹膜切除技术是PMP患者外科治疗中的必备手段,可显著提高切除率同时降低并发症发生风险。改良的PCI 评价体系可更好地体现出腹腔内肿瘤情况,与手术难度相关并与预后关系密切,建议临床推广。

