结直肠癌腹膜转移治疗的临床研究进展
向文强 蔡国响
结直肠癌(colorectal cancer,CRC)是第三常见的恶性肿瘤,5%~15%的CRC 患者会发生同时性腹膜转移(peritoneal metastasis,PM),20%左右会发生异时性PM。CRC PM 是仅次于肝肺转移的第三常见转移,TNM分期系统将其分为M1c期,通常采用姑息性治疗,预后差。随着药物治疗的进展,转移性CRC患者的预后有所改善。但是,PM 患者的生存获益仍然较少。腹膜肿瘤细胞减灭术(cytoreductive surgery,CRS)/腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)治疗手段的出现显著改善了PM患者的预后[1]。CRS/HIPEC治疗后,PM患者仍有较高的复发风险。因此,有学者探究了经CRS/HIPEC 治疗后复发的PM 患者再次应用CRS/HIPEC的治疗价值[2]。一些新的治疗方法,如腹腔加压气溶胶化疗(pressurised intraperitoneal aerosol chemothera⁃py,PIPAC)和腹腔MOC31PE抗毒素治疗开始应用于CRC PM 患者,并取得了一定成效[3]。本文拟对CRC PM 治疗的临床研究进行综述,为临床实践和研究提供参考。
1 结直肠癌腹膜转移的外科治疗
影像学检查评估是重要的手术前准备工作。CT对PM的灵敏度与病灶大小正相关,对于<0.5 cm的病灶,灵敏度为11%~70%,对于>3cm的病灶,灵敏度为90%~94%[4]。PET/CT对诊断PM的灵敏度为57%~86%,且对位于肠系膜和小肠的转移灶更有优势[5]。全身弥散加权MRI对PM诊断的灵敏度和特异度分别为80.3%和84.5%,能更准确评估肿瘤负荷[6]。PM肿瘤负荷的评估主要包括腹膜癌指数、腹膜表面疾病严重程度评分和结直肠癌腹膜转移生物学评分,有助于选择合适的患者进行CRS/HIPEC治疗。
1.1 结直肠癌腹膜转移肿瘤负荷评估
1.1.1 腹膜癌指数(peritoneal carcinomatosis index,PCI) 目前,临床上评估腹膜肿瘤负荷常采用PCI,将整个腹腔分为13个区:中央区、右上腹区、上腹中部区、左上腹区、左侧腹区、左下腹区、盆腔区、右下腹区、右侧腹区等共9个区和回肠近侧区、回肠远侧区、空肠近侧区和空肠远侧区等4个区。对应的腹膜病灶大小评分(lesion size score,LS)分为四级:LS 0:未见肿瘤;LS 1:肿瘤≤0.5 cm;LS 2:0.5 cm<肿瘤≤5 cm;LS 3:肿瘤>5 cm或融合成团。PCI评分即为每个区LS 评分的总和。PCI 是一种量化腹膜转移病灶范围的评分系统。研究表明,PCI 是CRC PM 的独立预后因素[5]。此外,PCI 评分也可指导治疗决策。目前认为,PCI>20或25不建议进行CRS/HIPEC治疗[7]。
1.1.2 腹膜表面疾病严重程度评分(peritoneal sur⁃face disease severity score,PSDSS) PSDSS 是基于患者临床症状、腹腔播散程度(即PCI)以及原发肿瘤组织学特征的评分方法。根据所得三项分数的总和将PSDSS分为四期:PSDSS Ⅰ:2~3分;PSDSS Ⅱ:4~7分;PSDSSⅢ:8~10分;PSDSS Ⅳ:>10分(表1)。研究表明,PSDSS 是独立的预后因素,能预测接受CRS/HIPEC 的患者的长期生存可能性[8]。Arjona-Sanchez等[9]的研究显示,RAS野生型CRC PM患者接受CRS/HIPEC 治疗后PSDSS Ⅰ~Ⅳ的5年生存率分别为:61.8%,39.9%,24.4%和0;RAS 突变型患者的5年生存率分别为:28.4%,26.4%,27.1%和0。最后提出将RAS 突变状态纳入PSDSS 系统,形成新的RAS-PS⁃DSS 体系。RAS-PSDSS分为Ⅰ~Ⅳ期,评判标准为:Ⅰ期:PSDSS 2~3分+RAS 野生型;Ⅱ期:PSDSS 4~7分+RAS 野生型;Ⅲ期:PSDSS 8~10+RAS 野生型或PSDSS 2~10分+RAS 突变型;Ⅳ期:PSDSS>10分+任何RAS突变状态。
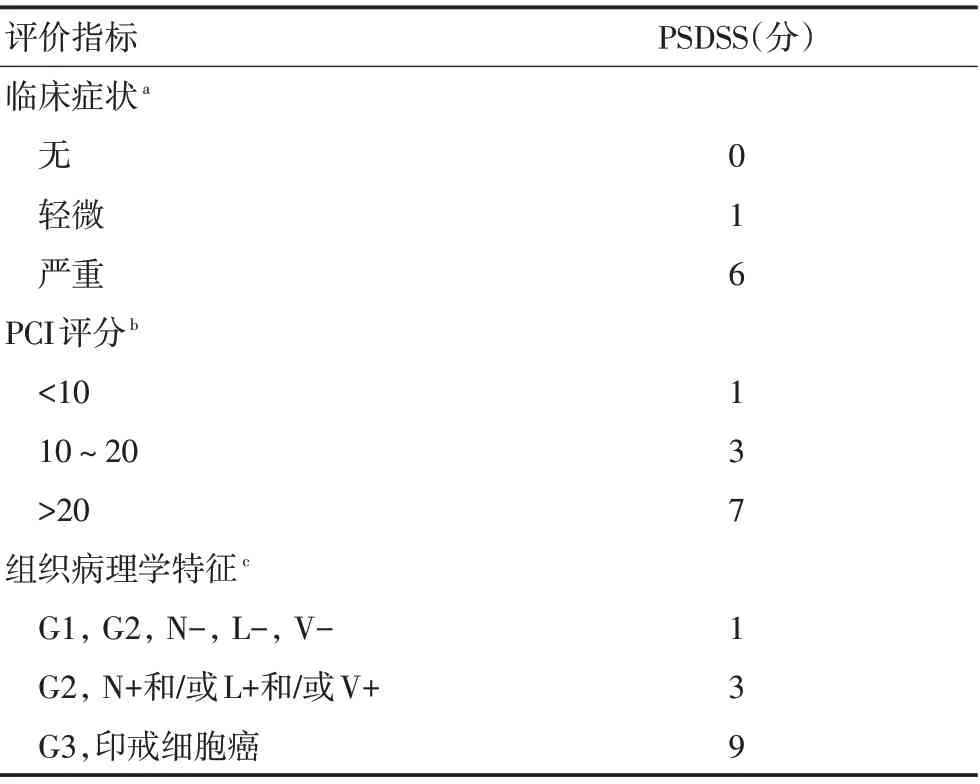
表1 PSDSS评分标准
1.1.3 结直肠癌腹膜转移生物学评分(biological score of colorectal peritoneal metastasis,BIOSCOPE) Schneider等[10]发现,PCI,N1,N2,G3和KRAS/BRAF突变能显著影响CRC PM患者CRS/HIPEC治疗后的生存率,从而构建了基于PCI、N分期、G分级和RAS/RAF状态的腹膜转移生物学评分标准BIOSCOPE(表2),并根据四个项目的总分数分为四个风险组。A风险组:0分,B风险组:1~3分,C风险组:4~7分,D风险组:≥8分。BIOSCOPE评分越高,患者预后越差。因此,BIOSCOPE有助于选择患者进行CRS/HIPEC治疗。
1.2 肿瘤细胞减灭术(cytoreductive surgery,CRS)
与传统的姑息性手术不同,CRC PM 的CRS治疗要求尽可能切除所有肉眼可见的病灶及受累的器官组织,包括大网膜、小网膜、胆囊、阑尾和卵巢,甚至需要合并切除部分小肠、直乙结肠、子宫、肝包膜、脾脏和远侧胃等脏器组织。尽管CRS 手术范围较广泛,但多数患者生活质量在术后6个月可恢复至基线水平。CRS联合HIPEC后,能改善CRC PM患者的预后[11]。对于可切除的PM,推荐CRS 联合HIPEC 和系统性化疗的多学科综合治疗。
一些CRC PM患者也同时合并肝转移(LM)。合并LM曾被认为是CRS/HIPEC治疗的禁忌证。但是,Goere等[5]综述了多项研究,其中一项报道当PCI<12且LM病灶<3处时,完全切除LM和PM后中位生存期(median overall survival,mOS)可达40月(95%CI,27~53个月),当PCI≥12或LM病灶≥3处时,mOS降至27个月(95%CI,19~35个月)。因此,对一些比较局限的CRC PM伴LM的患者可进行CRS/HPEC治疗联合LM病灶切除。
尽管CRS给PM患者带来生存获益,48%~70%患者术后仍会复发,其中31%~57%的患者复发部位仍然局限于腹膜[12]。因此,一系列研究开始探索,是否能选择合适的患者进行再次CRS。Huang等[13]发现,CRC PM复发患者接受二次CRS比单次手术患者的生存期(overall survival,OS)更长(56.1个月vs.27.4个月,P<0.01),5年生存率更高(42.6%vs.27.7%,P<0.01)。同样,Choudry等[2]也发现,CRC PM复发患者再次CRS/HIPEC治疗组的OS较单纯HIPEC治疗组显著延长(82.9个月vs.32.9个月,P<0.001)。因此,合适的CRC PM复发患者也可再次进行CRS/HIPEC治疗。
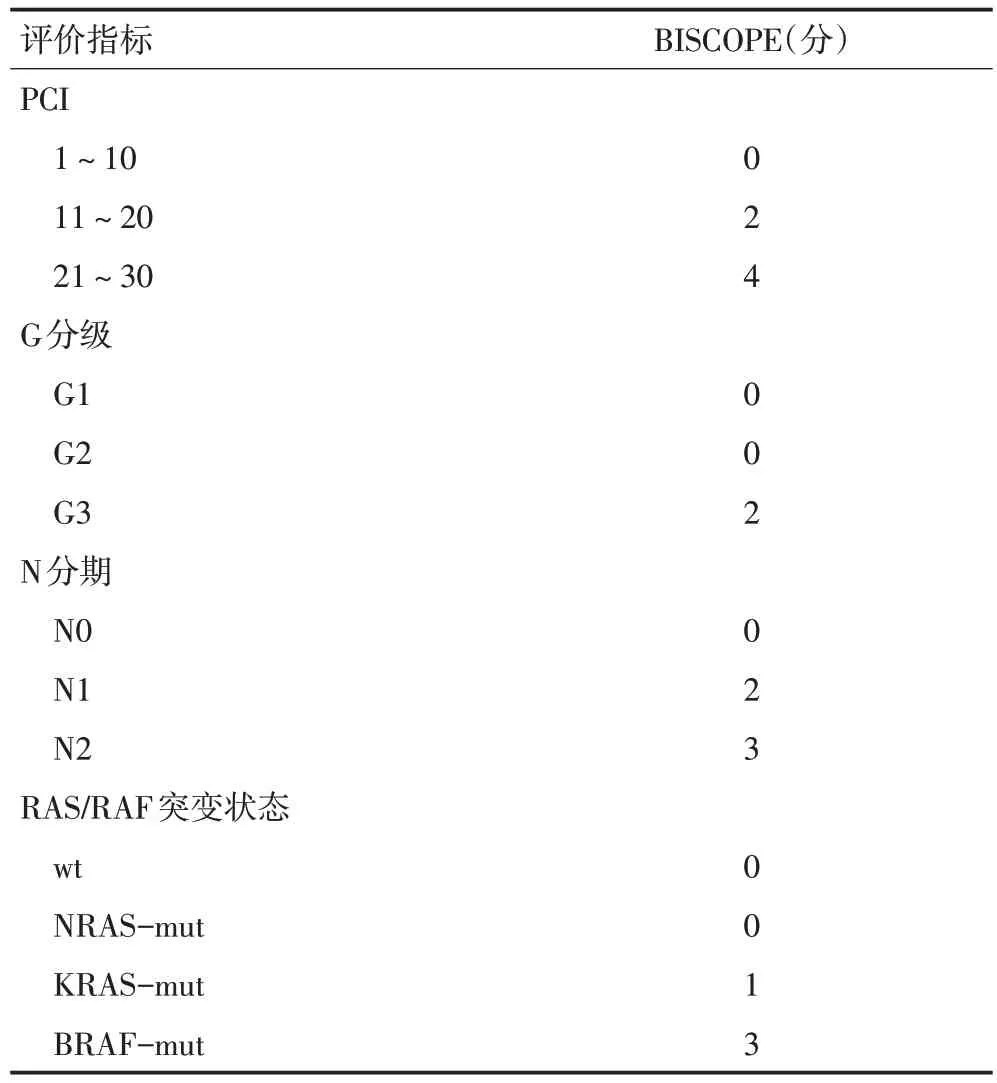
表2 BIOSCOPE评分标准
1.3 肿瘤细胞减灭术的彻底程度评分
腹膜减瘤手术的彻底程度通常采用CC(com⁃pleteness of cytoreduction)评分和R 评分进行评价。CC 评分通过测量残留肿瘤组织的最大径进行分级:CC 0:无肿瘤残留;CC 1:残留肿瘤组织<0.25 cm;CC 2:0.25 cm<残留肿瘤组织<2.5 cm;CC 3:残留肿瘤组织>2.5 cm。R评分分为:R0指无肉眼可见肿瘤残留,并且镜下切缘阴性;R1指无肉眼可见肿瘤残留,镜下切缘阳性;R2指有肉眼可见肿瘤残留。R2进一步分为R2a:残留病灶<5 mm;R2b:5 mm<残留病灶<2 cm;R2c:残留病灶>2 cm。CC 评分和R 评分均是患者预后的预测因素[14-15]。
2 结直肠癌腹膜转移腹腔化疗
腹腔化疗按照介质可分为:液体、固体和气体腹腔化疗。其中,液体为介质的腹腔化疗最为常用。按照液体的温度,进一步分为常温腹腔化疗和腹腔热灌注化疗(hyperthermic intraperitoneal chemothera⁃py,HIPEC)。以固体为介质的腹腔化疗主要是氟尿嘧啶类的腹腔缓释药物治疗。以气体为介质的腹腔加压气溶胶化疗(pressurized intraperitoneal aerosol chemotherapy,PIPAC)是近年来兴起的腹腔化疗。
2.1 腹腔热灌注化疗
在局部手术治疗方法出现之前,CRC PM主要采用全身化疗,但生存获益不明显。由于应用化疗后腹膜转移患者预后仍然较差,考虑到腹膜的厌氧环境及化疗药物渗透作用差,发明了HIPEC和CRS。研究报道,CRC PM应用HIPEC显著改善了给药效果,联合CRS后,并发症、死亡率以及长期生存均有所改善[11]。多中心研究指出,CRS/HIPEC的并发症和死亡率均在可接受范围内;在较大的医学中心,其并发症发生率与其他常见胃肠手术相当[14]。常见的并发症可分为手术相关并发症,包括吻合口瘘、出血、伤口感染和腹腔感染,化疗相关并发症包括中性粒细胞减少、心律失常和肾功能不全,以及其他并发症如血栓形成、肺栓塞以及肺炎等,死亡率为0~12%[7,14]。
一项荷兰的前瞻性临床研究结果显示,与单纯接受姑息性全身化疗相比,CRS/HIPEC联合全身化疗可显著延长mOS(22.3个月vs.12.6个月,P<0.05)[14]。法国Gustave Roussy医院的研究显示,CRC PM患者积极进行CRS/HIPEC治疗,5年生存率可达36.5%,接近CRC LM的治疗水平[5]。瑞典一项Ⅲ期临床研究报道,对于可切除的孤立性PM,CRS/HIPEC优于单纯的姑息性全身化疗(mOS 25个月vs.18个月,P<0.05)[1]。但是,2018年ASCO年会上公布的PRODGIE 7研究结果显示,CRC PM(PCI≤25)接受完全CRS联合HIPEC治疗组与单纯接受CRS治疗组的mOS分别为41.7个月和41.2个月,二者无显著差异。进一步亚组分析发现,PCI在11~15分的亚组可以从HIPEC治疗中获益,HIPEC治疗组与非HIPEC治疗组的mOS分别为41.6个月和32.9个月(P<0.05)[16]。该研究尚未正式发表论文,一些可能影响结果的数据并没有披露,包括治疗组和试验组接受围手术期化疗的具体方案和完成度、腹膜转移率等。对照组也有一部分患者,因再次出现腹膜转移而接受了HIPEC治疗,这可能会对总生存结果产生干扰。目前,美国NCCN指南、ESMO指南以及CRC PM诊治中国专家意见,均推荐有经验的医学中心可对PM较局限、且能达到完全切除的患者进行CRS+/-HIPEC治疗[17-19]。
2.2 腹腔加压气溶胶化疗
近年来,PIPAC被提出作为一种新的腹腔内给药方式,具有药物分布均匀、组织吸收良好以及耐受性好等特点。结直肠癌腹膜转移PIPAC 药物主要是奥沙利铂,也有研究指出,PIPAC 联合全身细胞毒化疗以及贝伐单抗是可行的、安全的且耐受性较好,但潜在的生存获益有待证实[20]。PIPAC可单独使用,也可与全身化疗交替使用,即每隔6±2 周进行1 次PIPAC治疗,间歇期全身化疗一个疗程,一般进行3 次。随后可根据患者耐受性及治疗反应性,决定是否需要继续PIPAC治疗。
2019年7月,Alyami等[3]在Lancet Oncology上发表的系统综述中指出,接受PIPAC治疗的患者,安全性良好。在前瞻性研究中,术中和术后并发症分别为3%;在回顾性研究中,其分别为0~11%和0~6%。并发症主要为肠梗阻(0~5%)、出血(0~4%)和腹痛(0~4%)。在前瞻性研究中,死亡率为0,回顾性研究中为2.7%。PIPAC治疗外周药物摄取量少,肝肾毒性小[21-22],34%患者的腹膜转移相关症状得到改善或完全缓解,生活质量相对稳定或有所提高[23]。Girshally等[24]对无法进行CRS/HIPEC的患者采用PIPAC作为新辅助治疗,影像学及组织病理学分别发现,78%和89%患者的病灶缩小,使CRS/HIPEC治疗成为可能。
综上所述,PIPAC 的可行性、安全性、耐受性、肿瘤学效应以及患者生活质量均较好,PIPAC已经在欧洲应用。但由于临床试验仍在进行中,长期结果有待观察。同时PIPAC的禁忌证需要重视,包括预期寿命不足3个月、肠梗阻、全肠外营养、腹水失代偿、肿瘤减灭同时切除肠管、化疗药物过敏史;相对禁忌证包括腹腔外转移、ECOG 评分大于2 以及门静脉血栓形成[3]。由于目前尚无大型前瞻性对比研究,无法明确PIPAC的适应证。其潜在的适应证包括:无法进行CRS/HIPEC、二三线全身化疗后疾病进展、难治性腹水、全身化疗不耐受以及不良组织病理学类型(印戒细胞癌)等PM患者。
2.3 腹腔MOC31PE抗毒素治疗
CRS/HIPEC使CRC PM患者获得长期生存,有时甚至可以达到治愈效果。然而,多数患者还会复发。因此,现有治疗方案仍有待改进。基于此,Frøysnes等[25]开展了ImmunoPeCa Ⅰ期临床试验,评价CRC PM患者接受CRS/HIPEC后,应用腹腔MOC31PE抗毒素治疗的安全性及毒副作用。研究结果显示,腹腔MOC31PE治疗安全性和耐受性好,腹腔药物浓度高,全身药物暴露量极少。MOC31PE抗毒素由靶向肿瘤相关抗原上皮细胞黏附分子(EpCAM)的MOC31单克隆抗体和假单胞菌外毒素A(PE)组成,可被整合入表达EpCAM的肿瘤细胞,通过干扰蛋白合成和诱导凋亡等导致肿瘤细胞死亡。
2019年4月,Frøysnes等[26]公布ImmunoPeCa试验的随访结果:中位随访时间34个月,mOS未达到,3年OS为78%,平均无病生存期(mean disease-free survival,mDFS)21月,3年DFS为33%。排除具有良好预后特征的患者后再次分析,mDFS为13个月,3年OS为72%。扩展队列中无3级及以上的毒副反应。因此,CRC PM患者接受CRS/HIPEC后,应用MOC31PE治疗安全性良好,但MOC31PE的临床疗效还需要更多大型研究进一步证实。
3 全身化疗
随着新的化疗药物的出现,转移性CRC 患者的预后显著改善,OS从不到6个月延长到20个月以上,肝肺转移灶切除率也增加。然而,PM 患者的生存获益仍然较少。直到CRS/HIPEC 治疗手段的出现后,才显著改善了PM患者的预后[27]。
随后,一些研究者开始探索全身化疗作为CRS/HIPEC 治疗前的新辅助治疗或CRS/HIPEC 治疗后的辅助治疗价值。Ceelen等[28]发现,在CRS/HIPEC治疗前应用全身化疗联合贝伐单抗,可延长CRC PM患者的OS。Vassos等[7]发现,接受新辅助化疗后,16.9%的的CRC PM患者组织病理学反应良好,且这些患者的生存时间比没有接受新辅助化疗的患者显著延长(P=0.003)。然而,Waite等[29]的研究未能证实新辅助治疗能延长OS。因此,全身化疗作为CRS/HIPEC 治疗前的新辅助治疗价值尚不能确定。同时,有学者探讨了全身化疗作为CRS/HIPEC 之后的辅助治疗的价值。Waite 等[29]的系统性综述指出,全身化疗作为CRS/HIPEC 后辅助化疗能改善OS,但还需要开展随机对照临床研究进一步证实此结论。
4 结语
随着CRS/HIPEC的出现,合适的CRC PM患者接受包括CRS、HIPEC 和全身治疗的多学科综合治疗后,预后得到显著改善。PIPAC 和MOC31PE 等新型治疗方法的出现,也为CRC PM 患者带来一定获益,但长期结果有待大型临床研究进行证实。

