完全肿瘤细胞减灭术加腹腔热灌注化疗治疗胃癌腹膜转移的病例筛选策略*
姬忠贺 刘刚 安松林 张彦斌 李兵 于洋 李鑫宝 闫国军 李雁
胃癌腹膜转移(gastric cancer with peritoneal me⁃tastasis,GCPM)是进展期胃癌临床诊治面临的最大挑战[1]。长期以来,GCPM 被认为是疾病的终末期表现,生存期不足6个月,不主张积极治疗[2]。
基于腹膜转移为腹盆腔区域转移,而非广泛远处转移这一理论认识,发展了以肿瘤细胞减灭术(cy⁃toreductive surgery,CRS)加腹腔热灌注化疗(hyper⁃thermic intraperitoneal chemotherapy,HIPEC)为核心的综合诊疗策略,推动了腹膜肿瘤学科的建立和发展[3-5]。由于胃癌肿瘤生物学特殊性,CRS+HIPEC对GCPM 的疗效尚不明确。部分研究表明,完全CRS(complete CRS,CCRS)可延长GCPM 生存期,但不完全CRS(incomplete CRS,ICRS)疗效有限[6]。然而,目前尚无准确预测肿瘤细胞减灭程度(completeness of cytoreduction,CC)的方法。
本文旨在分析CRS+HIPEC治疗GCPM的临床数据库,构建CC 预测模型,为CRS+HIPEC 治疗GCPM提供病例筛选方法。
1 材料与方法
1.1 临床资料
研究对象为2005年3月~2019年3月,于北京世纪坛医院接受CRS+HIPEC治疗的GCPM患者。纳入患者腹膜为唯一转移部位,不合并其他脏器及远处淋巴结转移。方案与前期发表研究中报道的一致[7]。数据采集主要包括基本临床病理特征、CRS+HIPEC手术相关信息、术后辅助治疗、安全性、生存相关随访信息。研究终点为总生存期(overall survival,OS),定义为CRS+HIPEC日起至GCPM相关死亡或随访截止时间。
1.2 随访
随访记录主要包括生存状态、死亡时间,末次统一电话随访日期为2019年12月31日,随访率为100%,无患者失访。
1.3 相关定义
腹膜癌指数(peritoneal cancer index,PCI)和CC评分:根据Sugarbaker 标准[8],PCI 用于评价腹膜转移程度,将腹部分成13个区,按腹部九分法分为9个区和空肠上段、空肠下段、回肠上段和回肠下段4个区。对每个区域的肿瘤负荷进行评分:0分为无可见癌组织,1分为癌组织直径≤0.5 cm,2分为癌直径0.5~5.0 cm,3分为癌组织直径>5 cm或融合,总分39分(图1A)。CC 评分用于评价CRS 程度,CC0分为细胞减灭术后未见肿瘤组织;CC1分为残余瘤直径<2.5 mm;CC2分为残余瘤直径2.5 mm~2.5 cm;CC3分为表示残余肿瘤直径>2.5 cm,或残留无法切除或姑息切除病灶(图1B)。
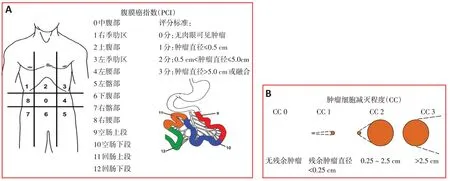
图1 腹膜转移程度与肿瘤细胞减灭程度示意图
腹膜转移时相:包含同时性腹膜转移和异时性腹膜转移。同时性腹膜转移指初诊胃癌时已发现腹膜转移或手术探查时发现腹膜转移,包括腹水脱落细胞学检测到癌细胞或术中发现腹膜种植灶;异时性腹膜转移指胃癌患者接受以根治性手术为主的综合治疗后,随访时发现腹膜转移。
严重不良事件(serious adverse event,SAE):依照国际腹膜癌联盟(peritoneal surface oncology group in⁃ternational,PSOGI)不良事件分级标准[9],共包含9 大分类,48个不良事件,每个不良事件分为Ⅰ~Ⅴ级,Ⅰ级不良事件指诊断成立但无需干预;Ⅱ级不良事件需要药物治疗;Ⅲ级不良事件具有潜在风险但可通过保守治疗治愈;Ⅳ级不良事件需要进入手术室或外科重症监护室进行干预治疗;Ⅴ级不良事件最终导致患者死亡。Ⅲ~Ⅴ级不良事件定义为SAE。
术前肿瘤标志物(tumor marker,TM):仅包括术前癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)和糖类抗原125(carbohydrate antigen 125,CA125)。CEA<5 ng/mL、CA19-9<37 U/mL 且CA125<37 U/mL 定义为TM正常,否则为TM异常。
1.4 统计学方法
采用Microsoft Excel 2013、SPSS 20.0、R 3.5.1(http:www.r-project.org/)软件进行数据分析。计量资料以实测数据表示,分析平均值与标准差或中位值与范围,假设检验采用t检验或非参数检验。计数资料以频数表示,分析中位数和组距,假设检验采用χ2检验、Fisher确切概率法;生存分析采用Kaplan-Meier生存函数和Logrank检验。预测模型构建采用多因素逻辑回归分析,计算回归系数(β)、相对危险度(odd ratio,OR)、95%可信区间(confidential interval,CI)和P值。根据多因素逻辑回归分析结果,使用“rms”R包绘制列线图。采用1 000次自抽样行内部验证,以ROC曲线下面积(area under curve,AUC)和校正曲线评价列线图效能。根据列线图预测结果,设定预测概率为50%,构建病例筛选策略,绘制流程图。P<0.05为差异有统计学意义。
2 结果
2.1 CCRS与ICRS定义
125例GCPM患者共接受CRS+HIPEC治疗131例次。根据CC评分结果,CC0者52例(41.6%)、CC1者22例(17.6%)、CC2者19例(15.2%)、CC3者32例(25.6%)。CC0、CC1、CC2、CC3中位OS分别为30.0(95%CI:16.8~43.3)个月、8.5(95%CI:6.7~10.2)个月、5.6(95%CI:3.0~8.2)个月、6.5(95%CI:5.2~7.7)个月。CC0中位OS优于其余3组,差异有统计学意义(P<0.001);CC1、CC2和CC3之间,中位OS差异无统计学意义(CC1vs.CC2,P=0.509;CC1vs.CC3,P=0.163;CC2vs.CC3,P=0.754)(图2A)。因此,CC0组定义为CCRS,中位OS为30.0(95%CI:16.8~43.3)个月,CC1-3组定义为ICRS,中位OS为7.3(95%CI:5.7~8.8)个月(P<0.001)(图2B)。
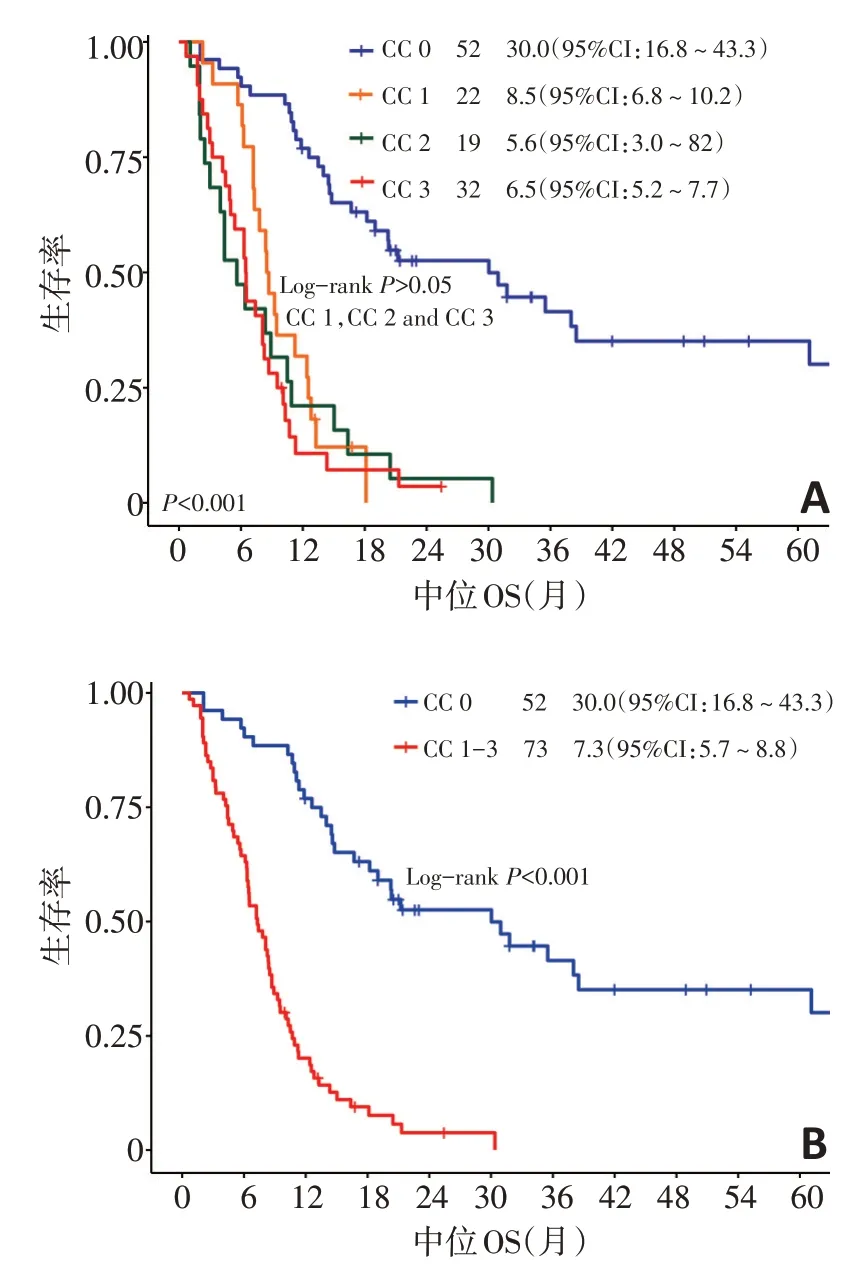
图2 肿瘤细胞减灭程度亚组生存分析
2.2 CCRS组与ICRS组基本临床病理特征比较
按上述分组标准,CCRS组52例(41.6%),ICRS组73例(58.4%),临床病理特征比较见表1。
2.3 ICRS风险预测模型建立与验证
以ICRS为因变量,将年龄、性别、KPS评分、原发瘤部位、分化程度、术前TM、腹膜癌时相、新辅助化疗、PCI 纳入多因素逻辑回归模型,模型优化后结果显示:腹膜癌时相、术前TM 和PCI 为预测ICRS 的独立危险因素(表2)。以3个独立危险因素构建ICRS预测列线图(图3A),各危险因素赋分值为:同时性GCPM 为0分,异时性为17分;术前TM 正常为0分,异常为12分;PCI 得分为2.6×(PCI-1)。总得分大于41分时,ICRS 预测概率大于50%。该列线图AUC 为0.985,内部验证校正AUC 为0.952,校正曲线显示预测值与实际观测值一致性较好(图3B),提示该列线图预测准确度较高。

表1 CCRS与ICRS组基本临床病理特征比较
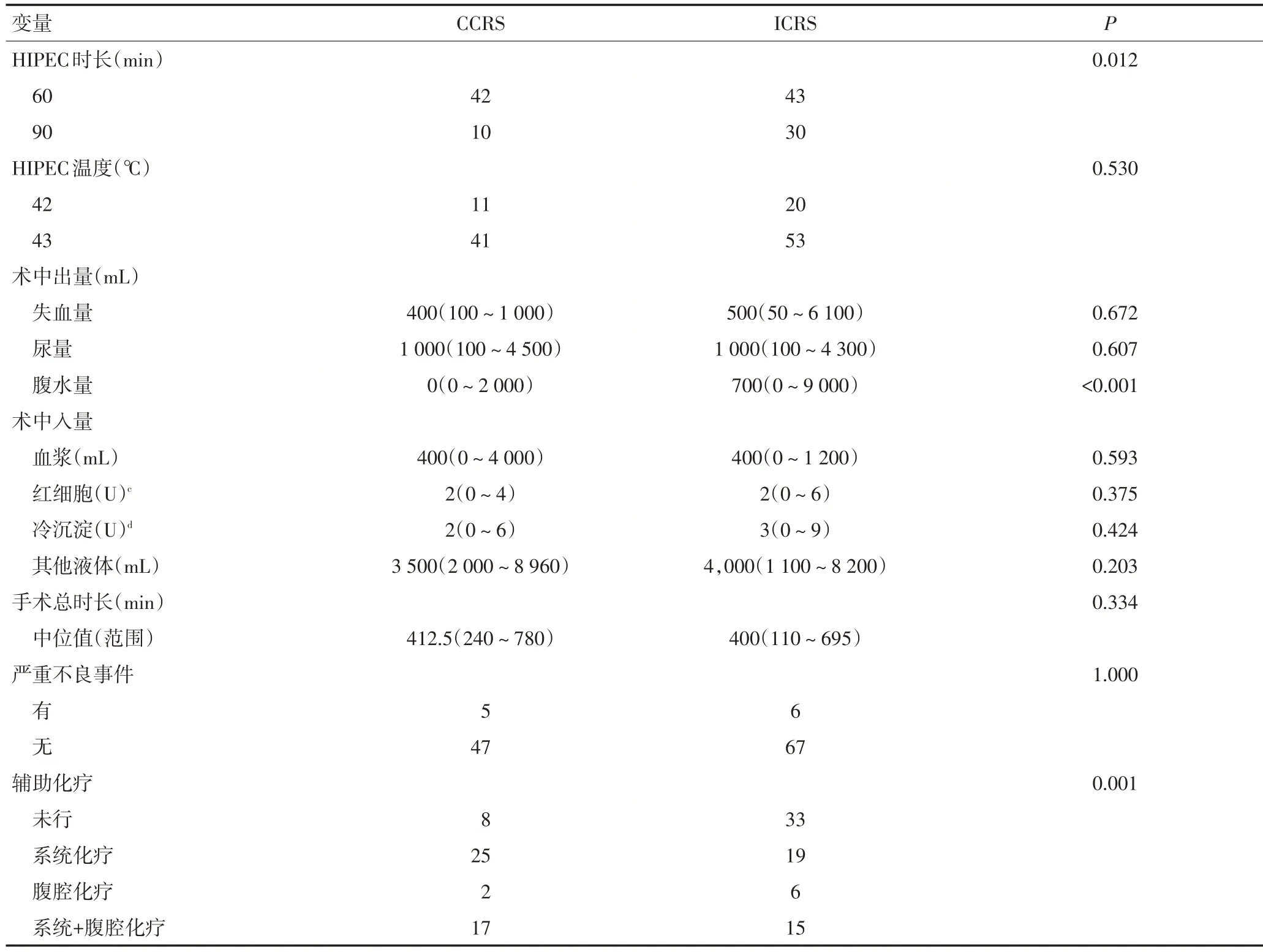
表1 CCRS与ICRS组基本临床病理特征比较(续表1)
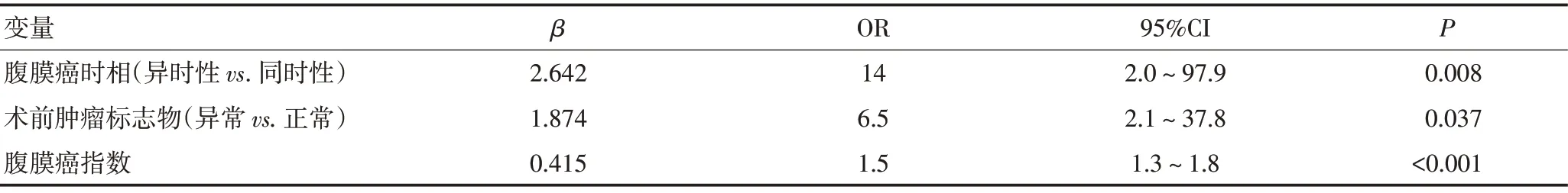
表2 ICRS风险的逻辑回归分析

图3 列线图及校准曲线
2.4 PCI为基础的病例筛选策略
根据列线图结果,GCPM可分为4个亚组:同时性且术前TM正常组(Syn-nTM),同时性且术前TM异常组(Syn-abnTM),异时性且术前TM正常组(Meta-nTM),异时性且术前TM异常组(Meta-abnTM)。设定ICRS风险小于50%,即CCRS可能性≥50%,则4个亚组PCI界值点分别为:≤16、≤12、≤10、≤5(图4)。
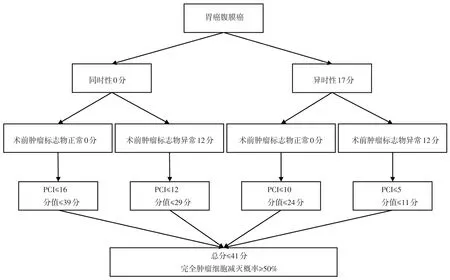
图4 PCI为核心的GCPM筛选策略
3 讨论
本研究分析125例CRS+HIPEC 治疗GCPM 的临床资料,发现CCRS+HIPEC可显著延长GCPM患者生存期,而ICRS+HIPEC 无法为GCPM 患者带来生存获益。基于这一认识,本研究首次采用列线图方法,构建了CCRS 预测模型,并提出了以PCI 为核心的病例筛选策略,即Syn-nTM组,PCI≤16;Syn-abnTM组,PCI≤12;Meta-nTM组,PCI≤10;Meta-abnTM组,PCI≤5 时,CCRS 可能性大于50%,推荐接受CRS+HIPEC治疗。
CC 是CRS+HIPEC 治疗GCPM 预后独立风险因素。研究表明,仅CCRS+HIPEC能为GCPM患者带来显著生存获益[6,10]。Yang等[11]报道了CRS+HIPEC 治疗GCPM唯一的前瞻性随机对照研究,其中CC0-1组中位OS为12.0个月,CC2-3组中位OS为8.2个月,差异有统计学意义。Glehen 等[12]报道了CC0-1组中位OS 为21.3个月,显著优于CC-2组的6.6个月。上述研究中,CC0-1 均被多因素分析认定为影响CRS+HIPEC 治疗GCPM 预后的独立预测因子[11-12]。然而,两项研究均将CC0和CC1合并统计,并未比较CC0与CC1 之间的生存差异。根据Sugarbaker 标准,残余肿瘤直径<2.5 mm 定义为CC1,理论上接近HIPEC 的最大渗透距离[8]。本课题组前期研究结果表明,HIPEC对腹腔游离癌细胞的有效清除率约80%,即在20%的腹膜癌患者中,HIPEC 无法有效清除腹腔肿瘤细胞[13]。因此,理论上在评估CRS+HIPEC疗效时,CC0和CC1 应分别分析。在本研究中,CC0组中位OS 为30.0个月,而CC1组中位OS 为8.5个月,差异有统计学意义;而CC1、CC2、CC3组间中位OS 无显著性差异。本研究结果与2010年法国多中心回顾性研究结果相似,后者分析了159例CRS+HIPEC 治疗GCPM的临床结果,CC0组中位OS为15个月,CC1组为6个月,CC2-3组为4个月[14]。Yonemura 等[10]报道了CRS+HIPEC 治疗419例GCPM 的长期随访结果,CC1组中位OS为12.0个月,所有患者6年内全部死亡,而CC0组中位OS 为20.5个月,5年生存率为14.3%,10年生存率为8.3%。因此,CC1 与CC2、CC3组中位OS无显著性差异,且与单纯化疗预后相似,不建议接受CRS+HIPEC治疗。与此相反,CC0可能性大的GCPM患者,应积极接受CRS+HIPEC治疗。
目前,尚无筛选GCPM 接受CRS+HIPEC 治疗的可行方法。列线图是一种广泛应用于恶性肿瘤预后预测的量化统计工具,它根据Cox 回归、Logistic 回归结果,对各独立预后因子定量赋值,通过计算各预测因子的总得分与终点事件发生概率之间的函数关系,预测患者终点事件发生的概率,结果直观、易懂,说服力强,操作简单,临床应用方便,可有效提高患者依从性[15]。本研究以CC 为结局变量,利用逻辑回归分析结果,首次构建了以腹膜癌时相、术前TM 和PCI预测ICRS风险的列线图。内部验证显示,该列线图准确度、异质性良好。根据列线图依据腹膜癌时相和术前TM指标,可将GCPM分为4个亚组,因此,根据腹膜癌时相和术前TM,可将GCPM分为4个亚组,并以PCI预测其CCRS+HIPEC概率。
PCI 预测腹膜癌预后的最佳界点值仍有争议。Coccolini 等[16]在一项纳入748例腹膜癌患者的荟萃分析中提出,PCI为12是腹膜癌患者预后好坏的最佳界点值。Yonemura 等[10]总结出,新辅助系统/腹腔化疗前后PCI分别≤13 和11,且小肠PCI<2 的患者应行最大限度的切除,以实现CCRS。本研究中,从临床实践出发,将CCRS预测概率设定为>50%,提出SynnTM组,PCI≤16;Syn-abnTM组,PCI≤12;Meta-nTM组,PCI≤10;Meta-abnTM组,PCI≤5,为推荐GCPM 接受CRS+HIPEC治疗的纳入条件。其更大的临床意义在于不满足上述标准的GCPM 患者应排除CRS+HIPEC治疗,以避免不必要的过度手术治疗。
本研究的不足之处在于,纳入病例数偏少,且基于单中心数据库,可能存在选择偏倚。除此之外,本研究仅采用内部验证法,而无独立队列的外部验证,因此本研究结论的普遍性仍需进一步证实。
综上,本研究发现CCRS+HIPEC 可显著延长GCPM 患者生存期,而ICRS+HIPEC 无法为GCPM 患者带来生存获益,并首次提出了以PCI为核心的临床病例筛选策略。

