瞬时无波形比值与血流储备分数的相关性及其影响因素
何立芸 张瑞涛 张永珍 崔鸣 韩江莉 徐昕晔 汪宇鹏 米琳 牛杰 王贵松 高炜 郭丽君
血流储备分数(fractional flow reserve,FFR)是冠状动脉病变功能学评价的“金标准”,国内外指南均推荐以FFR指导无缺血证据的临界病变或多支血管病变患者的血运重建策略[1-2]。但检测FFR必须使用血管扩张剂使微循环阻力充分降低[3],而药物的使用不仅增加了操作的复杂性和创伤性,还存在一定的不良反应和禁忌证,如哮喘、心动过缓、低血压等,因此限制了FFR的应用。
瞬时无波形比值(instantaneous wave-free ratio,iFR)是由FFR衍生的无需血管扩张剂的病变功能学检测指标,是心动周期特定时段,即心脏无波形期病变远端的冠状动脉内压力与冠状动脉口部压力的比值,此时段心肌微循环阻力类似于应用血管扩张剂诱发的充血状态下的阻力[4]。iFR重复性高,与FFR显著相关[4-6]。iFR在临界病变、弥漫病变、串联病变、急性心肌梗死急性期非梗死相关动脉的评价等方面具有独特的优势,以iFR指导的介入治疗效果非劣于FFR[7]。因此国外指南也推荐以iFR指导冠心病患者的介入策略,当iFR≤0.89时认为病变具有功能学意义而推荐进行血运重建治疗[1,8]。但目前iFR在国内尚未广泛开展,少有临床研究发表,其中iFR与FFR的相关性及诊断一致性的影响因素研究少见文献报道。
1 对象与方法
1. 1 研究对象
回顾性收集北京大学第三医院2015年5月至2019年4月因冠心病同时接受iFR和FFR检测的患者。入选标准:(1)冠状动脉造影(coronary angiography,CAG)直径狭窄30%~70%的临界病变或直径狭窄<90%无心肌缺血客观证据的病变;(2)经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后需复查FFR的病变。排除标准:(1)左或右冠状动脉开口病变;(2)冠状动脉旁路移植;(3)急性心肌梗死<7 d;(4)心力衰竭;(5)低血压;(6)心动过缓;(7)哮喘;(8)严重肾功能不全。根据iFR和FFR结果,计算出iFR预测FFR≤0.80的最佳临界值,以指南推荐的判断病变是否具有功能学意义的界值iFR 0.89和FFR 0.80将患者分为一致组(FFR≤0.80且iFR≤0.89,或FFR>0.80且iFR>0.89)和不一致组(FFR>0.80且iFR≤0.89,或FFR≤0.80且iFR>0.89),比较两组间临床因素的差异;并进一步以FFR 0.80和iFR 0.89为界值将测量结果分为四组,比较四组间病变解剖学因素的差异。
1. 2 研究方法
1. 2. 1 资料收集 患者均接受选择性CAG,由不知病变功能学检测结果的技师对图像进行冠状动脉定量分析(quantitative coronary analysis,QCA),记录患者的病变部位、参考血管直径(reference diameter,RD)、直径狭窄(diameter stenosis,DS)、面积狭窄(area stenosis,AS)、最小管腔直径(minimal lumen diameter,MLD)、最小管腔面积(minimal lumen area,MLA)和病变长度(lesion length,LL)等病变解剖学指标。同时记录患者的性别、年龄、身高、体重、合并用药、既往病史及临床诊断等一般资料,并记录血清肌酐(creatinine,Cr)、尿酸(uric acid,UA)、血脂、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、N末端B型脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)等实验室指标,同时收集患者室间隔厚度、左心室舒张末期内径、左心室射血分数、左心室质量指数等超声心动图指标。
1. 2. 2 iFR与FFR测量 iFR与FFR的测量使用Volcano S5冠状动脉腔内生理记录仪及PrimeWire压力导丝。在完成体外零点校正后将导丝送入冠状动脉开口,将压力感受器置于6 F导引导管口外1~2 mm处完成体内压力校正。然后送导丝将压力感受器置于病变远端至少3 cm处。向冠状动脉内推注硝酸甘油200 μg,待压力曲线平稳后进行测量。以冠状动脉内压力曲线上的重拨切迹为舒张期开始,以专用软件测量无波形间期(舒张期开始后的25%至舒张期结束前5 ms)内的远端冠状动脉平均压(Pd wave-free period)和冠状动脉口部平均压(Pa wave-free period)。iFR= Pd wave-free period/Pa wave-free period。随后经肘正中静脉输注腺苷三磷酸140 μg/(kg · min)诱发微循环最大充血,读取压差最大时的远端冠状动脉平均压(Pd)和冠状动脉口部平均压(Pa),FFR=Pd/Pa。测量完成后回撤导丝再次使压力感受器位于冠状动脉口部,观察Pd和Pa两条曲线是否弥合,若偏差>3 mmHg(1 mmHg=0.133 kPa),则重复上述测量。记录患者的iFR和FFR结果。
1. 3 统计学分析
所有数据采用SPSS 21.0统计软件进行处理。以Kolmogorov-Smirnov法进行正态性检验。正态分布的计量资料用()表示,组间比较采用独立样本t检验或F检验。非正态分布的计量资料用M(Q1,Q3)表示,组间比较采用Mann-Whitney U秩和检验,相关性分析应用Spearman相关性检验。计数资料用频数和百分比表示,组间比较采用χ2检验。采用受试者工作特征曲线(receiver operating characteristic,ROC)分析iFR与FFR的一致性。以二元logistic回归进行多因素分析。以P<0.05 为差异有统计学意义。
2 结果
2. 1 患者基本情况
共对60例患者的80支冠状动脉进行了FFR和iFR测量(部分冠状动脉在PCI术前和术后均进行了测量),从而共获得了109组FFR和iFR数据,FFR和iFR中位数分别为0.80(0.74,0.85)和0.90(0.87,0.94)。基线靶血管病变DS为(44.2±10.6)%;34组(31.2%)数据来自于PCI术后,PCI术后DS为(22.7±9.6)%。
2. 2 iFR与FFR的相关性及诊断一致性
相关分析显示,iFR与FFR呈明显线性相关(r=0.780,P<0.001,图1)。Bland-Altman分析显示, iFR与FFR差值的平均值为(0.107±0.064),95%一致性界限为-0.018~0.232(图2)。
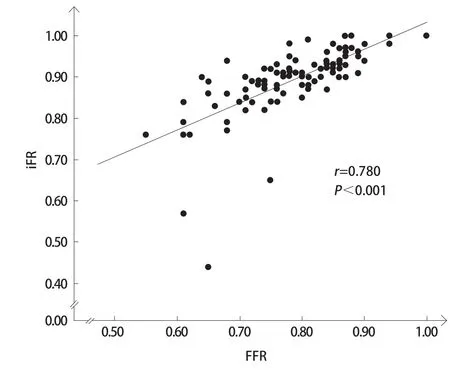
图 1 109组数据iFR与FFR的相关性
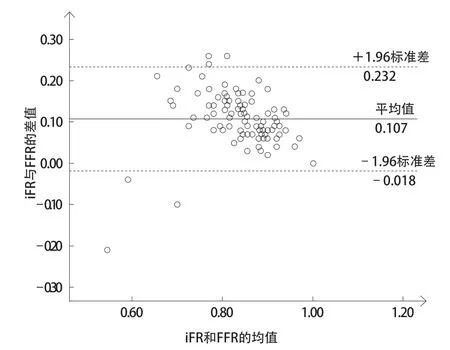
图 2 109组数据iFR与FFR的Bland-Altman分析
以FFR≤0.80为病变诱发心肌缺血的界值,iFR的ROC曲线下面积(area under curve,AUC)为0.870(95%CI 0.805~0.935,P<0.001,图3)。本研究患者中预测FFR≤0.80的最佳临界值为iFR≤0.90,其敏感度为77.6%,特异度为76.7%,阳性预测值(positive predictive value,PPV)为87.2%,阴性预测值为(negative predictive value,NPV)为69.4%,诊断一致率为77.1%。以PPV和NPV分别超过90%的界值区间作为iFR“灰区”,则iFR“灰区”为0.88~0.94,61次测量结果位于“灰区”。如仅对iFR为“灰区”的病变进行FFR检测,其余以iFR作为判断标准,则该杂交策略可使二者诊断一致率达到96.3%,使44.0%的检测免于使用腺苷。
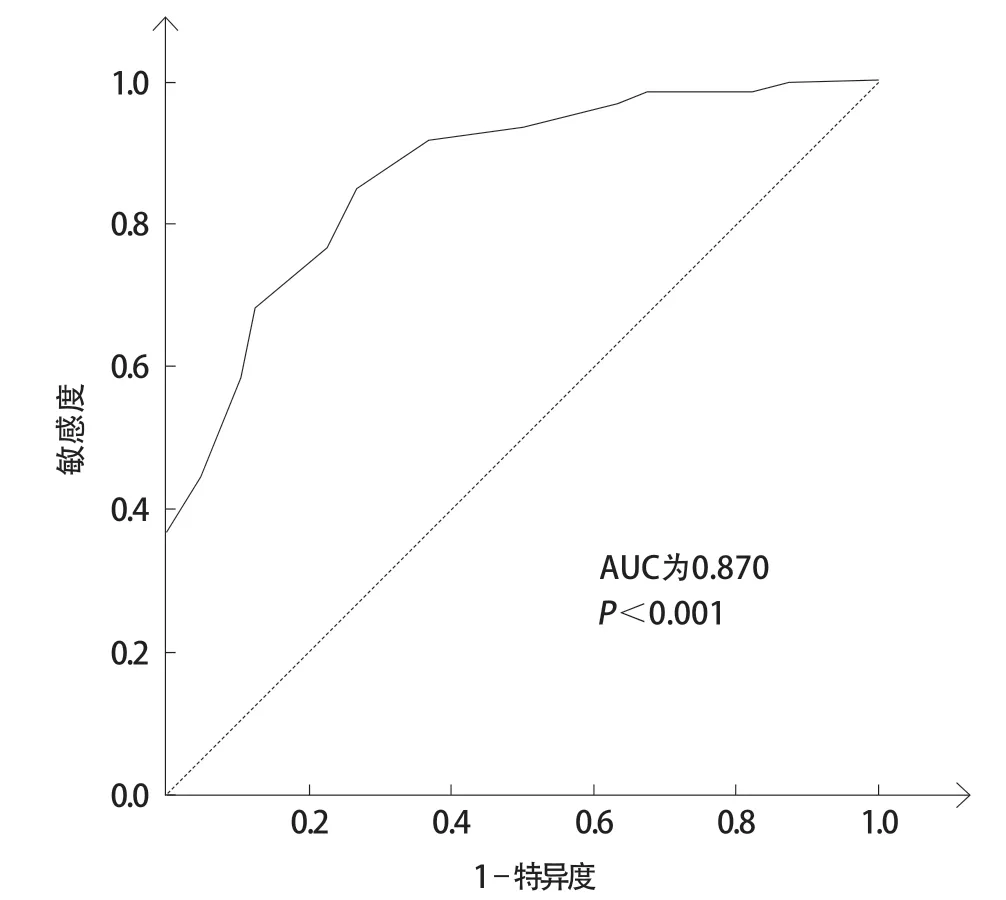
图 3 109组数据iFR预测FFR≤0.80的ROC曲线分析
2. 3 iFR与FFR诊断一致性的影响因素
为探索影响iFR与FFR一致性的临床因素,仅选取每位患者第一次检测的iFR和FFR数据,以FFR(≤0.80)和iFR(≤0.89)判断心肌缺血的结果是否一致将60例患者分为一致组(46例)和不一致组(14例)。不一致组患者的体重指数(body mass index,BMI)(P=0.002)和肌酐清除率(P=0.029)较高,而两组患者在年龄、性别、吸烟史、诊断、既往病史、合并用药、其他实验室检查、超声心动图、病变解剖学指标等方面比较,差异均无统计学意义(均P>0.05,表1~2)。二元logistic回归分析显示BMI是iFR与FFR诊断不一致的独立影响因素(OR 1.463,95%CI 1.093~1.957,P=0.010)。

表1 iFR 与FFR 一致组与不一致组患者资料比较
为了进一步探索影响二者一致性的病变解剖学因素,以 FFR是否≤0.80和iFR是否≤0.89将109组测量数据分为四组。四组数据间的RD、MLD和MLA比较差异均有统计学意义(均P<0.01),与FFR≤0.80且iFR≤0.89组相比, FFR≤0.80且iFR>0.89组的RD、MLD和MLA较大(均P<0.05,表3)。
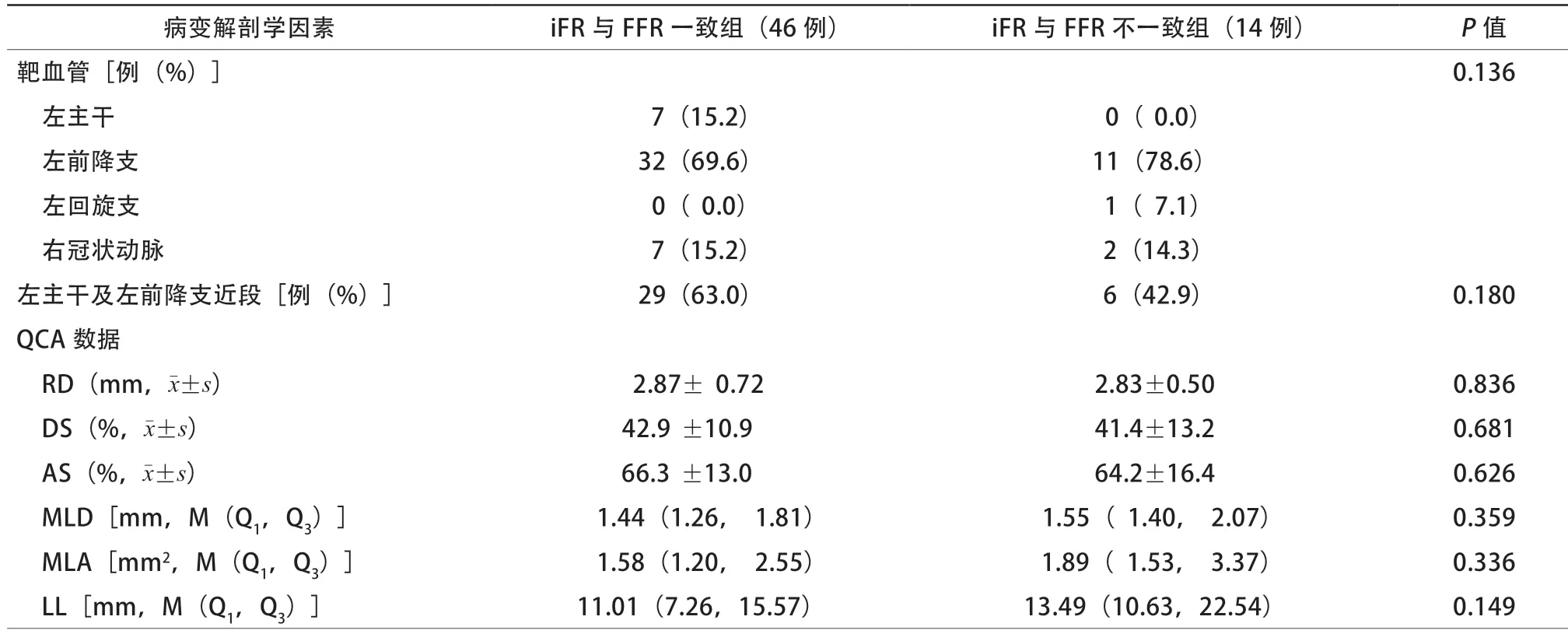
表2 iFR 与FFR 一致组与不一致组患者的病变解剖学因素比较
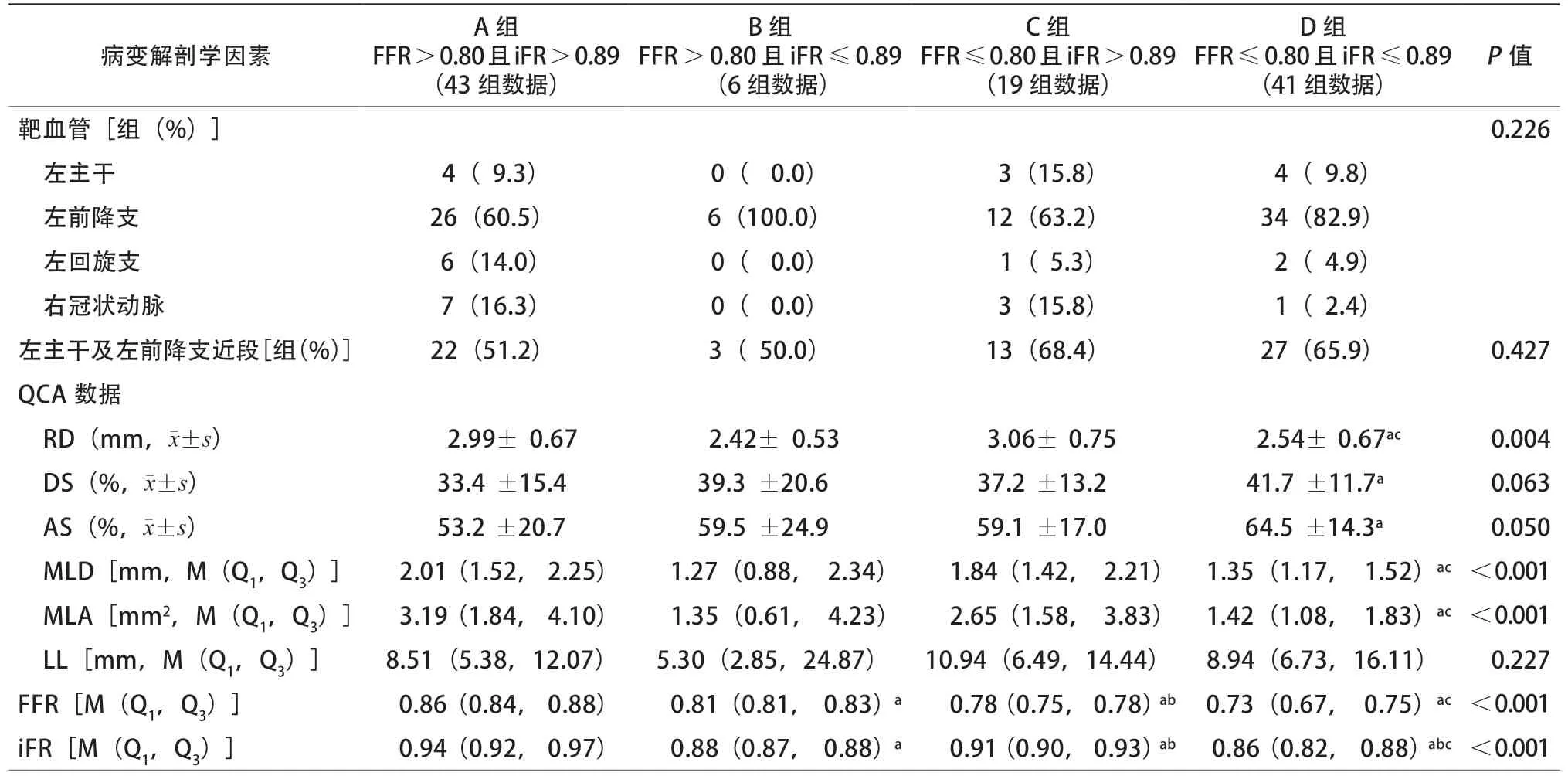
表3 影响iFR 与FFR 一致性的病变解剖学因素比较
3 讨论
由于FFR指导的功能性血运重建既能改善患者预后,又具有良好的卫生经济学效益,因此日益受到广泛重视[9]。但FFR存在一定禁忌证,并增加操作复杂性和创伤性;而iFR在测量时不需使用微循环扩张剂,不但简化了功能学评价流程,而且使更多患者获得了功能学评价的可能,因此具有巨大的发展潜力。
iFR与FFR具有良好的一致性,以往研究中二者的相关系数为0.75~0.812[5,10],与FFR≤0.80对应的iFR临界值为0.89~0.90,AUC为0.86~0.90,诊断一致率为80.0%~82.5%[6,11-12]。本研究中iFR与FFR的相关系数为0.780,预测FFR≤0.80的最佳临界值为iFR≤0.90,AUC为0.870,诊断一致率为77.1%,与以往研究结果相似。纳入了1768例患者的RESOLVE研究[13]中的Bland-Altman分析显示,iFR数值平均较FFR高0.10(95%一致性界限为-0.06~0.26),而该结果也与本研究结果相近。对比iFR与FFR指导治疗策略选择的DEFINEFLAIR[14]和IFR-Swedeheart研究[15]均显示两组间的1年主要不良心血管事件相似,而iFR组的操作相关不良反应和手术时间显著低于FFR组。以往研究和本研究结果都证实iFR与FFR具有较高的相关性,可用于指导治疗策略的选择,具有广阔的临床应用前景。
为减少血管扩张剂的使用,有研究探讨了iFRFFR杂交策略,发现对iFR≤0.85者行PCI、iFR≥0.94者推迟行PCI,仅对iFR在0.86~0.93者检测FFR,该策略可减少57%腺苷使用率,与仅检测FFR的诊断一致性达95%[16]。本研究以类似方法确立iFR的“灰区”为0.88~0.94,发现杂交策略时二者诊断一致率升至96.3%,使44.0%的病变免于使用腺苷,由此进一步证明iFR-FFR杂交策略可有效简化功能学评价流程。
尽管iFR与FFR的相关性较高,仍有20%左右的患者在应用iFR和FFR指导治疗策略时会得到不一致的答案[13]。有研究发现,在FFR>0.80组中,女性、糖尿病、RD小、DS重与iFR≤0.89有关;而在FFR≤0.80组中,男性、无糖尿病、DS轻与iFR>0.89有关[17]。另有研究发现,在iFR>0.89组中,左主干或左前降支近段病变、狭窄程度较重、年轻和心率慢是FFR≤0.80的预测因素;在iFR≤0.89组中,未使用β阻滞药、年龄、狭窄程度较轻则是FFR>0.80的预测因素,而性别、BMI和糖尿病不影响二者一致性[18]。本研究初步探索了影响二者一致性的临床及病变解剖因素,结果发现在临床因素中,BMI是二者不一致的独立影响因素,年龄、性别、糖尿病等临床因素不影响二者一致率;就病变解剖因素而言,在FFR≤0.80组(C组和D组)中,与iFR≤0.89者相比,iFR>0.89者的RD、MLD和MLA较大(均P<0.05)。
跨越狭窄病变的压力梯度是由跨病变的冠状动脉血流量以及压力的黏性损耗和分离损耗之和共同决定的,因此由压力衍生参数的根本局限性即压力梯度不一定能准确反映心肌缺血,并且可能受到人口学、合并症、病变特征和微血管功能等多种因素的影响[19-20]。作为压力衍生的参数,FFR和iFR之间的不一致可能源于患者临床特征与心外膜冠状动脉狭窄程度或几何结构之间的复杂关系,不同的临床和病变解剖特征可能代表了调节静息和充血冠状动脉血流的不同冠状生理行为。研究显示,FFR和iFR与血管内超声和光学频域成像技术检测的MLA均有良好的相关性[21]。然而,就最大充血时冠状动脉血流速度和冠状动脉血流储备而言,FFR≤0.80/iFR>0.89组与FFR>0.80/iFR>0.89组及冠状动脉无阻塞组相似,而FFR>0.80/iFR≤0.89组与FFR≤0.80/iFR≤0.89组相似[22],提示iFR与冠状动脉血流速度的相关性更好。应用13NH3正电子发射断层显像(13NH3-PET)技术的研究发现,尽管静息心肌血流(myocardial blood flow,MBF)相似,但与FFR≤0.80/iFR≤0.89患者相比,FFR≤0.80/iFR>0.89患者静息状态下的微血管阻力更高,而充血状态下的MBF更大、CRF更高,且存在PET定义的心肌缺血的比例更低[23],提示微循环状态是影响FFR与iFR是否一致的重要因素。FFR检测的前提是微循环最大扩张,存在微循环障碍的患者难以达到微循环最大扩张,从而可能高估FFR[24];而iFR不受诱发微循环扩张的影响,因此高龄[25]、糖尿病、BMI高[26]等微循环障碍者可能更易出现iFR与FFR的不一致。本研究也发现BMI高是二者不一致的独立影响因素,但由于样本量较小,未能证明其他影响微循环的临床因素对二者一致性的影响。
综上所述,本研究提示iFR与FFR具有良好的相关性,病变局部解剖特点可能对二者的诊断一致性产生一定的影响。但由于患者数较少,本研究在对影响二者诊断一致性的临床因素进行比较时未进一步按iFR和FFR的结果分为四组进行比较,因此可能忽略了部分潜在的临床影响因素;本研究仅为单中心回顾性研究,样本量小,影响二者一致性的临床及病变解剖学因素仅为探索性分析,结论尚需大规模研究进一步验证。

