不同RNA提取及反转录方法对环状RNA聚合酶链反应的影响
王建星,聂子元,董金辉,贾新菊
(1.河北医科大学第二医院耳鼻喉一科,河北 石家庄 050000;2.河北医科大学第二医院血液内科,河北省血液病重点实验室,河北 石家庄 050000;3.河北医科大学第一医院内分泌科,河北 石家庄 050000)
环状RNA(circular RNA,circRNA)作为重要的非编码RNA,在真核生物多种生物学过程中发挥关键作用,参与包括肿瘤及心血管疾病在内的多种疾病的发生发展[1]。由于环状RNA的闭合环状结构大大提高了其稳定性,且其存在组织及疾病特异性,越来越多研究将环状RNA作为疾病的潜在生物学标志物[2-3]。前期研究发现circFLNA在喉鳞状细胞癌中高表达并且参与了癌细胞的迁移[4]。尽管环状RNA普通存在真核生物中,但相对于线性RNA,如mRNA等,其在胞内的丰度较低。此外,目前鉴定环状RNA的方法主要是聚合酶链式反应(polymerase chain reaction,PCR)、Northernblot、原位杂交等,其中前两种方法就必须基于完整且高质量的总RNA[5]。且由于环状RNA在细胞内含量相对较低。因此有效提取高质量的RNA成为研究环状RNA先决条件。本研究通过不同总RNA提取方法及不同反转录引物得到的cDNA进行环状RNA扩增,进一步寻找可靠、省时、高效的环状RNA扩增手段,为基础研究及临床环状RNA测定提供帮助。
1 材料与方法
1.1细胞培养 人喉鳞状细胞癌细胞株Hep2细胞由河北医科大学第二医院耳鼻喉一科保存。Hep2细胞培养在含10%胎牛血清的RIPM1640培养液中培养,放于温度为37 ℃,5% CO2培养箱内培养。每1~2 d观察细胞形态及密度,进行传代并放回培养箱继续培养。
1.2miRNeasy Mini试剂盒提取总RNA 根据miRNesay Mini Kits(Qiagen)操作手册进行。具体如下,向1×107个Hep2细胞中加入1 mL QIAzol裂解液,室温放置5 min,加入200 μL氯仿剧烈震荡15 s,室温静置2~3 min,4 ℃ 12 000 g离心15 min,将上层清液转移到一个新的EP管中,加入1.5倍体积的无水乙醇,混匀。吸取700 μL样本转移到miRNeasy Mini 柱内,室温8 000 g离心15 s,弃掉收集管中的液体。向离心柱内加入700 μL的Buffer RWT,8 000 g离心,15 s,弃滤液。吸取500 μL的Buffer RPE于离心柱内,8 000 g离心15 s,弃滤液。吸取500 μL的Buffer RPE于离心柱内,8 000 g离心2 min,弃滤液。将miReasy Mini柱转移到新的1.5 mL EP管内。于柱内加入40 μL DEPC水,室温12 000 g离心1 min,得到的RNA溶液用于进一步实验。每组实验重复3次。
1.3Trizol抽提法提取总RNA方法 向1×107个Hep2细胞中加入1 mL Trizol抽提裂解液,充分混匀,室温静置5 min,加入200 μL氯仿剧烈震荡15 s,静置2 min;4 ℃ 12 000 g离心15 min,取上清500 μL,并在上清中加入500 μL异丙醇,将管中液体轻轻混匀,室温静置10 min。4 ℃ 12 000 g离心10 min,弃上清。加入1 mL 75%的DEPC-乙醇,洗涤沉淀。4 ℃ 8 000 g离心5 min,弃上清,可见白色RNA沉淀,滤纸吸干沉淀物,40 μL DEPC水溶解RNA沉淀,RNA溶液用于进一步实验。每组实验重复3次。
1.4RNA浓度及质量检测 使用Nanodrop 2000紫外分光光度计测定总RNA的浓度、RNA纯度由OD260/280,OD260/230进行判读,具体如下:Nanodrop 2000用2 μL DEPC水调准基线,取2 μL不同方法提取的总RNA溶液,读取RNA浓度,OD260/280及260/230比值,比值在1.8~2.0范围内证明RNA纯度高,达到下一步实验的要求。
1.5反转录反应和过程 使用5 μg不同方法提取的Hep2细胞的总RNA进行反转录,依据M-MLV First Strand Kit操作手册进行反转录合成cDNA。反应体系为20 μL。具体如下:0.2 mL微量离心管中加入总RNA 2 μg,通用引物1 μL或随机引物1 μL,10 mmol/L dNTP 1 μL,后用DEPC水将体系补足至12 μL;65 ℃变性5 min,迅速置于冰上冷却;短暂离心后分别加入4 μL的5×第一链合成缓冲液、2 μL 0.1 mmol/L DTT和1 μL RNaseOUT核酸酶抑制剂,离心混匀,置于PCR反应仪中37 ℃孵育2 min,随后常温下加入1 μL M-MLV逆转录酶(200 U/μL),离心混匀。重新放回PCR仪中,预设程序37 ℃反应50 min,接着70 ℃处理15 min以灭活逆转录酶,最后4 ℃冷却。制备的cDNA -20 ℃保存备用。
1.6实时定量PCR(real-time quantitative PCR) Realtime PCR反应在QuantStudioTM7 Flex Realtime,PCR System(Applied Biosystems,美国)上进行,反应体系为20 μL。cDNA按照1∶10稀释,反应体系如下:SYBR Green qPCR预混液10 μL,模板DNA 2 μL,上下游因为各1 μL,无RNA酶水7 μL,离心混匀后,按照如下反应条件,进行实时定量PCR反应:上游引物,下游引物,无RNA酶水7μL,离心混匀后,进行PCR反应。相对定量法采用比较Ct法,以线性GAPDH作为内参,采用△Ct(Ct目的-Ct内参)法进行相对定量分析,用2-△Ct计算所得值作为目的RNA的相对表达量。引物序列如下:circFLNA-F:CCAGCTGAGGCTCTACC-GTGCC; circFLNA-R:GAGGCGTCAGCATCCC-CAACAG;circHIPK3-F:TGGAGACTGGGGGA-AGATGA;circHIPK3-R:CACACTAACTGGCT-GAGGGG。
1.7琼脂糖凝胶电泳 配置1.5%琼脂糖凝胶,取上述PCR产物5 μL,120 V 30 min进行电泳,用凝胶成像仪成像取图,检测PCR扩增产物。
1.8统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较采用独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1miRNeasy Mini试剂盒法与Trizol抽提法提取细胞总RNA的浓度及总量比较 用miReasy Mini试剂盒法与Trizol抽提法分别提取1×107Hep2细胞中的总RNA,Nanodrop 2000紫外分光光度计测定总RNA浓度和计算RNA总质量。Trizol抽提法提取的总RNA的浓度为总质量均高于miRNeasy Mini试剂盒法,差异有统计学意义(P<0.01),见表1。
2.2miRNeasy Mini试剂盒法与Trizol抽提法提取细胞总RNA的纯度比较 用miReasy Mini试剂盒法与Trizol抽提法提取1×107个Hep2细胞总RNA,Nanodrop 2000紫外分光光度计测定总RNA的A260/280及A260/A230。两种提取试剂盒法提取的总RNA的A260/A280,A260/A230比值均在1.8~2.0,表明所得的RNA纯度比较高,而miReasy Mini方法提取的总RNA的A260/A280,A260/A230更接近2.0,说明RNA纯度更高,所含杂质含量较少。两种方法提取的总RNA的纯度差异有统计学意义(P<0.05),见表2。

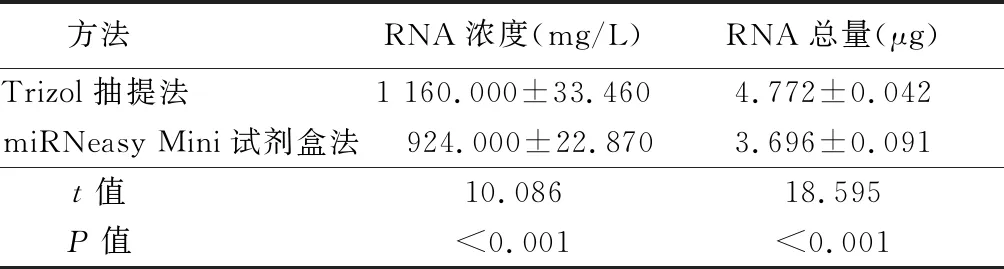
方法 RNA浓度(mg/L)RNA总量(μg)Trizol抽提法 1 160.000±33.4604.772±0.042miRNeasy Mini试剂盒法 924.000±22.8703.696±0.091t值 10.08618.595P值 <0.001<0.001


方法 A260/A280A260/A230Trizol抽提法 1.893±0.0091.807±0.031miRNeasy Mini试剂盒法2.043±0.0262.010±0.006t值 6.3129.098P值 <0.001<0.001
2.3随机引物及通用引物进行反转录对对环状RNA扩增的影响 miReasy Mini试剂盒法与Trizol抽提法提取总RNA,2 μg RNA分别利用随机引物及通用引物进行反转录,普通聚合酶链反应扩增circHIPK3及circFLNA,琼脂糖凝胶电泳检测PCR产物,利用随机引物进行反转录后,可顺利扩增出circHIPK3及cirFLNA,而通用引物反转录所得到的cDNA进行PCR,circHIPK3及circFLNA均不能被扩增,见图1。
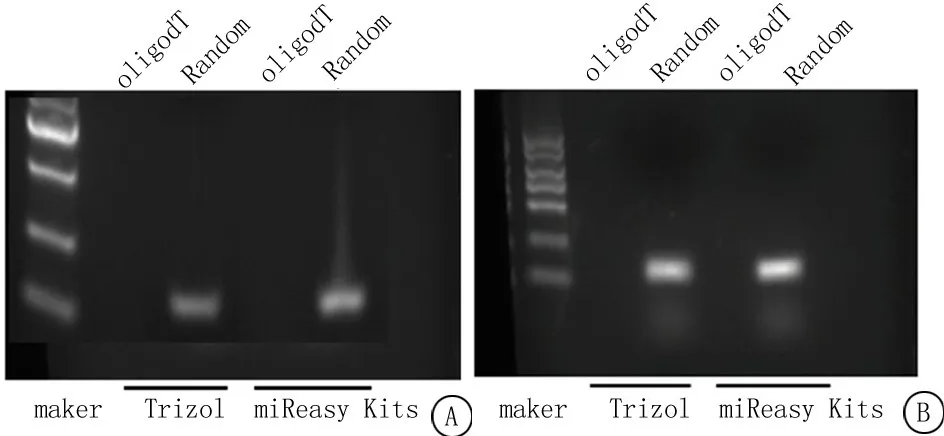
图1 随机引物及通用引物进行反转录对对环状RNA扩增的影响
A.琼脂糖凝胶电泳检测circHIPK3的表达;B.琼脂糖凝胶电泳检测circFLNA的表达
Figure 1 Effects of Random primers and oligodT primers on the amplification of circular RNA
2.4不同方法提取总RNA对环状RNA实时定量PCR相对表达量的影响 利用miReasy Mini试剂盒法与Trizol抽提法提取总RNA,2 μg RNA进行反转录,反转录引物为随机引物,实时定量聚合酶链反应检测circHIPK3及circFLNA在Hep2细胞中的相对表达量,以线性GAPDH作为内参,miReasy Mini试剂盒法提取总RNA后circHIPK3相对GAPDH的CT值为 -(9.717±0.166),circFLNA相对GAPDH的CT值为 -(11.69±0.213),Trizol抽提法提取总RNA circHIPK3相对GAPDH的CT值为 -(11.67 0.079),circFLNA相对GAPDH的CT值为 -(12.5±0.249),miReasy Mini试剂盒提取方法总RNA进行PCR所得的circHIPK3及circFLNA相对表达明显高于Trizol抽提法,差异有统计学意义(P<0.05),见表3。


方法 circHIPK3circFLNATrizol抽提法 -(11.670±0.079)-(12.500±0.249)miRNeasy Mini试剂盒法-(9.717±0.166)-(11.690±0.213)t值 23.7168.798P值 <0.001<0.001
3 讨 论
目前很多的研究指出,生命的本质也可能由RNA所决定。除了经典的转运RNA(tRNA),信使RNA(mRNA)和核糖体RNA(rRNA)之外,越来越多类型的RNA被发现,包括微小RNA(miRNAs),长链非编码RNA(lncRNAs),小干扰RNA(siRNAs)和其他非编码的RNA,而RNA多样的生物学功能也逐渐被揭示[6]。环状RNA是一类广泛存在于真核细胞内具有多种生物学功能的内源性非编码RNA[7]。在20世纪70年代,环状RNA首先被当做类病毒的遗传物质在植物中被发现,随后的研究表明环状RNA可以存在于多种生物体内,包括真核生物、酵母菌、病毒、四膜虫等。但当时观点认为,环状RNA可能是由于前体mRNA错误剪切形成的,含量较少,作为RNA垃圾,可能并没有实际意义,因此未能引起足够重视[8-9]。
随着聚合酶链反应及RNA测序技术的迅速发展,越来越多环状RNA被鉴定并赋予新的意义。Barrett等[10]首先证实了前体mRNA的环化特征,指出环状RNA是由mRNA前体经反向剪接产生的环状转录本,并确定其在正常细胞及肿瘤细胞中发挥相应作用。目前研究证实,环状RNA不同于其他非编码RNA,主要来源于蛋白质编码的外显子,通过剪接体作用减去前体mRNA中的内含子,同时下游的5′剪接位点与上游的3′剪接位点含有互补结构,通过共价键连接形成外显子环状RNA[11]。此外,也有研究证实,内含子,非编码区及不连续的外显子也可能通过其他形式形成环状RNA[12]。另外,包括RNA结合蛋白驱动及套索驱动模式也被证实在环状RNA环化中起了一定作用[13]。由于环状RNA不含有5′端的帽子结构及3′端的PolyA尾,不容易被RNA酶结合,因此其表达稳定不易破坏。研究证实,环状RNA的半衰期超过48 h,较其线性的mRNA明显增长。由于环状RNA的特性及越来越多的功能被发现,环状RNA也称为多种疾病的分子标志。通过高通量测序的方法,孔德沛等[3]在喉鳞状细胞癌中发现302种环状RNA上调,有396中环状RNA下调,提示着环状RNA可能参与了喉鳞状细胞癌的发生发展过程。
此外,环状RNA顾名思义是一个闭合的环状结构,与线性的mRNA不同,环状RNA不存在5′端帽子和3′端的PolyA尾,因此RNA反转录为cDNA过程中的引物选择过程中不能使用与PolyA互补结合通用引物,而是使随机引物或特定基因的特异性引物。本研究结果显示,当利用通用作为反转录引物时,不能扩增出目的环状RNA,原因是由于环状RNA没有3′ PolyA尾,通用引物不能识别环状RNA,而将随机引物作为反转录引物后能顺利扩增出所需要的环状RNA。
虽然高通量测序是目前批量鉴定环状RNA的理想方法,但该方法成本较高,周期长。而且测序结果仍需要通过PCR进一步验证。尽管环状RNA普遍存在于真核生物中,但其在胞内的丰度仍比较低。此外,目前最常用的鉴定方法仍然是PCR、Northern blot,这2种方法都必须基于完整RNA[14]。因此,有效提取高质量的RNA成为研究环状RNA先决条件。本研究通过对比Trizol抽提法和miReasy Mini试剂盒法2种总RNA,发现用传统Trizol抽提提取的RNA浓度要高于miReasy Mini试剂盒提取的。原因之一是,Trizol抽提方法是利用核酸沉淀原理,基本上能将所有的RNA沉淀下来,因此其RNA浓度较高,但也因为该方法,除了RNA之外,还有部分其杂质被沉淀下来,如蛋白质或DNA等;而试剂盒是利用膜与RNA的结合方式进行分离,该膜与RNA结合受到量的限制,当RNA过量时,膜的结合能力有限达到饱和,所以该方法分离到的RNA浓度相对Trizol抽提方法的要低[15]。同样,利用膜分离的方法可以排除其他杂质的影响,在提取RNA过程中,不能与膜结合的物质,如蛋白质和DNA就被洗掉,因为miRNeasy Mini试剂盒提取到的RNA纯度较高。虽然环状RNA较线性RNA稳定,它不容易受RNA外切酶的消化,但仍然属于RNA,易受无处不在的RNA酶消化而降解。因此,所提取出来的RNA纯度对环状RNA的稳定性影响较大。Trizol抽提法提取的RNA浓度虽高,但杂质较多,总RNA降解速度快,而miRNeasy Mini试剂盒提取的RNA纯度高,降解较慢。此外,绝大部分环状RNA均为长链RNA,容易被膜结合方式分离,所以用相同量的总RNA进行反转录时,经试剂盒提取的RNA,其中环状RNA的比例相对高,间接地提高了环状RNA的比例,因此,在低丰富的环状RNA中,miRNeasy Mini试剂盒提取到的RNA更容易被鉴定出来。
但是本研究仅局限于喉鳞状细胞癌Hep2细胞株对不同RNA提取方法及不同反转录引物进行反转录PCR效果差异分析,可能存在一定局限性,应该在更多不同类型细胞、不同细胞和不同组织样本进行更进一步研究以寻找出环状RNA扩增最为有效、经济的方法。
综上所述,应用miRNeasy Mini试剂盒法提取总RNA纯度更高,更有利于环状RNA的扩增,利用随机引物进行反转录而非通用引物,可顺利扩增出环状RNA,为环状RNA的进一步研究提供了省时、高效、稳定的扩增方案。

