白细胞介素10及其受体基因突变所致极早期炎性肠病的临床及影像表现
张天月, 龚英, 季敏, 杨宾, 乔中伟
随着胃肠镜技术的普及和对于炎症性肠病(inflammatory bowel disease,IBD)认识水平的提高,研究显示近几十年儿童IBD的发病率逐年上升[1]。极早发炎性肠病(very early onset IBD,VEO-IBD)指小于6岁发病的炎症性肠病[2],约占儿童IBD的4%~15%[3]。IBD病因及发病机制尚未完全明确,目前认为是由环境、遗传等多种因素导致肠道黏膜免疫系统异常反应的结果[4];相比于成人和儿童IBD患者,遗传因素在VEO-IBD的起病中占主导因素[5]。目前国内尚无对VEO-IBD影像表现的相关文献报道,本文回顾性分析了本院收治的19例确诊由白细胞介素(Interleukin,IL)-10基因及IL-10R基因突变导致的VEO-IBD患儿的临床及影像学表现,旨在进一步提高对本病的认识。
材料与方法
1.一般资料
搜集2012年1月-2017年12月经本院临床确诊的19例因IL-10基因及IL-10R基因突变导致的VEO-IBD患儿的临床及影像学资料,其中男9例,女10例。18例患者进行了腹部X线检查,所有病例进行了腹部CT增强检查。10例患者进行了结肠镜检查。
2.检查及评估方法
X线平片检查Kodak DR 7500机,常规摄腹部正、侧位片。CT检查使用GE Light Speed 64层螺旋CT扫描仪。检查前给予患儿0.5 mL/kg的10%水合氯醛溶液口服或灌肠。患者取仰卧位,行腹部CT平扫和增强扫描,检查范围自膈顶缘至耻骨联合下缘。扫描参数:80~100 kV,80~110 mAs,层厚5 mm,螺距1.375。增强扫描对比剂采用碘海醇注射液(300 mg I/mL),剂量1.5~2.0 mL/kg,延迟时间为50~60 s。
3.图像分析
所有CT原始数据图像均在AW4.3工作站上进行后处理,采用多平面重组、容积再现和最大密度投影技术进行图像重组。所有影像学资料由两位临床经验丰富的儿科放射科医师独立读片,观察病变累及肠道范围、肠壁厚度、强化程度、周围肠系膜、淋巴结和肠系膜血管受累情况及并发症。意见不一致时通过协商达成一致意见。
结 果
1.临床资料
19例中男9例,女10例,男女比例为9/10。发病年龄为生后1天至7个月,其中11例在新生儿期发病,6例于出生后1至3个月内发病,2例于3个月以后发病。
本组患儿均有消化道症状,主要为腹泻(17例,89.5%)和便血(9例,47.4%);16例患儿有肠外表现,主要包括发热(12例,63.2%)、皮疹(9例,47.4%)和口腔溃疡(9例,47.4%)。15例患儿有并发症,其中肛周脓肿及瘘管形成14例(73.7%)、消化道穿孔4例(22.2%)和肠梗阻1例(5.3%)。
10例患儿于我院进行结肠镜检查,内镜下显示所有患儿直肠均受累,8例累及多节段结肠,1例累及多节段结肠和末端回肠。
本组患儿共有12例进行干细胞移植治疗,其中11例移植成功;接受移植术的患儿中有3例在术前行回肠造瘘术,其中2例造瘘术前发生消化道穿孔。未进行移植治疗的7例患儿中有3例进行手术治疗,其中2例发生消化道穿孔并分别行回肠造瘘术加肠切除术和单纯回肠造瘘术,1例行回肠造瘘术;4例随访观察。
2.影像学表现
18例行腹部X线检查,其中13例表现为肠道动力性改变,1例表现为小肠梗阻,4例有消化道穿孔。
19例行腹部CT增强检查的患者中,18例(94.7%)有结肠子和直肠炎性病变,主要表现为肠壁增厚伴肠壁明显强化(图1);1例(5.3%)表现为小肠低位梗阻(图2)。肠外表现包括肠系膜水肿11例(57.89%),肠系膜血管增生9例(47.4%),肠系膜淋巴结增多7例(36.84%),蜂窝织炎4例(21.1%),肛周脓肿和瘘管形成4例(21.1%)(图3),肠腔狭窄5例(26.3%),脂肪肝5例(26.3%)。
10例患者同时有结肠镜和CT检查资料,CT与结肠镜检查结果相比,诊断敏感度为100.0%,特异度为90.0%。
讨 论
1.病因
相比于成年发病的IBD,儿童时期起病的IBD因发病年龄早,外部环境暴露时间有限,提示宿主遗传在VEO-IBD发病中起重要作用。研究显示VEO-IBD患儿多可见单基因缺陷[6-7], 2009年Glocker等[8]首先报道了IL-10受体(IL-10R)突变所致的VEO-IBD。IL-10通过限制促炎性细胞因子如肿瘤坏死因子(TNF)-α、IL-1、IL-6和IL-12等的分泌来限制和终止免疫应答,并可控制巨噬细胞、T淋巴细胞和B淋巴细胞的分化、增殖,在维持免疫系统平衡中起到重要作用[7]。据文献报道,VEO-IBD患儿中有IL-10基因及其受体基因突变者发病年龄较小,平均为5.0个月,而无基因突变者平均发病年龄为14.7个月[9],本组中有11例患儿在新生儿期发病。
2.临床表现及治疗方案
VEO-IBD患儿的肠道病变以结肠和直肠为主[4],常见的临床表现为腹泻和黏液血便[5];而相对年长的儿童IBD病变部位以末端回肠为主[10]。本组所有病例病变均累及直肠,90%的病例累及多节段结肠,仅1例回盲部受累。文献报道,IL-10及其受体的基因突变导致IL-10负反馈调节受阻,IL-10通路信号传导障碍,导致促炎性细胞因子的表达增高,使患儿肠道出现顽固的难治性高免疫炎症反应[7]。在IL-10通路的免疫调节异常情况下,正常的肠道菌群抗原也会诱发严重的肠道炎症反应[9],这可能是VEO-IBD多表现为直肠和结肠病变的原因之一。内镜检查可见严重的结肠炎症,表现为浅表及深部溃疡,累及范围为直肠至右半结肠,病变呈跳跃性、铺路石样改变;病理组织学表现以上皮内肉芽肿、黏膜层单核细胞浸润及隐窝脓肿为特点[11]。病变肠道的主要CT表现为肠壁节段性增厚伴明显强化,可见周边肠系膜水肿、血管增生及淋巴结增大。
IL-10及其受体突变所致IBD的患儿,肛周病变更多见,以肛裂、肛周脓肿及瘘管形成为突出表现[11-13]。亦有文献报道患儿出现肠-皮肤瘘和直肠-阴道瘘[13]。本组病例中有6例出现肛周脓肿,16例有瘘管形成,其中直肠-会阴瘘9例、肛瘘5例、直肠-阴道瘘1例和直肠-尿道瘘1例。在本组患儿的CT检查中并没有完全显示这些瘘管,分析原因,可能与未做肠道准备、瘘管细小和CT对于瘘管显示的敏感性有限等原因有关。
值得注意的是,本组5例患儿CT发现有肠腔狭窄,1例发生肠梗阻。肠壁增厚是IBD最常见的影像学表现,病变肠段的肠壁明显增厚可导致肠管僵硬和狭窄段的形成,显著狭窄可引起肠梗阻。本组亦有4例患儿出现消化道穿孔,这可能是因为患儿年龄小,肠壁组织相对薄弱,对严重的肠道炎症耐受性差,容易发生穿孔。
与年长儿童有所不同,VEO-IBD患儿的肠外表现多见。肠道炎症可导致反复发热、感染,免疫功能紊乱者还常见口腔溃疡,病情严重和发病年龄小的特点使患儿常见生长发育迟缓和营养不良[14]。本研究中发现部分患儿出现脂肪肝。有IL-10及其受体基因突变的患儿还可见皮肤湿疹,IL-10超家族信号通路的障碍会影响皮肤免疫功能的调控,可能是患儿产生皮疹的主要原因[15]。
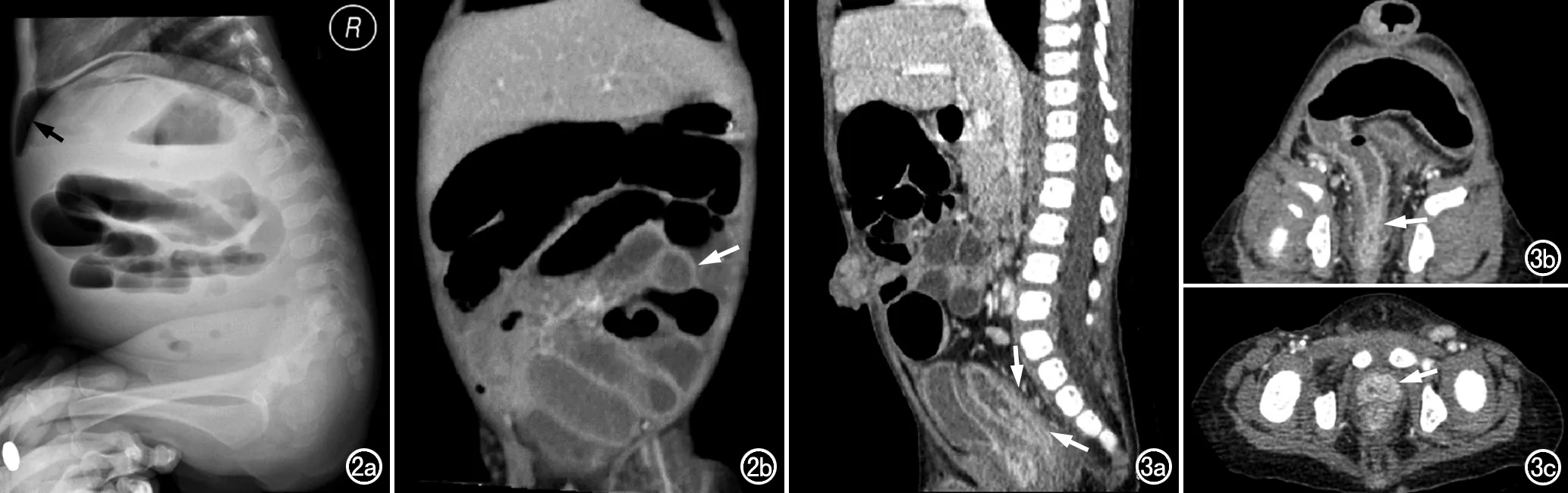
图2 患儿,男,3个月,出生后第8天出现口腔溃疡、1月余出现反复发热。a)腹部侧位片显示中上腹部肠道扩张,可见数个液平,提示小肠低位梗阻,膈下可见游离气体(箭),提示消化道穿孔;b)腹部CT增强冠状面图像,显示部分肠道扩张、积液(箭)。 图3 患儿,男,14个月,生后5天后出现腹泻、血便,行腹部CT增强扫描。a)矢状面图像上显示直肠和乙状结肠的肠壁明显增厚,并有异常强化(箭);b)多平面重组图像,显示直肠和乙状结肠周围肠系膜血管增生,直肠局部狭窄(箭)并经内镜证实,可见脐疝;c)盆腔横轴面图像,显示膀胱下方直肠前方异常强化灶(箭),内镜证实为直肠-尿道瘘。
VEO-IBD对传统药物治疗如激素、5-氨基水杨酸、免疫抑制剂及生物制剂等的反应不佳,移植治疗是有效的治疗方法[16-17]。本组中12例患儿进行了移植治疗,11例取得临床缓解。对于那些肠道炎症严重且持续的患儿,可选择部分结肠或结肠次全切除术、回肠造瘘术等以暂时控制肠道局部炎症反应[18]。Murugan等[19]报道,接受手术治疗患儿的平均年龄为24个月。本组病例中有6例接受了回肠造瘘术,2例行肠道部分切除术,均有效缓解了肠道症状。
3.影像学检查
本组病例中腹部X线检查显示72.2%的患儿可见肠道动力性改变,提示患儿肠动力增加,但这一征象缺乏特异性,无法作为诊断依据。但是,随访中我们发现4例患儿发生消化道穿孔,1例患儿出现肠梗阻,所以笔者认为腹部X线检查操作简便,可作为随访手段用于检出严重的肠道并发症。
CT小肠成像是评估IBD的主要影像学方法之一。CT小肠成像发现活动性炎症性肠病的诊断准确性很高,据报道其敏感度可达86%~100%,特异度达62%~100%[20]。本组中CT检查发现18例(18/19)患儿有直肠和结肠的炎性病变。在进行了结肠镜检查的10例患儿中,CT与结肠镜结果相比,诊断敏感度为100.0%,特异度为90.0%。但由于本组病例均为较小的婴儿,检查前需要镇静处理,故CT检查前均未进行特殊的肠道准备,因而对肠壁增厚和病变累及范围的诊断准确性有一定影响。MRI检查相比CT检查具有无电离辐射、可行DWI等功能成像的优点,有助于评估青少年及成人炎症性肠病的活动性[21],可能更适合于VEO-IBD的早期发现和长期随访,但MRI检查时间较长,容易产生移动伪影,对于VEO-IBD的MR肠道成像检查,我们正在探索和研究中。
综上所述,IL-10及其受体突变所致VEO-IBD发病年龄早,主要累及直肠和结肠,主要临床表现为迁延难治性腹泻和黏液血便,常合并肛周病变,肠外病变多样。CT检查能良好地显示肠道病变及其范围,与肠镜检查的符合率高,特别适用于不耐受肠镜检查的患儿;CT检查亦能同时显示肠外改变和并发症,有助于病情的评估。

