敲低巨噬细胞移动抑制因子表达对人肺成纤维细胞增殖及迁移能力的影响
罗益锋 易慧 黄鑫炎 谭卫平 郭禹标 谢灿茂
中山大学附属第一医院呼吸与危重症医学科,中山大学呼吸病研究所(广州510080)
间质性肺疾病(interstitial lung disease,ILD)是一类主要累及肺间质和肺泡腔,导致肺泡-毛细血管功能单位丧失的弥漫性肺疾病,患者往往表现为慢性咳嗽、活动后呼吸困难及进行性加重的低氧血症,肺功能提示限制性通气功能障碍伴弥散功能障碍,后期多数都可引起弥漫性肺纤维化,现有的各种治疗手段效果欠佳,患者最终出现呼吸功能衰竭而死亡。临床上如能找到抑制或逆转肺纤维化的方法,将大大改善间质性肺疾病患者的预后。
纤维化是一类富含胶原的细胞外基质在结缔组织中过度积聚、异常交联,从而影响组织器官正常结构和功能的病理改变。当组织器官局部出现原发炎症损伤后,机体启动创伤修复机制,组织细胞、成纤维细胞再生增殖。如在此过程中出现成纤维细胞等过度增殖的情况,即可使细胞外基质生成增多、过度积聚,最终发生纤维化[1-3]。因此,成纤维细胞的激活及过度增殖是纤维化发生发展过程中的重要环节。
巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一个多功能性的细胞因子,除了具有促炎症、免疫调节作用外,许多研究显示其还与肿瘤细胞的增殖、转移,动脉硬化,组织器官纤维化的发生发展等密切相关[4-9]。笔者此前的研究发现MIF 可促进人肺癌细胞H460 的增殖[5],因此笔者假设MIF 也可促进人肺成纤维细胞的增殖,从而导致肺间质纤维化的发生。近年来有研究报道,MIF 可以促进肥大细胞介导的人皮肤成纤维细胞的增殖、分化,从而加快硬皮病患者皮肤纤维化的进程[10];另有研究[11]显示MIF 可促进小鼠成纤维细胞NIH/3T3 细胞的增殖。但MIF 对人肺成纤维细胞增殖及迁移能力的影响如何,国际上尚未报道。
本研究用MIF 抑制慢病毒感染人肺成纤维细胞HFL1,构建MIF 抑制细胞株,观察敲低MIF 表达后对HFL1 增殖及迁移能力的影响,旨在明确MIF水平下调是否能抑制HFL1 的增殖及迁移能力,减轻肺纤维化的程度,从而为间质性肺疾病患者的治疗寻找新的靶点。
1 材料与方法
1.1 材料
1.1.1 实验细胞本实验所用的人肺成纤维细胞HFL1 购自于广州赛库生物技术有限公司。
1.1.2 实验试剂DMEM 培养基、改良1640 培养基购于美国HyClone 公司;F12-K 培养基、胎牛血清购于美国Gibco 公司;Puromycin 购于美国sigma公司;PLV.I 购于美国SBI 公司;Polybrene 购于美国Santa Cruz 公司;PEI 购于中国辉园苑科技有限公司;高纯度总RNA 快速提取试剂盒购于中国BIOTEKE 公司;CCK8 试剂购于中国碧云天科技有限公司;PBS 粉剂购于中国博士德公司;抗青霉素链霉素(双抗)购于中国TBD 公司;trypsin-EDTA 溶液购于中国BIOSHARP 公司;丝裂霉素购于美国Roche 公司。
1.2 方法
1.2.1 细胞培养HFL1 细胞采用含有10%胎牛血清的F12-K培养基,置37 ℃、5%CO2培养箱中培养。每隔48 h 更换1 次培养基,待细胞生长至80% ~90%密度时用0.25%胰蛋白酶消化细胞并传代。实验选用对数生长期细胞。
1.2.2 慢病毒包装提前1 d铺3×106/孔293TN细胞于10 cm 平皿;取9 μg PLV.I-MIF 质粒,3 μg pCMV-VSV-G、3 μg pMDLgpRRE、3 μg pRSV-Rev,0.6 mL 无血清DMEM,混合质粒,加入36 μL PEI试剂旋涡离心,室温孵育15 ~20 min;将转染试剂和混合物加到293TN 细胞6 h 换液;混合均匀后,放回37 ℃、5%CO2培养箱,感染24、48 及72 h 收集上层液体,室温下3 000 r/min 离心5 min;取病毒上清分装到1.5 mL 的EP 管中,放到-80 ℃保存备用。
1.2.3 细胞感染感染前1 d HFL1 细胞铺6 孔板铺至80%左右;加入2 mL 病毒上清,2 μg Polybrene及1 mL F12-K 培养基;于37 ℃、5%CO2,继续培养48 h。感染48 h 后检测病毒感染效率。
1.2.4 总RNA 提取-逆转录-聚合酶链式反应(qRT-PCR)鉴定MIF 抑制细胞株用高纯度总RNA 快速提取试剂盒(离心柱型)提取细胞总RNA并检测浓度和纯度,并根据逆转录试剂盒说明书逆转录成cDNA。qPCR 所用的引物由上海生工生物公司合成,以β-actin 作为内参基因,相关引物序列如下:MIF 上游5′-ATCAGCCCGGACAGGGT-3′和下游5′-ACCGTTTATTTCTCCCCACCAG-3′;β-actin上游5′-TGGCACCAGCACAATGAA-3′ 和下游5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。PCR 体系:ddH2O 7.4 μL,SYBR 10 μL,cDNA 1 μL,引物1.6 μL。qPCR 反应条件:94 ℃,1 min,40 循环(94 ℃,15 s;60 ℃20 s;72 ℃20 s)。
1.2.5 CCK8 检测细胞增殖将生长状态良好的细胞消化下来,将细胞悬液接种到96 孔板中,每孔5 000 个细胞,37 ℃,5%CO2培养箱中预养4、24、48 和72 h。向每孔加入20 μL CCK8 溶液,将培养板在培养箱内孵育2 h;用酶标仪测定在450 nm 处的光密度。
1.2.6 Woundhealing法检测细胞迁移先用marker笔在6 孔板背后均匀地划横线,大约每隔0.5 ~1 cm 一道,横穿过孔。每孔至少3 条线。将处于对数生长期的细胞消化下来,制成浓度为1 × 106/mL的细胞悬液均匀接种于6 孔培养板中,置于37 ℃,5%CO2培养箱中常规培养;细胞均匀铺满板底后,用丝裂霉素(4 μg/mL)处理2 h,抑制细胞分裂,用10 μL 枪头垂直于孔板制造细胞划痕,吸去细胞培养液,用PBS 清洗;加入含丝裂霉素(4 μg/mL)的完全培养基置于培养箱中继续培养,分别于划痕后0、24 和30 h 取下室细胞进行拍照;Image Pro-Plus 6.0 软件测量划痕宽度,计算细胞迁移距离。细胞迁移能力用迁移率表示,迁移率=(0 h 的划痕宽度-其他时间点划痕宽度)/0 h 的划痕宽度。
1.3 统计学方法数据使用SPSS 22.0 软件分析,所有数据均表示为均数±标准差。两两比较采用独立样本t检验,实验组与对照组相比,P<0.05 差异具有统计学意义。
2 结果
2.1 MIF 慢病毒成功感染HFL1 细胞本研究应用MIF 抑制慢病毒感染人肺成纤维细胞HFL1,感染48 h 后荧光显微镜下观察细胞感染的效率。结果显示,MIF 抑制慢病毒感染HFL1 细胞中荧光率达95%以上(图1)。
2.2 HFL1-sh-MIF 抑制细胞株的qPCR 鉴定设计针对MIF 的3 个抑制靶点,构建细胞株HFL1-sh-MIF-A、HFL1-sh-MIF-B 和HFL1-sh-MIF-C,以HFL1-sh-NC 为对照组,用qPCR 方法检测MIF mRNA 的表达水平,筛选表达水平最低的细胞株作为实验组进行后续的研究。结果如表1 和图2 显示,与HFL1-sh-NC 相比,细胞株HFL1-sh-MIF-B 的MIF mRNA 表达水平显著下降(P<0.001),抑制效率最高。因此筛选出细胞株HFL1-sh-MIF-B 作为后续研究的实验组细胞株,命名为细胞株HFL1-sh-MIF。
2.3 敲低MIF 抑制HFL1 细胞增殖为了探讨敲低MIF 对HFL1 细胞增殖的影响,用CCK8 检测两组细胞活力,用酶标仪测定在450 nm 处的OD值来反应细胞增殖情况。结果如表2、图3所示。4 h时,两组细胞的OD值差异无统计学意义(P>0.05);24、48 和72 h 时,对照组HFL1-sh-NC 的OD值高于实验组HFL1-sh-MIF,提示HFL1-sh-MIF 细胞株的增殖能力降低,差异有统计学意义(P<0.01)。

表1 不同细胞株MIF mRNA 的表达水平Tab.1 Quantitative results of mif mRNA expression in the established cell lines
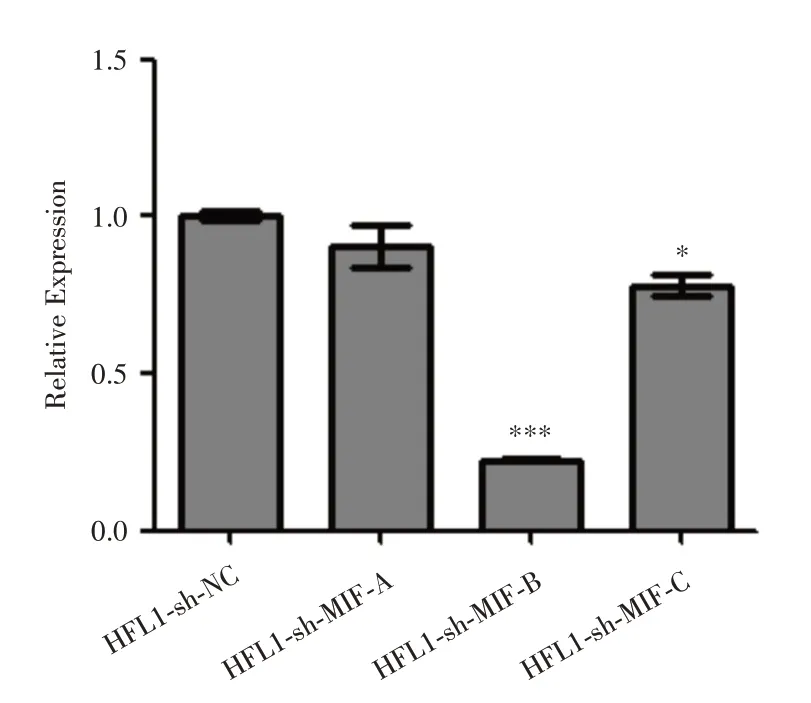
图2 抑制不同靶点后MIF mRNA 的表达水平Fig.2 MIF mRNA expressionfollowing the inhibition of different targets
表2 不同时间点对照组与实验组细胞的增殖情况Tab.2 Proliferation of control group and experimental group at different time points ±s

表2 不同时间点对照组与实验组细胞的增殖情况Tab.2 Proliferation of control group and experimental group at different time points ±s
注:与对照组相比,**P <0.01
时间(h)4 24 48 72光密度值对照组(HFL1-sh-NC,n=3)0.083±0.001 0.187±0.002 0.166±0.001 0.196±0.001实验组(HFL1-sh-MIF,n=3)0.084±0.003 0.105±0.001**0.060±0.000**0.089±0.004**
2.4 敲低MIF 抑制HFL1 细胞迁移能力为了明确敲低MIF 对HFL1 细胞迁移能力的影响,用Woundhealing 法检测对照组HFL1-sh-NC 及实验组HFL1-sh-MIF 细胞株的迁移能力,用迁移率反应细胞的迁移能力。24 h 时,实验组和对照组HFL1 细胞的迁移率差异没有统计学意义;30 h 时,与对照组相比,实验组HFL1-sh-MIF 迁移率显著降低,提示实验组HFL1-sh-MIF 细胞株的迁移能力降低,差异具有统计学意义。见表3、图4。
表3 不同时间点对照组与实验组细胞的迁移率Tab.3 Migration rate of controll group and experimental group at different time points ±s
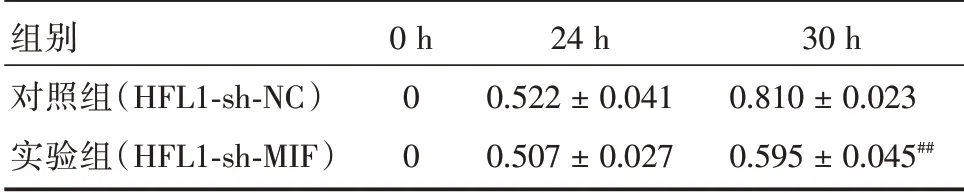
表3 不同时间点对照组与实验组细胞的迁移率Tab.3 Migration rate of controll group and experimental group at different time points ±s
注:与对照组相比,##P <0.01
组别对照组(HFL1-sh-NC)实验组(HFL1-sh-MIF)0 h 0 0 24 h 0.522±0.041 0.507±0.027 30 h 0.810±0.023 0.595±0.045##
3 讨论
MIF 做为一个多功能性的细胞因子,广泛参与到人类炎症、肿瘤、代谢、纤维化等各种疾病的发病机制中。自50 多年前MIF 被发现后,以其作为靶因子进行了许多基础及临床医学的相关研究。常用的针对MIF 进行干预的手段包括使用抗MIF 抗体、MIF 拮抗剂ISO-1 及运用RNA 干扰技术等[5,12-14]。构建shRNA 的慢病毒表达载体是目前较常使用的RNA 干扰技术之一。
慢病毒载体是从二十世纪九十年代发展起来的一种外源性转基因和基因治疗载体。它可以在不导致宿主细胞死亡的条件下在其体内复制,并连续传代,具有高效的转染与整合效率。慢病毒载体技术与siRNA 基因沉默技术相结合,在转基因动物细胞中实现了对特定基因的沉默效应。此外,慢病毒载体能够将基因治疗的基因整合到人的染色体上,使得该基因能够稳定长期的表达,从而达到治疗疾病的目的[15-16]。本研究中,构建针对MIF 特异性的shRNA 慢病毒表达载体,成功应用慢病毒载体感染人肺成纤维细胞HFL1,感染效率高,感染后可显著敲低HFL1 的MIF 表达水平,与文献报道相符。

图4 对照组及实验组细胞株在不同时间点的迁移情况Fig.4 Migration of controll group and experimental group at different time points
近年来对MIF 的深入研究发现,MIF 与成纤维细胞的增殖密切相关。GU 等[10]以成人皮肤成纤维细胞(HDFa 细胞)为研究对象,观察外源性重组人MIF 与抗MIF 抗体对HDFa 细胞的影响,结果显示加入外源性重组人MIF 后,明显促进了HDFa 细胞的生长及胶原蛋白的合成;加入抗MIF 抗体则可显著抑制HDFa 细胞的增殖及胶原合成。在另外两个小鼠成纤维细胞NIH/3T3 和小鼠胚胎成纤维细胞(MEFs)的研究中也发现,MIF 有促进成纤维细胞增殖的作用[11,17]。在本研究用CCK8 检测敲低MIF 表达后对HFL1 增殖的影响,用酶标仪测定在450 nm 处的OD值来反映细胞增殖的情况。结果发现4 h 时,对照组HFL1-sh-NC 和实验组HFL1-sh-MIF 两组细胞的OD值没有显著差异;24、48 和72 h 时,对照组HFL1-sh-NC 的OD值显著高于实验组HFL1-sh-MIF,两组间差异有统计学意义,表明MIF 表达受抑制后HFL1 的增殖减缓。以上结果提示MIF 对人肺成纤维细胞HFL1 的增殖具有促进作用,与文献报道的MIF 对其他物种或其他组织来源的成纤维细胞的作用相同。
MIF 对细胞迁移力的影响因细胞种类不同而各异。它可以显著抑制巨噬细胞的迁移,也因此得名;对中性粒细胞、淋巴细胞等炎症细胞也表现类似的作用,使中性粒细胞、巨噬细胞等炎症细胞在局部趋化聚集,分泌和释放多种炎症因子及炎症介质,最终导致局部炎症发生。对肿瘤细胞,MIF 可以促进其迁移及转移[18-20];对血管平滑肌细胞和微血管来源的内皮细胞,MIF 也表现为促进其迁移的作用[21-22]。对成纤维细胞,DEWOR 等[23]在研究中发现,MIF 可以通过Ca 通道途径激活小鼠胚胎成纤维细胞(MEFs),促进其迁移,使刮伤皮肤创口的愈合加快。本研究用Woundhealing 法检测敲低MIF 表达后对人肺成纤维细胞HFL1 迁移能力的影响。实验中使用含丝裂霉素的细胞培养液抑制细胞增殖,避免因细胞增殖对实验的影响。结果显示在24 h 时,实验组和对照组HFL1细胞的迁移率没有显著差异,在30 h 时,与对照组相比,实验组HFL1 细胞的MIF 表达下调后,其迁移率显著降低。上述结果提示,MIF 对人肺成纤维细胞HFL1 也表现为促进其迁移的作用,和DEWOR 等[23]报道的MIF 对小鼠胚胎成纤维细胞(MEFs)的作用相同。
本研究的主要不足在于未对敲低MIF 表达后抑制HFL1 的增殖及迁移力的相关通路和机制进行深入研究。MITCHELL 等[11]和PETRENKO 等[17]的研究发现MIF 可以通过ERK/MAPKs 信号通路途径及E2F/p53 信号通路途径促进成纤维细胞的增殖。此外,有研究提示MIF 可以通过上调Toll 样受体4(TLR-4)加强脂多糖诱导的滑膜成纤维细胞增殖[24-25]。MIF 对人肺成纤维细胞HFL1 增殖及迁移能力的影响是否也是通过以上通路和机制尚有待进一步实验验证。
肺纤维化的主要病理机制为成纤维细胞的异常增殖或凋亡不足以及细胞外基质的过度沉积,而成纤维细胞迁移、活化后转化为肌成纤维细胞并分泌大量的胶原是细胞外基质的主要成分之一。因此,抑制肺成纤维细胞的迁移、活化和增殖,有助于控制甚至逆转肺间质纤维化。从本研究的结果看,敲低MIF 表达后对人肺成纤维细胞HFL1 的增殖和迁移能力有显著的抑制作用,MIF有望成为抗纤维化治疗的新靶点。

