普瑞巴林可通过抑制TRPV1以缓解神经病理性疼痛
华璐 郭杨 马丽 傅佳 邱玲 赵姣妹 欧册华
1西南医科大学附属医院(四川泸州646000);2西南医科大学(四川泸州646000);3成都市公共卫生临床医疗中心(成都610000)
疼痛是一种令人不愉快的情感体验,它与实际或潜在的组织损伤相关[1],尤其慢性疼痛,严重困扰着人们的生活[2]。慢性疼痛性疾病包括神经病理性疼痛(neuropathic pain,NP)、脊柱源性疼痛、癌性疼痛、炎性相关性疼痛等[3]。据调查研究,在美国,慢性疼痛影响着25% ~30%的人口,其中65 岁以上人群疼痛发病率达60%左右[4]。与此同时,慢性疼痛性疾病通常与代谢性疾病、精神性疾病(包括抑郁和焦虑)相并存[4-5],严重影响人们的生存质量。NP 为直接损伤神经组织引起的慢性疼痛,是慢性疼痛中最为常见的一种,其导致疼痛时间可持续到组织伤愈后数月乃至数年[5]。据有关报道,NP 在普通人群中的患病率高达7% ~10%[6-7]。因此,慢性疼痛对患者的社会、经济、精神、身体健康产生较大影响,是一种较为普遍的公共卫生问题,探讨慢性疼痛特别是NP的治疗方法及其机制具有重要的意义。普瑞巴林(pregabalin,PGB)是应用于临床治疗NP 的一线用药[8],据报道,经PGB 治疗后睡眠干扰指数减少,VAS、NRS 评分结果均降低。PGB 可作用于中枢神经系统中与疼痛密切相关的电压门控钙离子通道蛋白,但这些作用机制尚未明确。因此,本研究首先构建了常用的神经病理性疼痛模型——CCI大鼠模型,并给予PGB 治疗,同时进一步检测与疼痛正相关的电压门控钙离子通道激活蛋白——瞬时阳离子通道亚家族V 成员1 蛋白受体(the transient receptor potential cation channel subfamily V member 1,TRPV1)在CCI 大鼠脊髓中的表达,以探讨PGB 对CCI 大鼠模型的镇痛效果及其机制。
1 材料与方法
1.1 动物分组与CCI 模型鼠的建立
1.1.1 动物分组SPF 级雄性8 周SD 大鼠72 只,购自西南医科大学城北动物实验中心,并在西南医科大学忠山校区动物中心饲养。所有动物实验都经过西南医科大学附属医院实验动物伦理管理委员会的批准,并根据西南医科大学附属医院实验动物有关的规定进行实验。72 只大鼠随机分为6 组:Sham 组(n= 12)为对照组,手术操作同CCI组,但不结扎神经;CCI 组(n= 12):结扎大鼠右侧坐骨神经复制慢性坐骨神经缩窄损伤模型;CCI +PGB 组(n= 12):复制CCI 动物模型,术后7 d 进行痛阈测定后给予普瑞巴林灌胃30 mg/(kg·d),连续7 d;CCI + CPZ 组(n= 12):复制CCI 动物模型,术后7 d 进行痛阈测定后给予TRPV1 拮抗剂辣椒平腹腔注射2 mg/(kg·d),连续7 d;CCI + CPZ +PGB 组(n= 12):复制CCI 动物模型,术后7 d 进行痛阈测定后先给予TRPV1 拮抗剂辣椒平腹腔注射2 mg/(kg·d),30 min 后再给予普瑞巴林灌胃30 mg/(kg·d),连续7 d;CCI+PGB+CP组(n=12):复制CCI 动物模型,术后7 d 进行痛阈测定后先给予TRPV1 激动剂辣椒素腹腔注射30 μg/(kg·d),30 min 后再给予普瑞巴林灌胃30 mg/(kg·d),连续7 d。
1.1.2 CCI 模型鼠的建立腹腔注射6%水合氯醛(3 mg/kg)麻醉大鼠,右侧大腿备皮,俯卧位固定于手术台,术区消毒铺巾,平行于股骨下方3 ~4 mm处做一约1 cm 左右的皮肤切口,游离皮肤,钝性分离,暴露坐骨神经,游离坐骨神经干大约10 mm,将4 根浸泡于生理盐水的4-0 丝线从坐骨神经下方穿过,打四个双节,每个节间隔约1 mm。节的松紧度以可以看到肌肉短暂的抽搐、线不会在坐骨神经上滑动为宜,后逐层缝合肌肉、皮肤。Sham组只是分离暴露坐骨神经但不进行结扎,余操作相同。大鼠模型复制成功后可见大鼠手术侧活动时出现跛行,休息时足不接触地面,足内收,外翻,震颤等。Sham 组大鼠术后未见异常活动、运动障碍等表现。
1.2 大鼠机械痛阈测定通过Von Frey Filament感觉测试器测定大鼠足部机械痛阈,测定3 次,取均值。当发生模糊反应(如出现行走、梳理毛发等情况),则使用相同的刺激力进行重复刺激。于术前、术后3、5、7、14 d 每组随机抽取6 只大鼠进行痛阈测定,该操作由同一位实验员进行,但其对动物分组情况不明。
1.3 免疫组化检测各组大鼠中TRPV1 蛋白的表达在14 d 完成痛阈测定后,每组随机抽取6 只大鼠麻醉后予4%多聚甲醛灌注组织,提取腰膨大段脊髓置于4%多聚甲醛中固定,制成石蜡切片。严格按照SP 法免疫组化试剂盒(南京凯基)说明检测大鼠脊髓中TRPV1 蛋白的表达。每张免疫组化切片随机拍摄3 张以上照片,对采集的图片使用Image-pro Plus 6.0 软件进行分析。
1.4 免疫印迹检测各组大鼠中TRPV1 蛋白的表达在14 d 完成痛阈测定后,每组随机抽取6 只大鼠,断头处死后,取腰膨大段脊髓,冻存于-80 ℃冰箱。提取腰膨大段脊髓背角组织的总蛋白,经SDS-PAGE 电泳、转模、孵育一抗(抗体稀释度为1∶500,兔多克隆抗体,Invitrogen,美国)和二抗后,按ECL 试剂盒说明进行化学发光、显影、定影。用image-J 软件图像分析系统对各条带进行灰度测定,目标条带TRPV1 与内参β-actin 比较,以矫正蛋白定量、上样过程中存在的实验误差。
1.5 统计学方法采用SPSS 22.0 统计软件对数据进行统计分析。计量资料用均数± 标准差表示,组内、组间比较采用单因素方差分析和LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 PGB 可减低CCI 模型大鼠机械痛阈为研究PGB 的镇痛机制,首先构建了CCI 大鼠模型,随后予PGB、CPZ 治疗以了解PGB 对CCI 模型大鼠机械痛阈的疗效。研究结果表明:各组大鼠CCI 造模术前痛阈差异无统计学意义(P>0.05);Sham 组大鼠术前术后各时间点痛阈比较差异无统计学意义(P>0.05);CCI 组、CCI+PGB 组、CCI+CPZ 组、CCI + CPZ + PGB 组大鼠术后各时间点痛阈低于术前(P<0.05)。术后14 d,CCI 组(3.78±1.80)g、CCI + PGB 组(5.56 ± 1.62)g、CCI + CPZ 组(7.67 ±1.57)g、CCI+CPZ+PGB组(8.00±1.37)g 大鼠痛阈低 于Sham 组(18.72 ± 6.17)g(P<0.05);CCI +PGB组、CCI+CPZ组、CCI+CPZ+PGB组大鼠痛阈高于CCI 组(P<0.05);CCI + CPZ + PGB 组、CCI+CPZ组大鼠痛阈高于CCI+PGB组(P<0.05);CCI +CPZ + PGB 组大鼠痛阈高于CCI + CPZ 组,但差异无统计学意义(P>0.05)。各组大鼠造模术前后痛阈变化详见图1。

图1 PGB 可减低CCI 模型大鼠机械痛阈Fig.1 PGB reduces mechanical pain threshold in CCI model rats
各组大鼠CCI 造模术前、术后3 d、术后5 d、术后7 d 及术后14 d 的机械痛阈比较显示:各组大鼠术前痛阈差异无统计学意义(P>0.05);Sham 组大鼠术前后各时间点痛阈比较差异无统计学意义(P>0.05);CCI 组、CCI + PGB 组、CCI + CPZ 组、CCI+CPZ+PGB 组大鼠术后各时间点痛阈低于术前(P<0.05);术后各时间点CCI 组、CCI+PGB 组、CCI + CPZ 组、CCI + CPZ + PGB 组大鼠痛阈低于sham 组(P<0.05);术后14 d,CCI + PGB 组、CCI +CPZ 组、CCI + CPZ + PGB 组大鼠痛阈高于CCI 组(P<0.05);CCI+CPZ+PGB 组、CCI+CPZ 组大鼠痛阈高于CCI+PGB 组(P<0.05)。
2.2 PGB 可减低CCI 模型大鼠TRPV1 蛋白的表达既往研究表明电压门控钙离子通道激活蛋白TRPV1 的激活会引起疼痛反应增强,其在多种炎性和神经病理性疼痛模型中表达上调,抑制TRPV1 时疼痛减轻;而PGB 可作用于CNS 中电压门控钙离子通道(VGCC)的α2δ亚基蛋白。因此,为探讨PGB 提高CCI 模型大鼠机械痛阈的机制,我们检测了各组大鼠中TRPV1 蛋白的表达。免疫组化研究结果显示(图3、4):造模术后14 d,CCI 组(光密度值为0.177 6 ± 0.004 2)、CCI +PGB 组(0.160 3 ± 0.005 6)、CCI + CPZ 组(0.143 3± 0.004 1)、CCI + CPZ + PGB 组(0.140 4 ± 0.005 6)大鼠的TRPV1 蛋白表达高于Sham 组(0.124 8 ±0.008 5)大鼠(P<0.05);但经治疗后,CCI + PGB组、CCI + CPZ 组、CCI + CPZ + PGB 组大鼠TRPV1蛋白的表达比CCI 组低(P<0.05),CCI + CPZ 组、CCI + CPZ + PGB 组大鼠TRPV1 蛋白的表达比CCI + PGB 组低(P<0.05);CCI + CPZ + PGB 组与CCI + CPZ 组大鼠的TRPV1 蛋白表达差异无统计学意义(P>0.05)。
类似的,免疫印迹结果也显示(图4):造模术后14 d,Sham 组、CCI 组、CCI+PGB 组、CCI+CPZ 组、CCI + CPZ + PGB 组大鼠脊髓的TRPV1 的蛋白表达分别为0.124 8 ± 0.008 5、0.177 6 ± 0.004 2、0.160 3±0.005 6、0.143 3±0.004 1、0.140 4±0.005 6。CCI 组、CCI + PGB 组、CCI + CPZ 组、CCI + CPZ +PGB 组大鼠脊髓的TRPV1 的蛋白表达比sham 组大鼠明显升高(P<0.05);CCI+PGB 组、CCI+CPZ组、CCI + CPZ + PGB 组大鼠的TRPV1 蛋白表达比CCI 组低(P<0.05);CCI+CPZ 组TRPV1 蛋白表达比CCI + PGB 组低(P<0.05);CCI + CPZ 组(0.93 ±0.02)大鼠TRPV1 蛋白表达与CCI +CPZ+PGB 组相比差异无统计学意义(P>0.05)。因此,以上免疫组化和免疫印迹结果充分表明PGB 可减低CCI模型大鼠TRPV1 蛋白的表达。

图2 免疫组化检测各组大鼠术后14 d 脊髓TRPV1 蛋白的表达情况Fig.2 Immunohistochemical detection of TRPV1 protein expression in the spinal cord of rats in each group at 14 days after surgery

图3 免疫组化检测各组大鼠术后14 d 脊髓TRPV1 蛋白的表达的定量分析Fig.3 Quantitative analysis of the expression of TRPV1 protein in the spinal cord of rats in each group at 14 days after immunohistochemical detection
各组大鼠免疫组化染色TRPV1 蛋白后光密度定量分析结果显示:造模术后14 d,CCI 组、CCI +PGB 组、CCI + CPZ 组、CCI + CPZ + PGB 组大鼠的TRPV1 蛋白表达高于Sham 组(P<0.05);但经治疗后,CCI + PGB 组、CCI + CPZ 组、CCI + CPZ + PGB组大鼠TRPV1 蛋白的表达比CCI 组低(P<0.05),CCI + CPZ 组、CCI + CPZ + PGB 组大鼠TRPV1 蛋白的表达比CCI+PGB组低(P<0.05)。
免疫印迹结果显示:造模术后14 d,CCI 组、CCI+PGB 组、CCI+CPZ 组、CCI+CPZ+PGB 组大鼠脊髓的TRPV1 的蛋白表达比Sham组大鼠明显升高(P<0.05);CCI + PGB 组、CCI + CPZ 组、CCI +CPZ + PGB 组大鼠的TRPV1 蛋白表达比CCI 组低(P<0.05);CCI + CPZ 组TRPV1 蛋白表达比CCI +PGB组低(P<0.05)。
2.3 PGB可通过抑制TRPV1蛋白的表达而减轻神经病理性疼痛为进一步研究PGB 的镇痛机制,同样构建了CCI 大鼠模型,予PGB 治疗CCI 大鼠后,再予TRPV1 激动剂辣椒素CP 干预。研究结果(图4)表明:术后14 d,CCI 组(3.60 ± 1.14)g、CCI+PGB 组(8.40±1.14)g 大鼠痛阈低于Sham 组(18.00 ± 1.58)g(P<0.05);予PGB 治疗CCI 大鼠后,CCI + PGB 组大鼠痛阈比CCI 组升高了(P<0.05);同时给予PGB 和TRPV1 激动剂辣椒素CP干预CCI 大鼠后,CCI + PGB + CP 组(4.2 ± 1.30)g痛阈低于CCI+PGB 组(P<0.05),且与CCI 组比较差异无统计学意义(P>0.05)。这些结果表明PGB 可通过抑制TRPV1 蛋白的表达而减轻神经病理性疼痛。
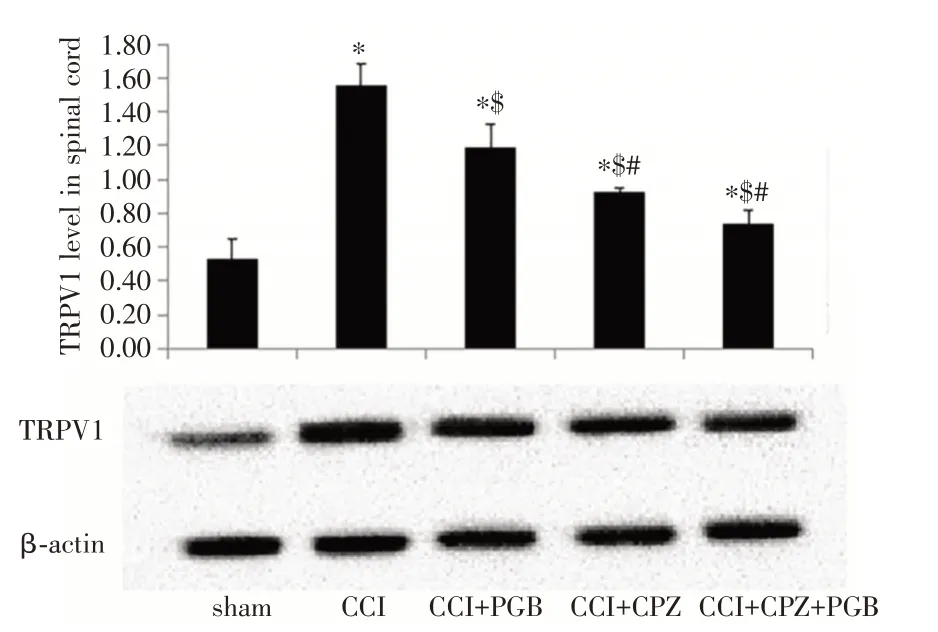
图4 免疫印迹检测各组大鼠术后14 d 脊髓TRPV1 蛋白的表达Fig.4 TRPV1 protein expression in the spinal cord of rats in each group at 14 days after immunoblot detection

图4 PGB 通过抑制TRPV1 蛋白的表达而提高CCI 模型大鼠机械痛阈Fig.4 PGB increases the mechanical pain threshold of CCI model rats by inhibiting the expression of TRPV1 protein
术后14 d CCI 组、CCI + PGB 组、CCI + PGB +CP 组大鼠痛阈均低于Sham 组(P<0.05)。术后14 d,CCI+PGB 组大鼠痛阈高于CCI组(P<0.05),CCI + PGB + CP 组大鼠痛阈与CCI 组大鼠痛阈差异无统计学意义(P>0.05),小于CCI+PGB组大鼠(P<0.05)。
3 讨论
疼痛是与实际或者潜在的组织损伤相关的令人不愉快的情感体验[1],在一定程度上疼痛是一种自我保护机制[1,9],但NP 疼痛可持续较长时间,甚至数月乃至数年[5]。慢性疼痛性疾病包括NP、脊柱源性疼痛、癌性疼痛、炎性相关性疼痛等[3]。据调查研究,中国北京慢性疼痛在社区的患病率为8.91%[10-11]。此外,慢性疼痛性疾病常常与代谢性疾病、精神性疾病(包括焦虑和抑郁)等相伴随[4,12]。总之,慢性疼痛对患者的精神、经济、身体健康产生较大影响,是一种较为普遍公共卫生问题。因此,探讨慢性疼痛特别是NP 的治疗方法及其机制具有重要的意义。
本研究中,为研究NP 的机制,首先构建了CCI大鼠模型,随后予PGB 或TRPV1 抑制剂CPZ 治疗以了解他们对CCI 模型大鼠机械痛阈的疗效。研究结果表明PGB 和CPZ 都能有效地提高CCI 大鼠模型的痛阈。为进一步研究PGB 的镇痛机制,检测了与疼痛正相关的电压门控钙离子通道激活蛋白TRPV1 在CCI 大鼠脊髓中的表达,免疫组化和免疫印迹结果均充分表明PGB 可减低CCI 模型大鼠脊髓中TRPV1 蛋白的表达;同时给予PGB 和TRPV1 激动剂CP 干预CCI 大鼠后,其痛阈比CCI+PGB 组大鼠降低了,且与CCI 组大鼠比较差异无统计学意义。这表明PGB 可通过下调脊髓中TRPV1 蛋白的表达来对神经病理性疼痛产生镇痛作用。
PGB 是一种抗癫痫药物,是目前治疗NP 的一线用药[8]。孙卓浩等[9]通过对1 625 例PHN 患者的研究表明,经PGB 治疗后患者睡眠干扰指数减少,VAS、NRS 评分均降低。PGB 可减少谷氨酸为主的兴奋性神经递质释放,从而抑制神经元的过度兴奋以达到镇痛的目的[10]。但PGB治疗NP的作用机制目前尚未被完全阐明。本研究中,为研究PGB 的镇痛机制,首先构建了常用的神经病理性疼痛模型——CCI 大鼠模型,随后予PGB 治疗,结果显示PGB 可有效地提高CCI 大鼠模型的痛阈。
TRPV1 又称辣椒素受体,是一种非选择性阳离子通道,其主要作用于周围神经系统伤害性感受神经元中。TRPV1 可通过细胞内信号转导途径,进而激活酪氨酸激酶受体(RTKs)和G 蛋白耦联受体(GPCRs)而致敏。TRPV1 也可被内源性的配体,酸性环境、高于42 ℃的温度等外源性所激活,进而激活电压门控钙离子通道,引发一系列的生物学效应。TRPV1 的致敏与激活均可增强疼痛反应。在多种疼痛模型中TRPV1 表达上调,疼痛减轻[13-15],表明TRPV1 是疼痛信号传导的关键整合者。大鼠坐骨神经慢性缩窄性损伤(chronic constriction injury,CCI)模型是神经病理性疼痛常用模型[16-17]。研究[18-20]表明在CCI 模型中,脊髓里的TRPV1 会上调。辣椒素(capsaicin,CAP)是TRPV1 的激动剂,其可诱导CCI 模型脊髓中的P 物质、降钙素基因相关肽等神经肽的释放增加而导致TRPV1 致敏,进而参与到神经病理性疼痛的发生和(或)维持[20]。因此为进一步研究PGB 的镇痛机制,本文检测了与疼痛正相关的蛋白TRPV1在CCI 大鼠脊髓中的表达,免疫组化和免疫印迹结果均充分表明PGB 可减低CCI 模型大鼠脊髓中TRPV1 蛋白的表达。此外本研究结果还显示TRPV1 抑制剂CPZ 组对CCI 鼠的镇痛作用强于PGB,CCI + CPZ 组TRPV1 蛋白表达比CCI + PGB组低(P<0.05),CCI + CPZ 组大鼠TRPV1 蛋白表达与CCI + CPZ + PGB 组相比差异无统计学意义(P>0.05)。即抑制TRPV1 蛋白的表达后,PGB 不能通过进一步抑制TRPV1 的表达以提高机械痛阈。同时给予PGB 和TRPV1 激动剂CP 干预CCI大鼠后,CCI + PGB + CP 组大鼠的痛阈比CCI +PGB 组大鼠降低了,且与CCI 组大鼠比较差异无统计学意义。这些结果表明PGB 可通过下调脊髓中TRPV1 蛋白的表达,从而缓解神经病理性疼痛。
综上所述,NP 是一种较为普遍公共卫生问题,探讨NP 的治疗方法及其机制具有重要的意义。本研究中,为研究NP 的机制,首先构建了常用的神经病理性疼痛模型——CCI 大鼠模型,随后予PGB 或TRPV1 抑制剂CPZ 治疗,结果表明PGB和CPZ 都能有效地提高CCI 大鼠模型的痛阈。为进一步研究PGB 的镇痛机制,检测了与疼痛正相关的TRPV1 蛋白在CCI 大鼠脊髓中的表达,免疫组化和免疫印迹结果都显示PGB 可减低CCI 模型大鼠脊髓中TRPV1 蛋白的表达;同时给予PGB 和TRPV1 激动剂CP 干预CCI 大鼠后,其痛阈比CCI+PGB 组大鼠降低了,且与CCI 组大鼠比较差异无统计学意义。这表明PGB 可通过抑制TRPV1 蛋白表达来缓解神经病理性疼痛。这为NP 的治疗提供了新的思路。
NP 是一种较为普遍公共卫生问题,探讨NP的治疗方法及其机制具有重要的意义。本研究结果表明PGB 可通过抑制TRPV1 蛋白表达来缓解神经病理性疼痛,但仍需在体内外实验、甚至人体实验中进一步验证,同时TRPV1 蛋白的上下游靶点的作用也仍需进一步探讨。

