产酸芽孢杆菌的获得及其发酵液对水稻种子萌发的影响
李可,吕可欣,孙冬梅
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
水稻是我国主要的粮食作物,约占全国粮食总产量的1/3[1]。水稻属喜弱酸性的作物,适宜的pH值为6~7,根系正常生长的适宜pH 值为4.5~5.5,偏酸性的土壤对水稻秧苗的生长极为有利[2]。可能与酸性条件可活化土壤中某些营养元素,消减有害物质积累,提高秧苗生理机能及增强抗逆性有关[3]。
床土调酸目的是创造一个适宜的酸性土壤环境,提高水稻种子萌发的生理机能及土壤中磷铁等营养元素的有效性和根系吸收能力,抑制立枯病菌的繁殖,一定程度上决定了育苗的成败。目前常用的调酸方法有两种,一种是采用钙镁磷肥、石灰氮等化学调酸剂,另一种是用98%的浓硫酸直接调酸[4-5]。传统土壤调酸的方式虽然有效但是不好掌握用量,容易造成残留污染。木醋液有效成分主要是有机酸,经过一定倍数稀释后可替代化学调酸剂用于水稻育秧苗床土调酸[2]。而大量微生物在代谢过程中可以产生有机酸[6-7],由此可见,生物调酸可以作为一种更新化学调酸的手段。
芽孢杆菌(Bacillus spp.)是农业生产中的重要微生物资源,常用的芽孢杆菌主要有枯草芽孢杆菌(B.subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、多粘类芽孢杆菌(B.polymyxa)、蜡样芽孢杆菌(B.cereus)、巨大芽孢杆菌(B.megaterium)、短小芽孢杆菌(B.pumilus)等[8-12]。而目前有关芽孢杆菌产酸方面鲜被提及,因此,筛选具有产酸能力的芽孢杆菌意义重大。
种子的萌发是种子从吸水到胚根突破种皮期间所发生的一系列生理生化变化的过程[13]。种子组织中存在超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等抗逆酶,能够在种子萌发过程中清除代谢产生的活性氧,保护种子膜结构在发芽期间的完整性[14]。丙二醛(MDA)含量可反映机体内脂质过氧化程度,间接反映植物胞膜受伤害的程度[15]。种子萌发过程中抗逆酶活性的增加有利于防御病菌入侵,有效的降低了种子萌发过程中病害的发生[16]。
试验通过选择培养基分离,获得产酸芽孢杆菌,利用产酸芽孢杆菌发酵液对水稻种子进行萌发试验,以探究不同浓度产酸芽孢杆菌发酵液对水稻种子萌发的影响,从而为产酸芽孢杆菌在水稻生产中的具体应用提供科学依据,为水稻生物调酸提供新的微生物资源。
1 材料与方法
1.1 试验材料
水稻种子:龙粳18,由黑龙江八一农垦大学农学院水稻研究室提供。
分离培养基:酵母膏10 g,碳酸钙10 g,蔗糖10 g,无水乙醇30 mL,琼脂粉18 g,蒸馏水定容至1 000 mL。
液体培养基:酵母膏10 g,蔗糖10 g,无水乙醇30 mL,蒸馏水定容至1 000 mL。
1.2 试验方法
1.2.1 产酸芽孢菌株的分离与纯化
将供试土壤样品用无菌水10倍稀释后,置于80℃恒温水浴锅中处理30 min,然后将处理液10倍等比稀释,选取10-5的土壤稀释液在分离培养基中进行涂布法分离。分离后的培养皿倒置于30℃的培养箱内培养2 d。挑取钙溶解圈较大的单个纯菌落转移到斜面试管中培养。
1.2.2 产酸菌株的鉴定
采用显微观察、生理生化指标测定与16S rDNA测序技术相结合进行产酸菌株鉴定。
具体生理生化指标选择根据《芽孢杆菌属(Bacillus)二分检索表》中的相应指标,对待测菌株进行检验[17]。
将待测菌株在液体中培养24 h,采用CTAB/Na-Cl裂解法提取菌液DNA,选择通用引物27F和1492R进行PCR,PCR产物送公司测序,测序结果在GenBank数据库中进行比对,并对其进行系统发育分析。具体方法如下:
CTAB/NaCl裂解法提取菌液DNA:将产酸菌单菌落培养于液体培养基中,放置于30℃摇床中振荡培养 24 h,摇床转数为 110 r·min-1。取 1.0 mL 培养后的菌液加入1.5 mL离心管中,13 000 r·min-1的转速下离心2 min后去除上清;沉淀重悬于1.0 mL 0.85%的NaCl溶液中,13 000 r·min-1的转速下离心2 min后去除上清;沉淀重悬于550 μL 1×TE中,加入浓度为 35 mg·mL 的溶菌酶 17 μL,37 ℃下温育 30 min;加浓度为20 mg·mL的蛋白酶K3 μL,37℃下温育30 min;加 30 μL的 10%SDS溶液,37℃下温育30 min;加 100 μL 5 M NaCl溶液充分混匀;加 80 μL CTAB/NaCl溶液,混匀后在65℃下水浴10 min;加等体积氯仿/异戊醇(24∶1),轻轻振荡混匀后在13 000 r·min-1的转速下离心10 min,取上清液加入到新的1.5 mL的离心管中,加入等体积酚/氯仿/异戊醇(25∶24∶1)振荡混匀,12 000 r·min-1离心 5 min,保留上清;加入0.48 mL异丙醇,轻轻震荡混合至DNA沉淀产生,12 000 r·min-1离心15 min,收集DNA沉淀,用1 mL 75%乙醇于12 000 r·min-1离心5 min洗涤DNA沉淀,真空干燥0.5 h。将最终得到的DNA沉淀溶解于 50 μL 1×TE 中。
PCR 反应体系为 50 μL:10×PCR Buffer 5 μL;MgCl 4 μL;dNTP 1 μL;模板 DNA 2 μL;引物 27F/1492R 各 4 μL;Taq DNA 酶 2 μL;ddH2O 补足到 50 μL。
PCR反应条件:95℃预变性5 min;95℃变性30 s;50℃退火1 min;72℃延伸1.5 min,循环扩增25次;72℃下温育5 min;4℃保存。
1.2.3 产酸菌发酵液对水稻种子萌发的影响
选取籽粒饱满的水稻种子,共设置8个处理,每处理3次重复,每次重复100粒种子。具体处理设置为产酸芽孢杆菌发酵液与清水按 0∶1,1∶50,1∶40,1∶30,1∶20,1∶10,1∶0 比例稀释,同时设置一个培养基的对照,进行水稻种子萌发试验。
萌发试验处理方法为:利用不同处理的液体分别浸种24 h后,将种子摆放于含有相同液体润湿的滤纸上,置于无菌培养皿中,覆盖相同处理润湿的滤纸保湿,盖上皿盖。3 d后检测种子发芽率及测定种子萌发过程中的生理指标变化。采用硫代巴比妥酸法测定MDA含量,氮蓝四唑光化还原法测定SOD活性,紫外吸收法测定CAT活性,愈创木酚法测定POD 活性[18-19]。
样品粗酶提取液制备:称0.5 g样品放入研钵中,倒入少量石英砂,在冰浴条件下进行研磨,待样品磨成粉末状后,加入pH为7.8的磷酸缓冲液5 mL继续研磨,后将研磨物全部倒入10 mL离心管中,4℃下4 000 r·min-1离心20 min,取上清液即为粗酶液,置于4℃下备用。
MDA含量测定:取1 mL粗酶液加入2 mL MDA反应液,封口后沸水浴15 min,冷却后离心,取上清在OD600、OD532、OD450三个波长下比色,每组三个重复。空白以1 mL蒸馏水代替粗酶液,其余处理与试验组一致。MDA含量单位为μmol·g-1,含量计算公式:
MDA 浓度 C(μmol·L-1)=6.45(OD532-OD600)-0.56 OD450;MDA 含量(μmol·g-1)=C×V/W
式中V为提取液体积,W为样品鲜重。
SOD酶活性测定:各组分别取粗酶液200 μL,加入3 mL SOD反应液后置于4 000 Lux光照强度下,反应30 min后在OD560下进行比色,每组三个重复。空白为200 μL pH为7.8的磷酸缓冲液加入3 mL SOD反应液,严格避光保存30 min。酶活单位为鲜重酶单位每克(U·gFW-1),计算公式:
SOD总活性=[(Ack-AE)×V]/(1/2Ack×W×Vt)
Ack为照光对照管的吸光度,AE为样品管的吸光度,V为样品液总体积,Vt为测定时的酶液用量,W为样品鲜重。
CAT酶活性测定:取200 μL粗酶液加入2.5 mL CAT反应液,立即放于OD240下比色,每隔一分钟读数一次,共计五分钟。以每分钟变化OD值为酶活单位,每组三次重复。空白对照为200 μL pH为7.8的磷酸缓冲液中加入2.5 mL CAT反应液。以每分钟OD 值降低 0.01 为单位酶活(U·(g·min)-1),计算公式:
CAT=[ΔA240×Vt]/(W×Vs×0.01×t)
ΔA240为反应时间内吸光度的变化,W为样品鲜重,t为反应时间(min),Vt为提取酶液总体积,Vs为测定时取用酶液体积。
POD酶活性测定:取200 μL酶液加入3 mL POD反应液,立即置于分光光度计中在OD470下比色,每隔一分钟读数一次,共计五分钟。以每分钟酶活变化OD值为酶活单位,每组3次重复。空白为200 μL pH为7.8的磷酸缓冲液中加入3 mL POD反应液。以每分钟 OD 值升高 0.01为单位酶活(U·(g·min)-1),计算公式:
POD=(ΔA470×Vt)/(W×Vs×0.01×t)
ΔA470为反应时间内吸光度的变化,W为样品鲜重,t为反应时间,Vt为提取酶液总体积,Vs为测定时取用酶液体积。
1.3 数据分析
使用Excel表格和SPSS软件进行数据处理。
2 结果与分析
2.1 产酸菌株的分离
培养2 d后,在平板上出现大量菌落,从具有水解圈并生长旺盛的单菌落中分离选取12株,记录从菌落边缘至透明水解圈边缘的距离(表1)。通过对比发现:2号菌落的透明水解圈最大,为5.5 mm,将其命名为BY-2073。在分离培养基上,该菌落呈油脂状,米白色,表面平滑,边缘整齐,培养基内不产生色素(图 1)。
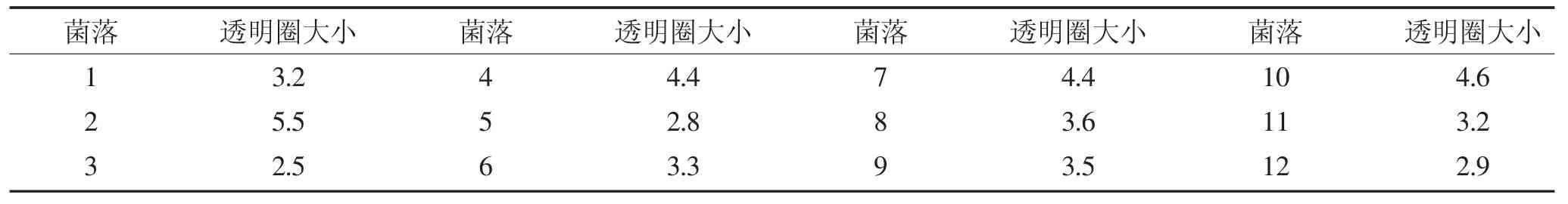
表1 12株产酸芽孢杆菌菌落透明水解圈大小(mm)Table 1 Transparent ring size of 12 colonies of Bacillus strains of lactic acid hydrolysis(mm)
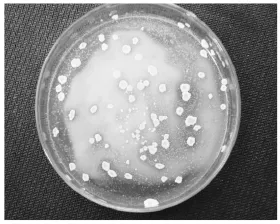
图1 产酸芽孢杆菌by-2073菌落形态Fig.1 Colonial morphology of acid-producing bacillus
2.2 产酸菌株的鉴定
纯化后生长2 d的菌体经简单染色后在显微镜油镜下观察发现:菌体形态多为短杆状,有芽孢,单个或成对、成链排列(图2)。革兰氏染色和芽孢染色结果为革兰氏阳性菌,芽孢小于1 μm,位于菌体一端且菌体没有膨大(图3,图4)。
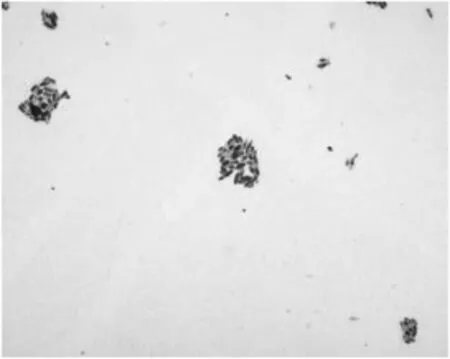
图2 简单染色Fig.2 Simple stain
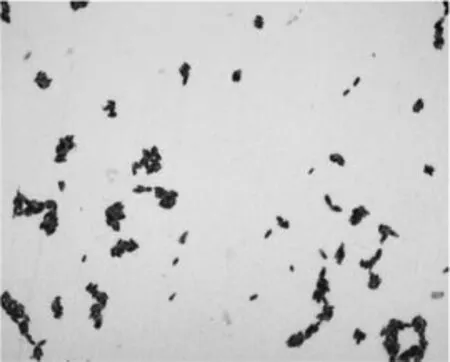
图3 革兰氏染色Fig.3 Gram stain
图4 芽孢染色Fig.4 Spore stain
根据二分检索表,对该菌株的形态学及其生理生化特征进行鉴定,发现该菌株符合短小芽孢杆菌(Bacillus pumilus)的主要特征(表 2);16S rDNA 分子鉴定表明:该菌株DNA的PCR产物片段长度约为1 500 bp,送检测序结果经Genbank比对并构建了系统进化树(图5),确定待测菌株BY-2073也为短小芽孢杆菌,故结合形态与生理生化指标及分子生物学鉴定,初步确定该菌株为短小芽孢杆菌。

图5 待测菌株BY-2073的系统进化树Fig.5 Phylogenetic tree of the tested strain BY-2073

表2 待测菌株BY-2073二分检索鉴定结果Table 2 Binary search evaluation test of the tested strain BY-2073
2.3 短小芽孢杆菌BY-2073菌株发酵液对水稻种子萌发的影响
2.3.1 发酵液处理对水稻种子萌发率的影响
由图6可以看出,水稻种子经过不同浓度产酸菌发酵液处理,除1∶0发酵液稀释液处理的种子几乎没有萌发迹象外,不同浓度产酸菌发酵液对水稻种子萌发率均有促生作用,种子萌发率均在92%左右。
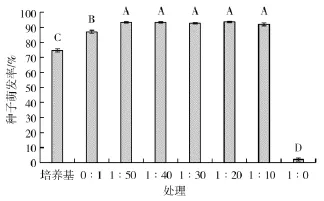
图6 不同处理对水稻种子萌发率的影响Fig.6 Effect of different treatments on rice seed germination rate
2.3.2 发酵液处理对水稻种子萌发中MDA含量的影响
图7表明,经不同浓度发酵液处理后的水稻种子MDA含量不同,除1∶20和1∶10发酵液稀释液之外,其他处理与对照相比,MDA含量均有降低。其中,1∶30发酵液稀释液处理的水稻种子MDA含量最低,达到2.747 Umol·g-1,与清水对照相比降低了43.30%。
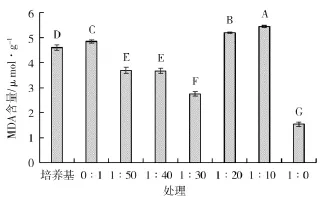
图7 不同处理对MDA含量的影响Fig.7 Effect of different treatments on MDA contents
2.3.3 发酵液处理对水稻种子萌发中SOD活性的影响
图8表明,经不同浓度发酵液处理后的水稻种子SOD酶活性不同,各浓度发酵液稀释液对水稻种子SOD酶活性均有促进作用,1∶30发酵液稀释液处理的水稻种子SOD酶活活性达到最高,为63.713 U·g-1,与清水对照相比提高了124.37%。
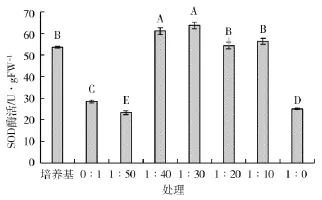
图8 不同处理对SOD酶活性影响Fig.8 Effect of different treatments on SOD enzyme activity
2.3.4 发酵液处理对水稻种子萌发中CAT活性的影响
从图9可以看出,经不同浓度发酵液处理的水稻种子CAT活性不同,除1∶0发酵液稀释液外,其余处理水稻种子CAT活性均低于清水对照,1∶30发酵液稀释液处理的水稻种子CAT活性为191.667 U,与清水对照相比提高了24.32%。
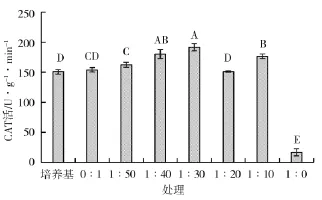
图9 不同处理对CAT酶活性影响Fig.9 Effect of different treatments on CAT enzyme activity
2.3.5产酸菌发酵液对水稻种子萌发时POD活性的影响
从图10可以看出,经过不同浓度发酵液稀释液处理的水稻种子POD酶活性均较高,1∶40发酵液稀释液处理的水稻种子POD酶活性为14 416.667 U,与清水对照相比提高了33.13%。
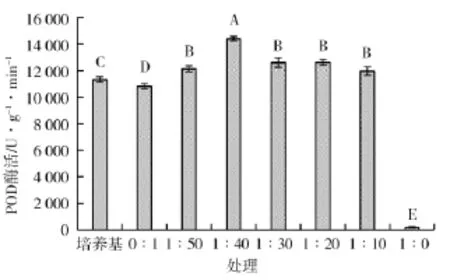
图10 不同处理对POD酶活性的影响Fig.10 Effect of different treatments on POD enzyme activity
3 讨论与结论
芽孢杆菌是一类重要的根际促生细菌,由于其能产生抗逆性强的芽抱、对环境和人畜安全等特性而被广泛地应用于实际生产中,谢珊珊[20]的试验验证枯草芽抱杆菌OKB105能够明显促进水稻株高的生长,促生效果为25.2%。陈刘军等[21]发现蜡状芽孢杆菌AR156能抑制水稻纹枯病菌的生长,直接降低病害传播的可能性,能增强水稻保护性酶SOD,CAT和POD酶活性,增加水稻对纹枯病的抵抗力。Chauhan等[22]通过田间试验,分别用内生芽孢杆菌TSH42和蜡状芽孢杆菌TSH7进行细菌化的姜黄植株和联合使用对姜黄有促生作用并且提高了姜黄的产量。Qiao J等[23]通过试验明确枯草芽孢杆菌PTS-394能够促进番茄植株生长,并且能够有效抑制土壤传播疾病。王勇等[24]采用单因素试验和正交试验筛选出解淀粉芽孢杆菌GZ-5的最适生长条件,并通过盆栽试验确定其对番茄具有促进生长的作用。何碧珀等[25]采用浸种法试验,得到解淀粉芽孢杆菌B10-26发酵液对芝麻种子的萌发率及芝麻幼苗的根长、株高和鲜、干质量都有显著促进作用。金美芳等[26]将多粘类芽孢杆菌S960对番茄灌根使用后,番茄叶绿素A、植株地上生物量、根系生物量、株高、茎周长均显著升高,而枯萎高度占株高比例显著降低,因此,多粘类芽孢杆菌S960能促进番茄植株生长且对其枯萎病有一定的防治效果。林玲等[27]从马来西亚植物根际土壤中分离得到具有抑制水稻白叶枯病菌和油菜菌核病菌的芽孢杆菌,分别有解淀粉芽孢杆菌、短小芽孢杆菌、蜡样芽孢杆菌和苏云金芽孢杆菌。
短小芽孢杆菌在植物病害防治、微生态制剂等方面应用潜力巨大,逐渐成为近年来的研究热点[28]。曲发斌等[29]采用短小芽孢杆菌发酵液进行试验,发现NMCC46短小芽孢杆菌菌株对番茄种子萌发、根芽生长及幼苗株高和株重有明显的促进作用。Pandey等[30]发现短小芽孢杆菌BS-27和枯草芽孢杆菌BS-58的组合为提高苋菜的营养价值提供了天然和持久的潜力,对苋菜的生长起到的促进作用。李海薇等[31]发现短小芽孢杆菌菌株 KX-33具有耐盐碱性且能明显缩短棉花酶出芽时间,促进棉苗生长。Kaushal等[32]通过田间试验证实了短小芽孢杆菌YSPMK11的培养滤液对菌核病的体外生长有抑制作用,且具有较高的植物促生长特性,可作为取代花椰菜栽培系统中常用杀菌剂的有效生物防治剂。Padaria等[33]鉴定出短小芽孢杆菌 MTCC7615的吩嗪-1-羧酸基因(phc CD)对水稻纹枯病菌有拮抗作用。但有关短小芽孢杆菌产酸的报道比较少见,试验利用选择培养基分离到了具有产酸能力的短小芽孢杆菌BY-2073菌株。
SOD、CAT和POD是植物活性氧清除系统中重要的保护酶,它们能有效地阻止高浓度氧的快速积累,防止膜脂的过氧化作用,延缓植物的衰老,增强植物抗逆性[34]。张文平等[35]采用不同浓度乳酸菌胞外多糖对水稻种子进行萌发试验,发现水稻种子发芽率最高时,MDA含量明显下降,抗逆酶活性均有不同程度提高,缓解逆境胁迫伤害效果最为显著。蒋航等[36]采用外源褪黑素对As3+胁迫下的水稻种子进行萌发试验,结果表明当种子萌发率最高时,抗逆酶活性升高最为显著,且MDA含量随之降低。
试验也证实,经短小芽孢杆菌发酵液与水按比例稀释后处理的水稻种子萌发率均有提高,在种子萌发过程中SOD、CAT、POD活性亦有明显提高,其中以按1∶30比例稀释处理的水稻种子抗逆酶活性最为显著,且MDA含量最低,表示该处理条件下的种子在萌发过程中细胞膜受到的伤害最少。这与他人的试验结果相似,但试验中也发现,不经稀释的发酵液处理后水稻种子几乎无法萌发,这可能与该发酵液的pH为3.7左右有关,故测定的MDA含量较低,相关抗逆酶活性也较低。
怀宝东等[37]通过试验证明,在水稻栽培生产过程中开展生物有机肥和微生物菌剂的营养补偿措施,整合成减量高效施肥技术模式可达到提高肥料利用率,增加水稻产量的目的。
以上研究结果为在生产实践中进一步利用该菌株及其发酵液该菌株发酵液在水稻生物调酸中的应用提供了理论依据。为了更好地开发该菌株,今后还将进一步优化产酸芽孢杆菌的发酵条件,以降低成本及研发适合生产的生防制剂,进一步验证其田间效果。

