基于近红外免疫层析技术快速检测食源性甲型肝炎病毒
万晓楠,畅晓晖,齐玮,高欣,乔彬,杨向莹,李小林,张惠媛,石嵩,张捷*,周熙成
1(北京海关 技术中心,北京,100026)2(皇岗海关 机关服务分中心,广东 深圳,518000)
甲型肝炎病毒(hepatitis A virus, HAV)是人类病毒性疾病的重要病原体,它是一种无包膜的核糖核酸(RNA),属于小核糖核酸病毒科,通过人与人之间的接触或摄入受污染的水或食物感染健康人群。它广泛存在于自然界中,感染甲肝病毒的潜伏期可持续15~50 d[1]。据统计全世界约有130万人死于病毒性肝炎,其中甲型肝炎病毒急性感染约11 000例死亡、戊型肝炎病毒约44 000例死亡,两者均会引起肝炎和肝功能衰竭[2]。最常见的食物包括双壳软体动物贝类、各种鳞茎类蔬菜等易感染此类病毒而引发疾病,该病毒在冷藏食品也较常见[3]。
传统的甲型肝炎病毒检测方法耗时费力,无法快速有效地检测甲型肝炎病毒。比如细胞培养法,甲型肝炎病毒难以适应细胞,培养周期太长,因此无法进行检测。目前甲型肝炎病毒的检测方法主要包括分子生物学、DNA微阵列和电化学免疫传感器等。实验人员采用普通PCR法对甲肝病毒的目标基因进行特异性扩增,但对于给定的样品PCR无法定量负荷病毒,灵敏度不高,所以该法在检测中受限;荧光RT-PCR法,耗时较短价格相对便宜,在实验室中较为推广,但精细操作对实验人员技术要求较高,同时缺乏对甲肝病毒感染性的指征。近年来DNA微阵列可以替代PCR法,鉴定样品序列的单核苷酸多态性,但其价格昂贵,不适用于实验室常规检测[4-6]。电化学免疫传感器可以同时检测到不同的甲肝病毒抗原,灵敏度较高,但同样价格昂贵,需要大量的纳米金颗粒和蛋白A,步骤复杂从而增加检测成本[7]。因此为了进一步提高口岸检出进出境食品中甲型肝炎病毒的效率,本研究针对甲型肝炎病毒,采用近红外dylight 800荧光染料制备近红外免疫层析试纸条进行快速检测,可用于贝类等食品中甲肝病毒的高效检测,为进出口食品安全监管提供可靠的技术支持。
1 实验材料
1.1 病毒
甲肝病毒,由中国疾病预防控制中心病毒病预防控制所提供。
1.2 主要仪器与试剂
高速低温离心机,德国Sigma公司;超纯水仪,美国赛默飞公司;高压灭菌设备,江苏万创灭菌设备科技有限公司;近红外点荧光扫描仪,北京博润福得科技发展有限公司。
荧光染料dylight 800,美国赛默飞世尔公司;鼠抗甲肝病毒单克隆抗体(monoclonal antibody,McAb)、羊抗鸡免疫球蛋白,上海慧耘生物科技公司、羊抗甲肝病毒衣壳蛋白多克隆抗体,艾博抗Abcam公司;TaqDNA聚合酶、试剂盒,生物工程有限公司。
2 实验方法
2.1 近红外荧光染料标记甲肝病毒单克隆抗体
标记抗体的制备方法如下:
参照文献[22]所述方法,首先取100 μL磷酸盐缓冲液稀释好的鼠抗甲肝病毒单抗(质量浓度为1 mg/mL),然后加入dylight 800荧光染料涡旋混匀后于室温避光。1 h后加入100 μL磷酸盐缓冲液混匀,终质量浓度为0.5 mg/mL。
划膜抗体的制备方法如下:
参照文献[22]所述方法,用划膜液稀释羊抗甲肝病毒多抗1.5 mg/mL,最后将标记抗体放入磷酸盐缓冲液中,4 ℃透析过夜,回收抗体作为最终标记抗体。
2.2 甲肝病毒近红外免疫层析试纸条的制备
将样品垫、结合垫、抗体承载膜、吸水垫及反应支持基质按图1所示依次搭接,切割机将其切成试纸条。采用划线机,将划膜抗体(羊抗甲肝病毒多抗1.5 mg/mL)和羊抗鸡IgY多抗划在抗体承载膜上,分别作为检测线(T)和质控线(C),检测线、质控线间距0.5 cm,室温风干。
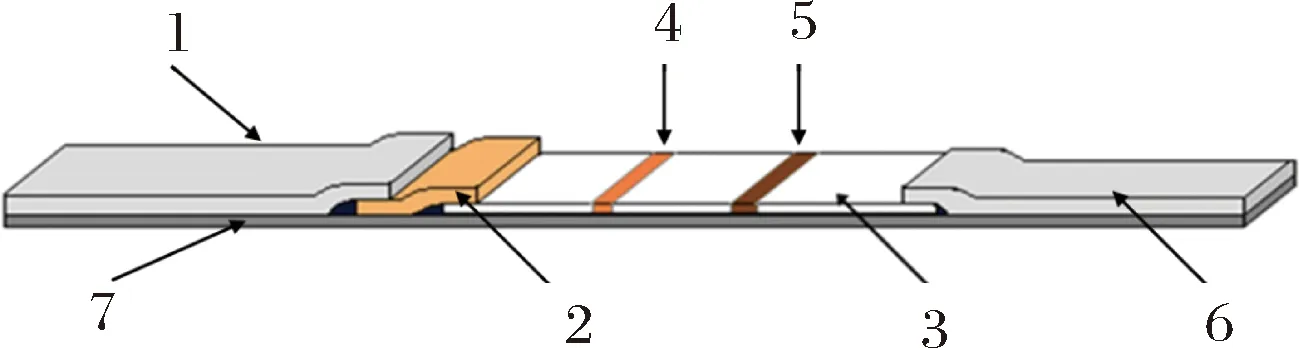
1-样品垫;2-结合垫(含有近红外荧光染料标记抗体的玻璃纤维素膜);3-硝酸纤维素膜(抗体承载膜);4-检测线;5-质控线;6-吸水垫;7-反应支持基质
2.3 定性检测
实验人员使用配制好的层析缓冲液分别稀释标记抗体(鼠抗甲肝病毒单抗)和羊抗鸡免疫球蛋白IgY(稀释比为1∶50、1∶2 000)(质量浓度0.5 mg/mL),鼠抗甲肝病毒单抗稀释液与羊抗鸡免疫球蛋白IgY 按1∶1比例涡旋混匀。随后在上述溶液中,滴加甲肝病毒稀释液(100 μL病毒稀释液+4 μL混合液)涡旋混匀,滴加至制备好的近红外免疫层析试纸条样品垫上,充分反应15 min后,采用便携式近红外荧光扫描仪检测。
2.4 定量检测
标准曲线绘制:用PBS稀释液(含5%BSA、0.1%Tween 20)将1 mg/mL的HAV抗原(HAV 抗原为猴肾细胞培养后的灭活全病毒)进行倍数系列稀释,分别按照表1,制成不同浓度的稀释样品;根据数学统计原理,绘制成标准工作曲线。每个稀释度样本平行测量2次,取平均值作为测量值,以该值对应的样品浓度作标准工作曲线。
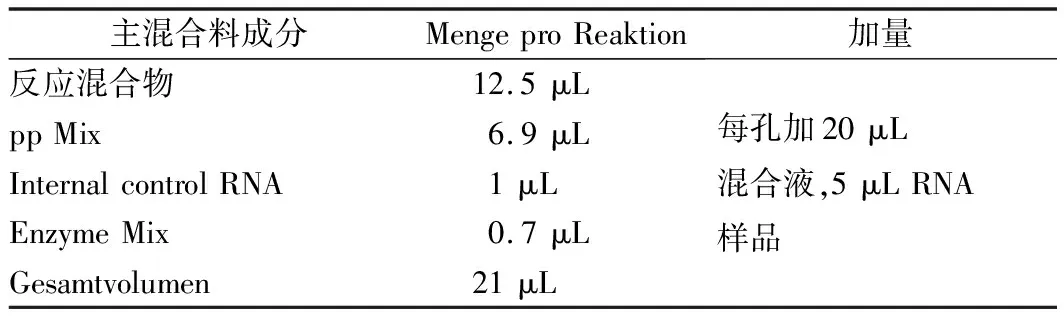
表1 甲肝病毒实时荧光PCR反应体系
2.5 特异性实验
在无菌条件下,将5种食源性病毒包括腺病毒、诺如病毒、轮状病毒Wa、轮状病毒SALL和肠道病毒71型(EV71)原液稀释,稀释液按3∶7体积比与4 μL制备好的层析混合液涡旋混合,随后滴加到样品垫上,室温放置15 min后,近红外荧光扫描仪检测近红外免疫层析试纸条。
3 评价方法
3.1 RT-PCR检测方法
贝类、海螺丝、蛏子等15份样品,均来自北京海关技术中心食品实验室。
贝类、海螺丝等前处理方法均按照国家标准[8]进行检测。
3.2 甲肝病毒实时荧光RT-PCR
引物序列如下所示:
正向引物5’-TTTCCGGAGCCCCTCTTG-3’,
反向引物5’-AAAGGGAAATTTAGCCTATAGCC-3’
探针序列5’-FAM-ACTTGATACCTCACCGCCG TTTGCCT-TAMRA-3’
采用甲肝病毒试剂盒试剂盒:sureFast Norovirus/Hepatitis A 3plex。
3.3 染毒实验组贝类样品的处理
用镊子等工具分别称取贝类、海螺丝、蛏子等样品(未检出甲肝病毒)各消化腺1g,用7 mL甘氨酸缓冲液(pH 9.6)用超声波方法对消化腺进行粉碎,并将上清液加入,进行样品浓缩。
3.4 用实际样品进行符合性评价
按照所建立的甲肝病毒近红外免疫层析法,对15份实际样品(北京海关技术中心食品实验室)进行检测,并将近红外检测结果与荧光RT-PCR法进行比较。
3.4.1 贝类样品甲肝病毒的富集
按照3.3建立的方法,15份贝类样品进行前处理后充分研磨。采用离心分离过滤膜过滤的方式形成待测物。
3.4.2 检测
来自实验室的15份贝类样品分别按照3∶7比例再加4 μL混合液滴加到近红外免疫试剂条样品垫上,分别做两个平行实验,室温反应15 min后用近红外荧光扫描仪检测。
4 结果分析
4.1 定性检测
根据2.3定性检测方法,发现若贝类、蛏子等食品样品中含有甲型肝炎病毒(目标病毒),目标病毒将与结合垫中的荧光标记单抗形成甲肝病毒抗原-抗体复合物。然后抗原抗体复合物通过毛细管作用移动至检测线,发生抗原抗体免疫反应,被它们各自的特异性多抗捕获。结果表明,若甲肝病毒近红外免疫层析试纸条质控线(T)区域不存在(未出现荧光发射峰),则认为该测试无效。若T线区域、C线区域同时出现荧光发射峰,则认为检测结果为阳性;若仅T线区域测试出现荧光发射峰则为阴性结果。

图2 甲肝病毒低噪声激发式荧光检测图
4.2 定量检测
按照2.4定量检测方法进行试验,用移液器加50 μL已知浓度的甲肝病毒至样品垫,待样品吸收后再滴加50 μL配制好的层析液,室温静置10 min。低噪声激发式荧光扫描仪检测甲肝病毒标准品,样品中的目标检测物甲肝病毒采用近红外光标记,甲肝病毒浓度通过反射光强度表征。扫描获得检测线(T)和质控线(C)的荧光峰值,若两者同时出现发射峰,则为阳性样品。将样品测试2次后取平均值,检测结果见表2。
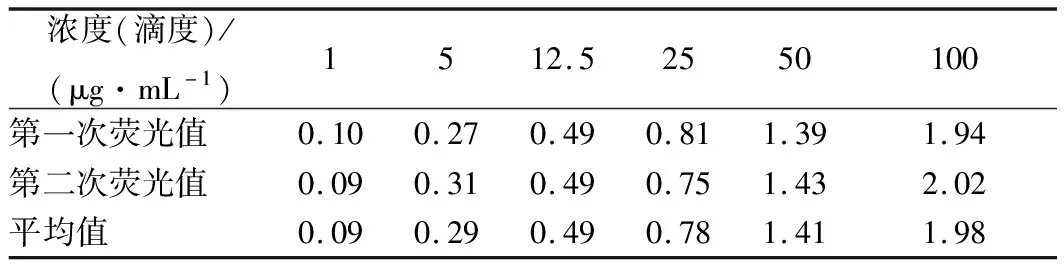
表2 不同质量浓度甲肝病毒标准品对应检测结果
以检测峰值对相应的样品质量浓度制作标准工作曲线,如图3所示得出计算公式Y=0.018 8x+0.232 5,R2=0.958 8。结果显示,甲肝病毒质量浓度在1~100 μg/mL时,荧光比值与质量浓度线性关系良好,即线性范围1~100 μg/mL。检测限为1 μg/mL。
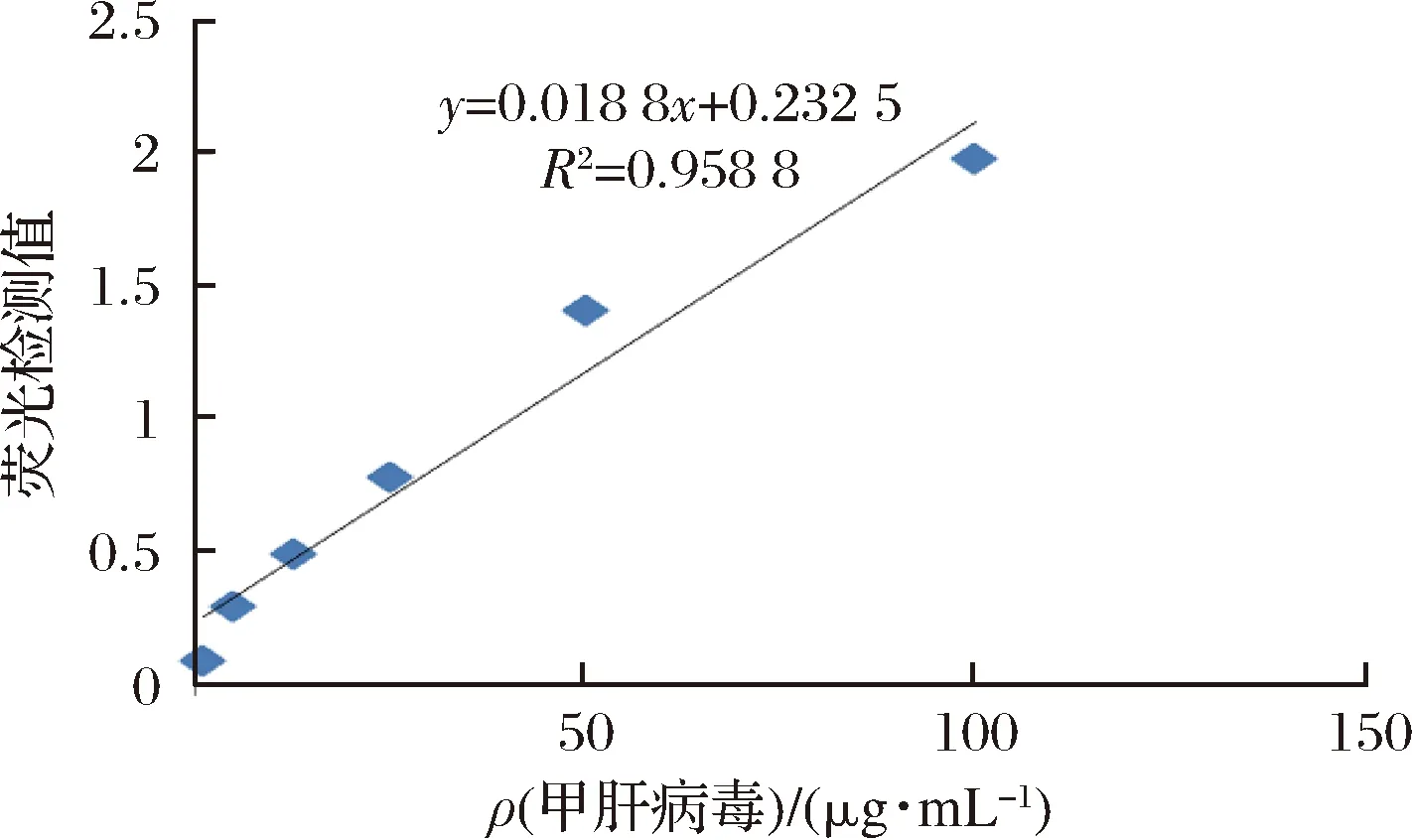
图3 甲肝病毒近红外免疫层析标准曲线
4.3 特异性实验
按照2.5实验方法将5种病毒包括诺如病毒、轮状病毒Wa病毒株(rotavrius strain Wa)、肠道病毒71型(EV71)等原液稀释后,分别滴加入甲肝病毒近红外免疫层析试纸条进行检测。仅甲肝病毒检测线区域和质控线区域出现荧光峰值,其余5种病毒均未出现检测线发射峰。由此可见本团队研制的甲肝病毒免疫层析试纸条与腺病毒、肠道病毒EV71、轮状病毒、诺如病毒等均无交叉反应。
4.4 近红外免疫层析法、荧光RT-PCR法比较
按照3.4实验方法对北京海关技术中心实验室15份贝类样品进行检测。检测结果发现15份贝类、蛏子等样品的近红外免疫层析法和荧光RT-PCR检测结果一致,结果均为阴性(如表3所示)。甲肝病毒近红外荧光法与荧光RT-PCR法的符合率达到100%。
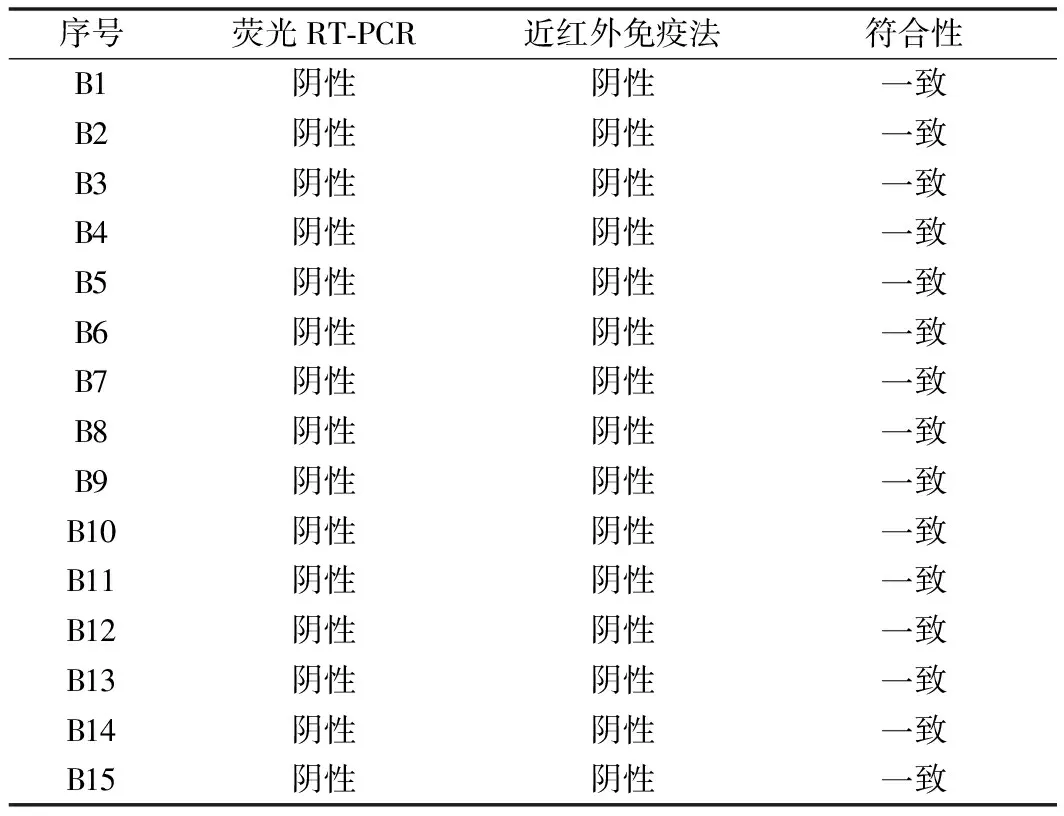
表3 本方法与荧光RT-PCR法比较
5 讨论
甲型肝炎病毒是一种正链RNA病毒,非细菌性肝炎的重要病原体[2],易被其感染的食物类别多为海鲜,包括贝类、蛏子、生的肉类等缺少热处理的食品[9-11]。研究发现,甲型肝炎病毒(HAV)感染通常是自限型的并且诱导永久的主动免疫。目前RT-PCR是最为通用、常见的检测法,但其检测特异性和灵敏性不是很高[12]。近年来,澳大利亚、美国、日本等检测食源性甲肝病毒,通常采用RT-PCR检测目标基因,可达到10~40 copy的病毒核酸。但由于食品种类繁多,成分较为复杂,大多会富含RT-PCR的抑制剂,灵敏度会很大程度地减低,因此该法存在一些局限性。20世纪90年代初期,研究人员采用斑点金免疫结合法进行甲肝病毒抗体的检测[13]。其优点是操作简单快捷,胶体金试剂保存时间长,但实验人员易将弱阳性标本误读,性价比和准确度不高。基因芯片检测法具有信息量大、高度平行化和集成化等特点,适用于各种病原体的筛查和诊断。目前基因芯片法需建立稳定的标准程序才能在病毒筛查和传染病的预防中广泛应用[14]。2014年乔煜婷等[15]将制备的特异性甲肝病毒免疫磁珠与SYBR-GREEN荧光定量技术联合使用成功检测了水体中的甲型肝炎病毒,该法主要适用于环境中甲肝病毒污染状况的评价。
近年来,近红外荧光免疫层析技术在医学诊断、环境微生物、生物物理学等各领域受到广泛关注[16-18]。近红外免疫层析技术是将近红外荧光与免疫层析技术相结合的一种新型侧向流技术,具有背景荧光低、检测信噪比高,检测灵敏度高的特点。2017年JIHANE等[19]通过将甲肝病毒HAV固定在碳纳米粉末糊状电极的表面上,开发了用于甲型肝炎病毒抗原(HAV)检测的间接竞争性电化学免疫传感器,具有良好的稳定性和高生物选择性,也成功应用于水样中HAV的测定,但检测成本昂贵,操作步骤繁琐,难以在实验室推广。本研究利用近红外染料标记抗体,依据双抗体夹心免疫层析原理制备甲肝病毒免疫层析试纸条,选用荧光探针Dyligh 800信噪比较高,灵敏度较高,生物基体极少在该区域自发荧光,使得背景荧光干扰较少。基于750 nm波长的荧光免疫层析试纸条对甲肝病毒的最低检测限为1 μg/mL。
2015年开始本团队采用近红外荧光染料dyllight 800作为标记,研制出一系列近红外荧光免疫层析试纸条检测食源性致病微生物, 检测对象包括沙门氏菌、副溶血弧菌、霍乱弧菌、诺如病毒等[20-23]。本研究将近红外荧光探针与免疫层析技术结合制备了甲肝病毒近红外免疫层析试纸条,该试纸条能够应用于进出口食品类样品中的甲肝病毒实时检测,具有结果准确、高效的特点,同时便于携带,能够为食品安全的监管、现场查验提供强有力的技术支撑。
致谢感谢中国疾病预防控制中心病毒病预防控制所张晓光老师研究团队和中国科学研究院理论物理所舒咬根研究团队对本研究的大力支持和帮助。

