过表达APE1对糖尿病心肌病小鼠心肌损伤的保护作用及机制的研究
吴浩翔,姜佳美,吴 铿
(广东医科大学附属医院 心血管内科,广东 湛江524001)
糖尿病是全球高发性疾病,其患病率正以惊人的速度增长。最近的预测表明,到2045年全球将有7亿成人患有糖尿病[1]。重要的是,糖尿病患者发生相关并发症的风险增加,包括肾病、神经病、视网膜疾病和心血管疾病[2]。尽管糖尿病导致心力衰竭的风险增加了五倍,但这不能完全归因于高血压和冠心病的存在[3]。实际上,糖尿病患者会发展出一种独特的心力衰竭,称为糖尿病性心肌病(DCM),其特征是在没有收缩功能障碍的情况下出现最初的舒张功能障碍[4]。尽管受到了广泛关注,但DCM的发病机制尚未完全明了[5],所以目前不存在DCM特异性的治疗措施。糖尿病环境引起心脏中几种细胞类型的改变,包括心肌细胞,心脏成纤维细胞,炎性细胞和内皮细胞。这些变化促进有害的心脏重塑,包括心脏肥大、心肌细胞凋亡和心肌纤维化。
近年来,氧化应激及其所致 DNA 损伤在 DCM 发病中的作用受到了越来越多的关注。研究发现,在DCM 动物模型中,血或尿ROS水平和DNA损伤标志物8-羟基-脱氧鸟苷(8-OHdG)显著升高,而且与DCM严重程度密切相关[6]。脱嘌呤/脱嘧啶核酸内切酶 1(APE1)是碱基切除修复途径(BER)的关键限速酶,同时也具有氧化还原功能[7]。本人所在课题组的前期研究发现:DCM患者血清中的APE1的表达显著增加,然而DNA核酸内切酶的活性却明显降低[5]。于此同时,课题组也指出需要进一步研究APE1的表达与DCM之间的直接联系,例如在DCM细胞水平和动物模型水平研究APE1的表达和功能[8]。在此之后,后续研究又发现了糖尿病(高糖)环境下心肌内皮细胞外泌体中APE1表达增加,活性降低,介导氧化应激、DNA损伤和细胞功能障碍,以此实现了细胞水平对APE1的验证[9]。以此为基础,为了探讨APE1在DCM 动物模型中的作用及机制,课题组设计并完成了本课题。本课题通过APE1对相关氧化应激因子和炎症因子的影响来探讨APE1对DCM小鼠心肌保护作用及其相应机制,为APE1在DCM的临床治疗中提供理论依据。
1 材料与方法
1.1 动物实验中所用的心肌特异性高表达APE1转基因小鼠来自于广东医科大学附属医院临床医学研究中心衰老相关心脑疾病重点实验室[10]。转基因小鼠以C57BL/6J (野生型)小鼠为遗传背景进行繁育。野生型小鼠购于赛业(广州)生物科技有限公司。实验动物的开展取得了广东医科大学实验动物伦理委员会批准。
1.2 药物与试剂STZ(纯度 99%)及测定ROS的试剂盒购自美国 Sigma 公司。SOD、MDA测定试剂盒购于南京建成生物制品有限公司。IL-1β、IL-6 、TNF-α及葡萄糖测定试剂盒均购买于北京莱尔生物科技有限公司。
1.3 仪器双目显微镜、荧光与相差显微镜(日本 Olympus)、全自动彩色病理图像分析系统、超速冷冻离心机、 荧光及紫外分光光度计(美国 PE)、超净工作台、MDF-3820 超低温冰箱(日本 Sanyo)。
1.4 方法
1.4.1造模和分组 APE1转基因PCR阳性雄性小鼠与其同窝雄性阴性对照小鼠经过1周适应性喂养。将60只小鼠随机分成4组:普通饲料喂养的阴性小鼠对照组(CON组)、普通饲料喂养的APE1转基因小鼠组(CON+APE1组)、高糖高脂饮食结合STZ的阴性小鼠对照组(DCM组)和高糖高脂饮食结合STZ的APE1转基因小鼠组(DCM +APE1组),每组各15只小鼠。DCM组和DCM+APE1组以高脂高糖饲料喂养8周后,禁食不禁水约12小时,腹腔注射STZ(30mg·kg-1)72 h,测随机血糖,选取血糖浓度> 11.1 mmol·L-1诊断为糖尿病小鼠。若未符合标准,再次重复上述操作,筛选出理想的DCM小鼠。CON组和CON+APE1组小鼠腹腔注射相应剂量的柠檬酸钠缓冲液。再培养8周后,取新鲜动物标本,置于-80℃冰箱保存。
1.4.2药物制备 冰上避光配制STZ,将其溶解于0.1 mmol·L-1的柠檬酸缓冲液中(pH=4.5)。
1.4.3分离血清测血糖 腹腔注射STZ(30 mg·kg-1)72 h后,提前给予小鼠禁食12 h,不禁水,用75%酒精擦拭小鼠尾端,尾静脉采血,血糖试纸沾取少许血液,血糖仪测量血糖。
1.4.4心肌细胞及间质的观测 在光学显微镜下,应用苏木精-伊红(HE)染色观察心肌细胞的形态及其心肌结构的改变;应用马松(Masson)染色观察心肌间质纤维化的程度。应用TUNEL染色观察心肌细胞的凋亡情况。
1.4.5酶联免疫吸附法(ELISA)检测小鼠心肌组织中炎症因子及氧化应激指标 在冰上取小鼠50 mg 心肌组织,用超声破碎仪磨成匀浆。按照试剂盒说明书,检测各组小鼠心肌组织中炎症因子IL-1β,IL-6,TNF-a 的含量和氧化应激因子ROS,MDA,SOD的活性指标。
1.4.6统计方法 采用SPSS 25.0 软件对数据进行统计分析。实验数据用均数±标准差表示。两组间比较用独立样本t检验(方差齐性数据);多组数据比较用方差分析(ANOVA),若ANOVA显示有统计学差异,则进一步组间两两比较,P<0.05 为差异具有统计学意义。
2 结果
2.1 各组小鼠体重和血糖分析
STZ(30 mg·kg-1)注射后72小时,DCM组及DCM+APE1组小鼠血糖水平升高,均高于11.1 mmol·L-1。与CON组及APE1组小鼠相比,DCM组及DCM+APE1组小鼠血糖水平具有统计学差异(P<0.05),而CON组与APE1组之间则差异不具有显著性(P>0.05),表明糖尿病小组模型造模成功。实验到达终点时,DCM组及DCM+APE1 的体重比CON组减低,血糖比CON组升高,差异具有显著性(P<0.05)。与DCM组比较,DCM+APE1组体重增加,并且DCM+APE1组血糖水平较DCM组降低,差异具有统计学意义(P<0.05),见表1。
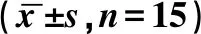
表1 小鼠体重及血糖变化
注:*P<0.05 与CON组比较;#P<0.05 与DCM组比较; DCM:糖尿病心肌组;CON:阴性对照组。
2.2 APE1 对DCM小鼠心肌细胞及心肌间质的影响
CON组小鼠心肌细胞形态正常,界限清楚。DCM组小鼠心肌细胞核呈现不规则形状、肿胀、固缩甚至消失,有核裂解和核丢失,排列疏松紊乱,界限模糊。细胞质呈颗粒状,分布不均,呈现炎细胞浸润。CON组小鼠心肌纤维排列整齐,无增粗,胶原纤维无明显沉积。DCM组小鼠心肌纤维排列紊乱,纤维粗大,胶原纤维沉积呈蓝染。DCM+APE组心肌纤维化明显降低,增粗蓝染的胶原纤维大幅减少(见图1,2)。
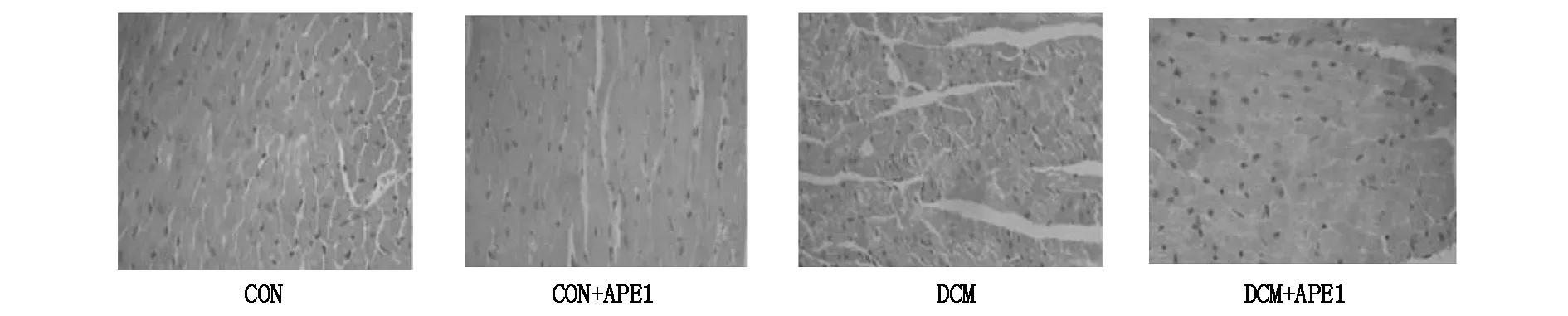
图1 各组小鼠心肌细胞及心肌间质HE染色
图2 各组小鼠心肌细胞及心肌间质Masson染色
2.3 APE1对DCM小鼠心肌细胞凋亡的影响
TUNEL染色用来分析心肌细胞的凋亡情况,可见CON组及CON+APE1组心肌凋亡细胞较少,DCM组心肌凋亡细胞明显增多。与DCM组相比,DCM+APE1组心肌凋亡细胞明显减少(见图3)。

图3 各组小鼠心肌细胞及心肌间质TUNEL染色
2.4 APE1对DCM 小鼠心肌组织匀浆中SOD,ROS水平的影响
与CON组比较,DCM组SOD活性明显降低(P<0.05),MDA和ROS含量明显升高(P<0.05);与DCM组相比,DCM+APE1组SOD活性明显升高(P<0.05),MDA和ROS含量明显降低(P<0.05)。见表2。
表2 各组小鼠心肌组织中SOD,MDA,ROS水平的影响
注:*P<0.05 与CON组比较;#P<0.05 与DCM组比较; DCM:糖尿病心肌组;CON:阴性对照组。
2.5 APE1对各组小鼠心肌组织中IL-6,IL-1β及TNF-α含量的影响
与CON组比较,DCM的IL-6、IL-1β和TNF-α含量明显增多(P<0.05)。与DCM组比较,DCM+APE1组IL-6、IL-1β和TNF-α含量减少(P<0.05)。见表3。
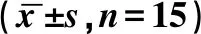
表3 各组小鼠心肌组织中IL-6,IL-1β,TNF-α水平的影响
注:*P<0.05 与CON组比较;#P<0.05 与DCM组比较; DCM:糖尿病心肌组;CON:阴性对照组。
3 讨论
DCM最早可追溯到1972年Rubler等人对四位患有充血性心衰但并没有发现冠状动脉病变的患者的报道[11]。DCM 患者心脏功能与心脏结构都发生变化,包括左心室肥大、心肌结构紊乱、心肌纤维化、心肌细胞凋亡等病理学特点。本课题通过高糖高脂饮食结合STZ腹腔注射的方式诱导DCM小鼠模型。与CON组相比,DCM组的小鼠血糖升高,体重下降,且具有统计学意义。HE 染色发现DCM小鼠心肌组织结构紊乱,心肌纤维排列无序;Masson 染色提示DCM小鼠心肌间质大量胶原累积;TUNEL 染色发现DCM小鼠心肌细胞凋亡数量明显升高。以上证据都证实了DCM小鼠发生了心脏结构和功能的变化,已成功诱导了DCM小鼠模型。
在糖尿病疾病状态下,为应对高血糖、高血脂、胰岛素缺乏或抵抗等代谢性应激或紊乱[12],心肌细胞产生大量活性氧,超过细胞内在的抗氧化能力,就产生了氧化应激,可直接或间接导致心肌细胞兴奋收缩偶联障碍、凋亡、坏死、纤维化、心肌肥大和炎症等[13]。ROS可引起核酸、蛋白质、脂肪酸和糖类等过氧化,诱导生成8-OHdG、蛋白质羰基化产物及丙二醛等有害的氧化产物,从而影响心肌细胞的正常结构与功能[14]。越来越多的研究表明,在糖尿病的前提下,心肌细胞ROS生成增多,ROS经过NF-Kβ磷酸化促进NLRP3炎症小体过度表达,NLRP3炎症小体通过促进心肌间质炎症反应异常激活,导致心肌细胞凋亡与心肌组织纤维化[15]。本研究发现,DCM组小鼠,ROS和MDA含量明显升高,并且炎症因子IL-6、IL-1β、TNF-α的含量水平也显著增高,说明DCM小鼠确实发生了氧化应激和炎症反应,与上文提及的文献报道相一致。
APE1是DNA氧化损伤中有碱基切除及修复功能的关键酶。在哺乳动物细胞中,大于99%的AP核酸内切酶的活性由APE1所承担。在过去的报道中,APE1与肿瘤的发生和预后紧密相关,也与冠心病、脑卒中等疾病的发生及发展关系密切[16,17]。因为APE1参与肿瘤耐药、放疗耐受、肿瘤血管形成等过程,所以APE1的高表达与肿瘤病人预后不良的程度呈正相关[18]。以往有报道称:糖尿病患者及具有如糖尿病肾病、糖尿病视网膜病变等并发症的糖尿病患者,氧化应激反应和DNA损伤程度有所增加,增加幅度与血糖的控制和疾病的预后有密切地联系[8,19]。但是,APE1在参与DCM心肌损伤的发生发展中是否有其特殊的作用还不明确。
针对上述问题,本课题组展开了一系列的研究。近期发现:①DCM患者血清APE1蛋白表达增加,其DNA修复功能降低,而且APE1 功能与患者心室舒张功能呈正相关关系[5]。②高糖诱发心肌细胞损伤,APE1蛋白及功能也有类似变化,经免疫沉淀和蛋白免疫印迹法验证为APE1蛋白发生乙酰化修饰[20,21]。③APE1野生型过表达心肌细胞,能明显抑制高糖引起心肌细胞毒性、ROS生成和DNA损伤。本研究在上述科研基础上开展了动物模型研究发现,相比于DCM小鼠,APE1过表达的DCM小鼠确实体重有所增加,FBG有所下降,抑制了心肌细胞肥大和凋亡及降低了心肌纤维化的程度。同时,SOD活性有所增强,MDA和ROS含量有所降低。组织中的诸如IL-1β、IL-6、TNF-α的含量也有所下降,且均具有统计学差异(P<0.05)。此结论与课题组前期在DCM患者和心肌细胞细胞水平的研究结果相一致,可以说从另一角度对课题组的结论得以补充说明。接下来可能需要进一步进行APE1抗氧化应激和抗炎作用更深层次的分子水平的研究。
综上所述,本研究通过制造动物模型探讨了APE1对DCM小鼠的心肌细胞损伤的保护作用,其机制与APE1的抗氧化应激和抗炎作用有关,这可为治疗和改善糖尿病心肌病提供一条新的思路。

