2D延迟增强磁共振成像预测外科治疗房颤转复疗效临床研究
王宪颖,邬晓臣,柯振武,殷小强,丁盛,刘敬臻,张近宝
心房纤颤(atrial fibrillation,AF)是风湿性心脏病患者最常见的心律失常,在瓣膜病变患者中发生率较高。AF 是脑卒中的主要危险因素,也是促进充血性心力衰竭的一个重要因素,目前射频、冷冻疗法等新能源组成迷宫Ⅳ操作成为AF 手术治疗的金标准[1]。AF 射频消融1年的窦性心律转换率在66%左右[2],仍有一部分AF 患者术后出现AF复发。左心房心肌纤维化是AF患者心房结构重构最突出的表现,是发生AF的结构基础[3]。左心房纤维化、心内膜低电压是AF严重程度和AF 消融术后复发的预测指标[4]。三维电解剖标测(three-dimensional electroanatomical mapping,CARTO)被认为可以通过对左心房心内膜电压进行标测进而明确左心房纤维化程度[5],但因其创伤较大,故在临床上无法广泛开 展。延 迟 增 强(late gadolinium enhancement,LGE)磁共振成像(magnetic resonance imaging,MRI)检查为无创检查,且无辐射,注射造影剂后心肌纤维化区域呈延迟强化显像[3]。本研究拟通过对瓣膜疾病合并AF 患者术前行2D LGE-MRI检测,以评估其在外科射频消融术后AF转复中的预测价值。
1 资料与方法
1.1 病例资料收集本院自2018年10 月至2019年1月拟行瓣膜置换或者瓣膜成形并行迷宫Ⅳ型手术的风湿性心脏病患者30例,男性18例,女性12例,年龄43~62岁(55±5.56)岁,6例合并高血压,5例合并糖尿病,7例有吸烟史,术前所有患者接受LGE-MRI。患者纳入标准:①经临床体检及心电图、心脏彩超检查,明确诊断为瓣膜病变合并持续性AF;②AF 持续时间>48 h,对药物的复律无反应;且既往无AF 消融术病史;③患者MRI扫描过程中可配合,图像无严重伪影。排除标准:①合并严重多器官功能衰竭;②心源性恶液质。临床资料见表1。本研究通过了西部战区总医院伦理委员会审查(2019ky85)。
1.2 MRI及图像分析MRI采用国内报道的方法[6],所有患者均在手术前24 h 内使用德国Siemens Magnetom Skyra 3.0 T MRI进行扫描。患者取仰卧位,采用呼吸道航、心电门控技术,对比剂经肘静脉注入,剂量为0.2 mmol/L,延迟10 ~20 min,期间多次扫描,患者平均扫描时间约为30 min。完成扫描后由2 名经验丰富的MRI诊断医师完成纤维化分级及左房前后径、左房长径及左房横径的图像测量[7](图1),并将分级结果与CARTO图像进行比较。具体操作如下:①首先用MRI基本阅片功能打开所有图像,胸壁皮下脂肪层信号与心腔内对比剂信号接近时为最佳时像,采用2D逐层分析图像。②本研究中左心房相邻2 层及2层以上均呈强化诊断为延迟强化信号。③左心房心肌纤维化分级标准如下:在MRI横轴位图像上将左心房划分出8个象限(图2),肺静脉作为前后分界,中线代表左右分界,二尖瓣作为上下界;0 级为无延迟强化的正常心肌,Ⅰ级为单一象限相邻2层及以上图像均存在强化信号,Ⅱ级为2 个象限产生强化;Ⅲ级为3个及以上象限产生强化。

表1患者临床资料(n=30)
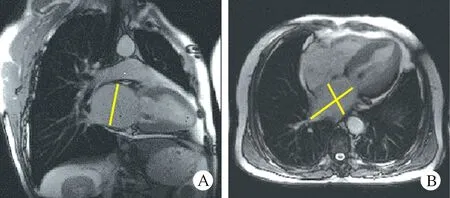
图1心脏收缩期图像测量左房长短和前后径
1.3 CARTO左心房电解剖图像所有患者均在MRI
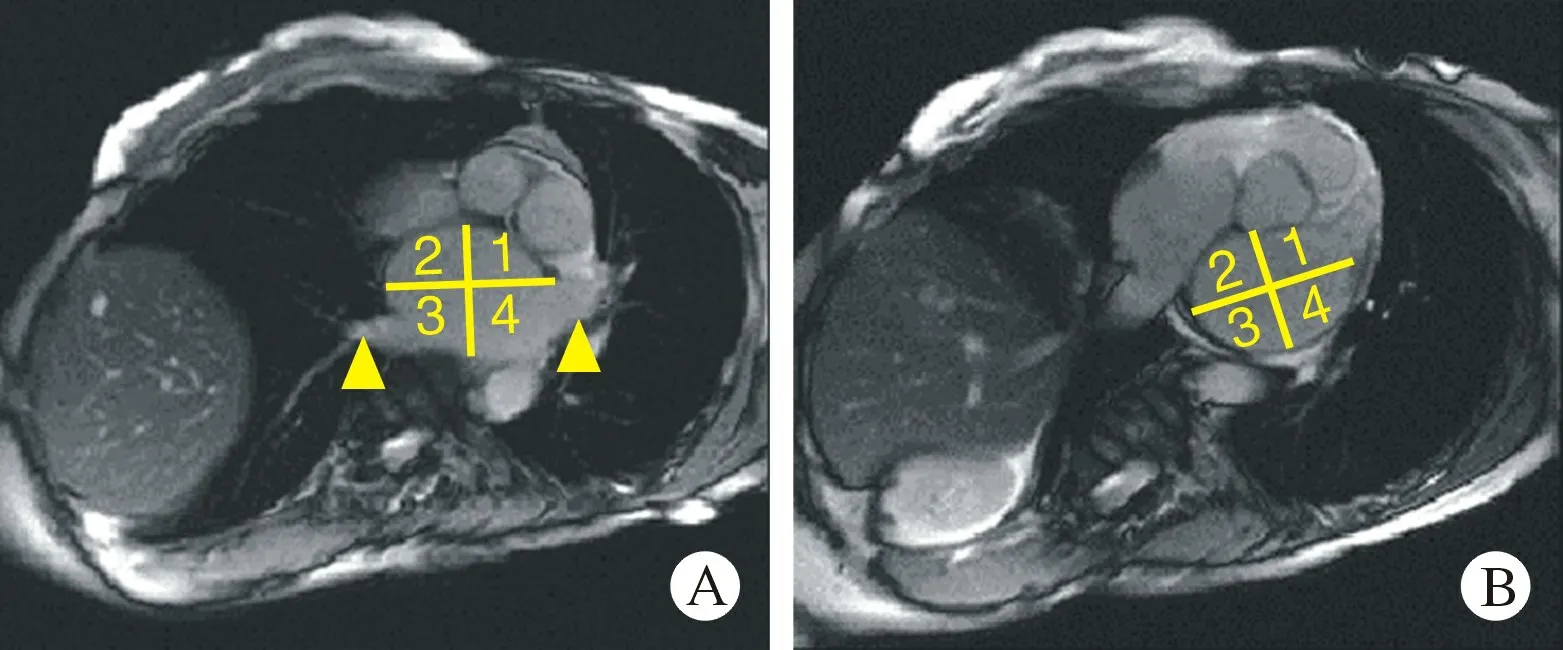
图2左心房LGE-MRI图像划分8个象限
检查后24 h 内进行CARTO操作。经股静脉穿刺跨过房间隔后,用CARTO系统行左房建模。本研究定义正常心内膜电压振幅>1.5 mv,CARTO图像显示为粉红色,“纤维化区域”心内膜低电压<0.5 mv[8]。根据CARTO图像结果及MRI所划定的8个象限。0级为正常,无低电压区;Ⅰ级为单个象限出现低电压区;Ⅱ级为2 个象限出现低电压区;Ⅲ级为3个及以上象限出现低电压区。
1.4 手术方法手术采用中低温体外循环。过程包括:①肺静脉隔离术:分离右肺静脉,行右侧肺静脉环状消融,切断Marshall韧带,分离左肺静脉,行左侧肺静脉环状消融。②左心房消融术:切开房间隔,行左侧与右侧肺静脉消融环连线消融,右下肺静脉至二尖瓣环消融,右上肺静脉至左上肺静脉消融,左上肺静脉至左心耳间消融。③右心房消融术:右心房切口到三尖瓣瓣环消融线;房间隔切口至冠状静脉窦消融线。射频消融完成后,将术前左房前后径大于45 mm的患者常规行左房折叠术,具体方法如下:缝合左心耳,折叠缝线依次经过二尖瓣后瓣及左下肺静脉口之间,左房,左右肺静脉之间,左房顶,最后回到左心耳。分别视情况进行二尖瓣置换、主动脉瓣置换。心脏复跳后静脉泵入胺碘酮,初始予以100 mg 原液静推,后以10 ml/(kg·min)维持,同时根据心率酌情调整。拔除气管插管后给予患者口服胺碘酮200 mg,每天2次,根据心率调整口服次数,持续服用至术后3个月[9]。
1.5 数据处理应用SPSS 22.0统计软件对数据进行分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差检验。计数资料用百分比表示,组间比较采用卡方检验。AF的复发因素如性别、年龄、AF病史、左心房前后径、四腔心切面左房横径、四腔心切面左房长径、体质量指数、糖尿病、高血压、吸烟,运用逐步Cox 回归模型分析术后与早期AF复发的关系,以上检验均以P<0.05作为有统计学意义。LGE-MRI左心房心肌纤维化和CARTO系统重建图像的分级采用Kappa 检验来评估两者一致性,Kappa>0.75为一致性好,0.40 ~0.75为一致性较好,<0.40为一致性差。
2 结果
2.1 CARTO与LGE-MRI对比结果30例患者行瓣膜置换或瓣膜成形并迷宫Ⅳ型手术,无围手术期死亡,无二次开胸探查,均在术前完成电解剖检测及LGE-MRI检测并分级,0 级共4例,Ⅰ级共10 例,Ⅱ级共10例,Ⅲ级共6例。CARTO分级0级共4例,Ⅰ级共9例,Ⅱ级共11例,Ⅲ级共6例。MRI纤维化分级正确25例,错误分级5例,LGE-MRI和CARTO图像分级间一致性较好(Kappa =0.77,P<0.01)(图3),左心房心肌纤维化分级及诊断准确率见表2,LGE-MRI分级总的诊断准确率为83.3%(25/30)。
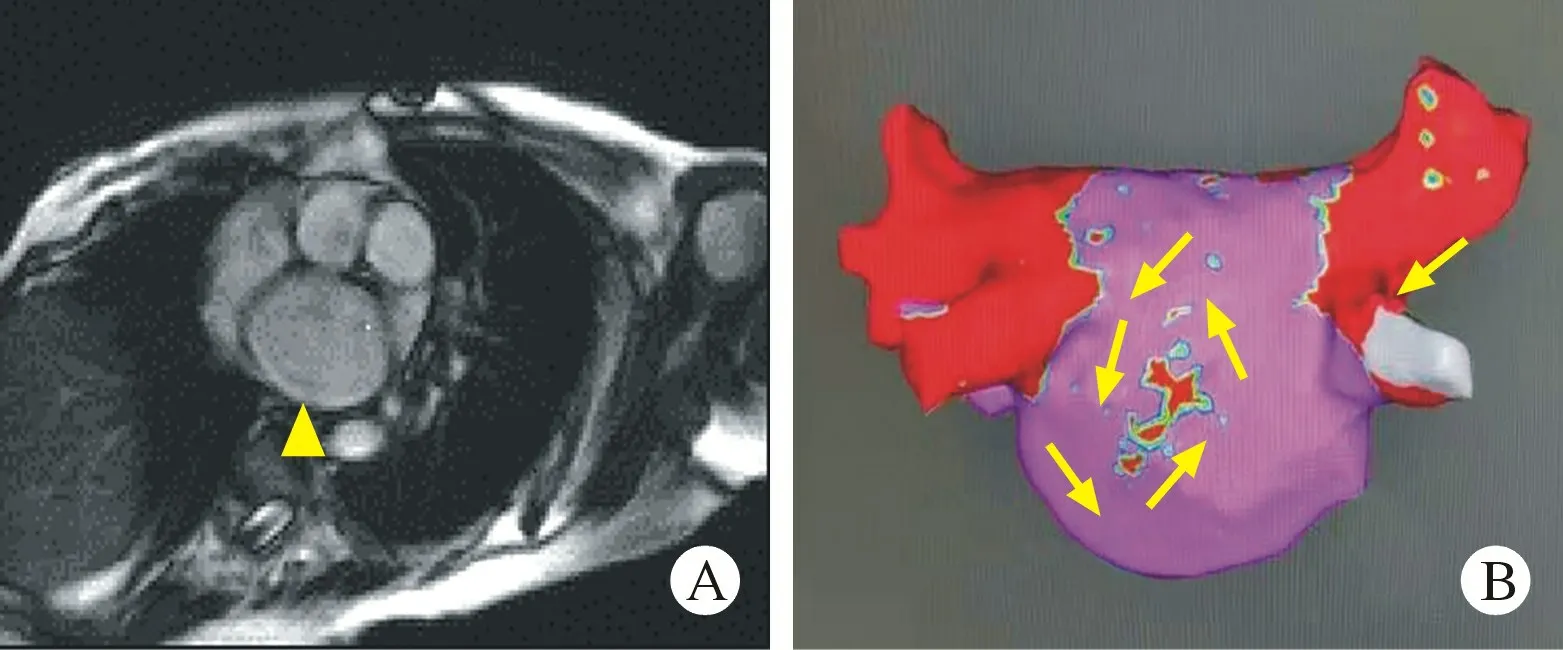
图3患者LGE-MRI 与CARTO图像示例
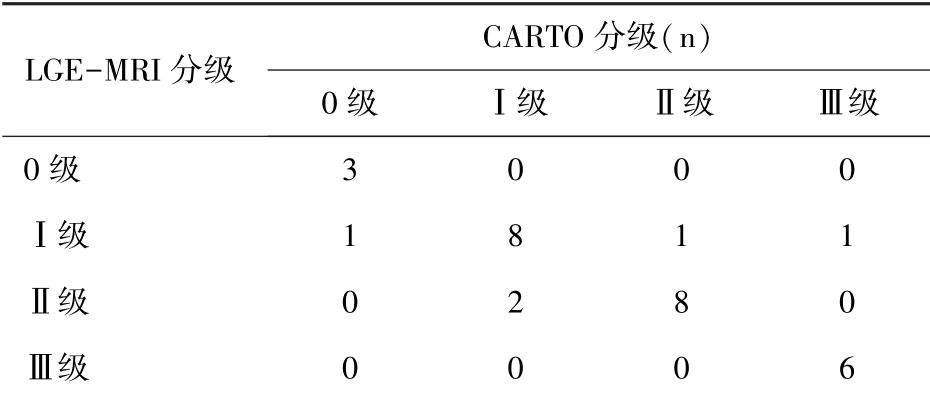
表2左心房心肌纤维化LGE-MRI分级及CARTO分级比较(n=30)
2.2 手术后患者AF 转复率30 个患者平均住院天数为(26±8.6)d,出院时窦性转复率为93.3%(28/30),术后半年复检窦性转复率为80%(24/30)。随访半年,术前LGE-MRI分级0级的患者未出现AF 复发(0%),Ⅰ级有1例出现AF复发(10%),Ⅱ级患者有2例AF 复发(20%),Ⅲ级患者有3例AF 复发(50%),有统计学意义(P<0.05)。
2.3 与术后AF 早期复发有关的监测指标结果提示术后AF复发病例数为6例,未复发的病例数为24 例,将患者术前临床检测指标纳入逐步Cox 回归模型,逐个分析术后AF早期复发与各临床特征之间的关系,显示术前MRI心房纤维化分级是预测术早期AF 复发有效指标,有统计学意义(P<0.05),其余临床特征对术后早期AF复发无统计学意义(均P>0.05),即心房纤维化为射频消融术后早期AF复发的独立影响因素。见表3。
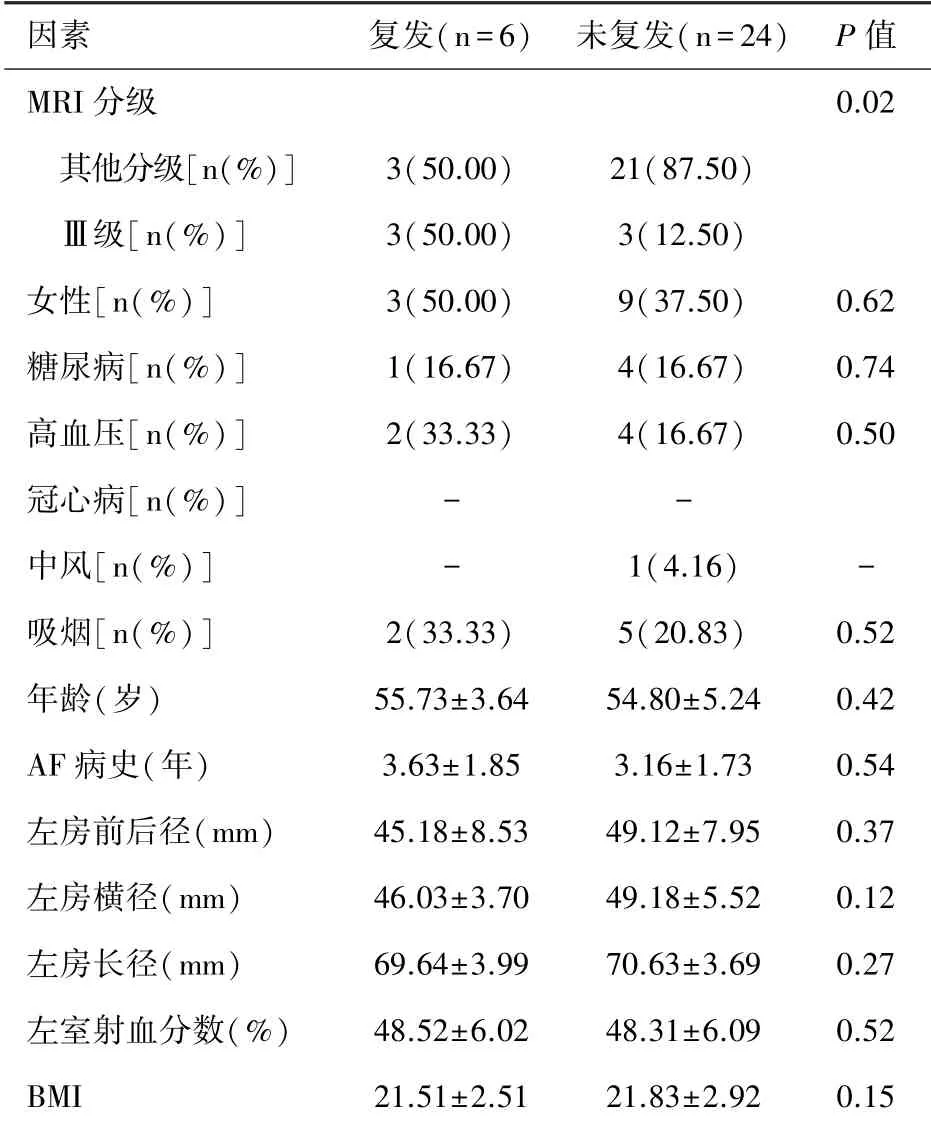
表3各临床特征与术后早期AF 复发的关系
2.4 手术前后左房前后径比较结果本组患者术后复查左房前后径(36.54±3.73)mm,术前左房前后径(48.41±8.08)mm,术后左房前后径平均减少25%(P<0.05)。
3 讨论
AF的主要治疗方式包括药物复律、电复律、介入手术、外科手术,不论是药物治疗还是手术治疗,均存在相当的复发率。因此研究如何提高AF 治疗的成功率、如何选择AF患者最佳的治疗策略及降低治疗后的复发率仍然值得人们不断探讨。本研究发现术前纤维化程度越高术后AF 复发率越大(0 级0%,Ⅰ级10%,Ⅱ级20%,Ⅲ级33%),多因素回归分析中纤维化程度又是AF 复发的独立预测因素,因此术前行LGE-MRI可能提供一种非入侵的方式评估术后复发情况。对于术前纤维化程度较轻的瓣膜病变患者,早期积极行射频消融术可能会得到良好的转归。对于术前纤维化程度较高的患者,术后AF复发概率也会相应偏高,因此LGE-MRI能够为AF患者提供个体化治疗。对于纤维化程度较高的这部分患者,应该进一步探究射频消融术对于这部分患者是否可行,或者继续探索其它有效的治疗方式[10]。
从目前国内外研究的报道来看,影响外科射频消融术效果的因素众多,如年龄、性别、AF病程、吸烟、BMI、左房前后径等,同时有关这些因素的观点也存在许多分歧,而左房前后径大小对AF术后复发的影响也被多项研究证实[11](即术前左房前后径越大,AF术后复发越高),而本研究的结果显示左房径大小与AF 术后复发无统计学意义。原因可能为:本组患者术后复查左房前后径与术前相比较显著缩小。由于手术过程中左房前后径大于45 mm均常规行改良左房折叠,术后左房前后径平均减少25%。同时,术后左房径的减小也与术后血流动力学改善有关。由于本研究样本量较小,笔者将在后续研究中对这一现象做出进一步探讨。
Mahnkopf[12]等第一次证实MRI对左心房心肌纤维化识别的可行性,并采用高分辨率LGE-MRI发现导管消融隔离肺静脉后左心房的瘢痕形态。本研究结果显示MRI和CARTO图像的分级一致性较好,准确率达到83.3%,与国内外相关研究结果相近[6,13]。对于MRI而言,除了有非侵入性及无辐射特点外,和CARTO比较,MRI具有高分辨对比能力,尤其在心血管方面具有识别心脏组织及了解心脏功能的能力。它对正常心房组织的评估更准确。在比较研究中[13],CATRO的制图研究具有高度的空间误差,这种误差从0.5 cm 到1.0 cm不等。相比之下,用LGE-MRI提供了更为准确的解剖学和病理位置信息。
本研究因样本量较小,尚有一定的局限性,且国内对于LGE-MRI心肌纤维化研究较少,心肌纤维化程度的分级方法尚无统一定论。因此需要一些大样本或多中心的临床试验证实该方法的可靠性,使之在临床实践中成为一种强烈的术前预测检查。此外本研究AF 复发的因素除了与术前纤维化程度有关,笔者认为还需要考虑可能与射频消融术后消融线不完整有关系,从而可以通过术后行3D LGEMRI进一步明确,同时通过导管介入的方式进一步完善消融线,但本研究为2D LGE-MRI,因此也无法全面、三维的观察消融瘢痕是否完整,后续研究中笔者将使用3D LGE-MRI进一步探讨。

