体外膜氧合辅助心肺复苏患者50例置管经验总结
苏用鹏,卢剑海,朱瑞秋,左六二
体外心肺复苏术(extracorporeal cardiopulmonary resuscitation,ECPR)是经积极传统心肺复苏(conventional cardiopulmonary resuscitation,CCPR)未能恢复有效自主循环的患者快速实施体外膜氧合(extracorporeal membrane oxygenation,ECMO),短时间替代心肺做功的高级生命支持技术[1]。改善难治性心脏骤停预后的关键因素是缩短机体低灌注的时间,而快速建立血管通路是建立ECMO支持的重要环节[2-3]。ECMO主要置管方式有改良式外科切开置管和B超引导下经皮穿刺置管两种方式。因此,对本院50例ECPR 患者置管方式进行总结,比较两种置管方式的效果及并发症,为置管方式的选择提供经验。
1 资料与方法
1.1 对象 回顾性分析2013年5月至2019年6 月期间南方医科大学顺德医院重症医学科50例经ECPR治疗难治性心脏骤停患者(难治性心脏骤停定义:经积极的CCPR 20 min未能恢复有效自主循环的心脏骤停[4])。所有病例均由本院重症科医师负责置管,院内或者外院能提供B超设备的情况下,根据置管的条件,如置管地方、是否具备彩超、血管情况等,首选穿刺置管,切开置管作为备选。若经多次穿刺未能成功置管,改局部切开,暴露并游离股动静脉,直视下置管。必要时胸外科医生予以支持。
1.2 方法
1.2.1 ECMO设备使用Medtronic或者Maquet 公司的离心泵、氧合器、体外循环导管及穿侧附件,动脉导管为15 ~17 Fr,静脉导管为19 ~21 Fr,下肢远端灌注导管为7 Fr。根据B超评估血管情况选择合适的导管型号。
1.2.2 改良式外科切开置管在腹股沟韧带中点下1 cm 做1个8~10 cm的纵切口,钝性分离皮肤和皮下组织,先找到股动脉及股浅动脉并游离,然后在股动脉内后侧方找到股静脉,游离股静脉。在股动、静脉表面预备穿刺处缝制荷包备用。穿刺针从股动、静脉表面所缝荷包中央处穿刺,见回血后置入导丝,在导丝引导下扩张血管,并置入动静脉导管,调整插管深度至合适位置后(动脉导管置入约20 cm,静脉导管置入到下腔静脉入口平面),收紧荷包缝线,检查渗血处,严密止血。动静脉导管与ECMO管路连接,实施ECMO支持。再在直视下运用Seldinger 方法于股浅动脉穿刺并置入远端灌注管,远端灌注作为旁路连接在股动脉导管,供应下肢血供。最后皮肤缝线固定插管。
1.2.3 B超引导下经皮穿刺置管B超引导下采用Seldinger 方法经皮穿刺置管方式。在同侧下肢先后置入远端灌注管、股动脉导管及股静脉导管或者在一侧下肢置入远端灌注及股动脉导管的同时,对侧下肢置入股静脉导管。穿刺置管的顺序为股浅动脉—股动脉—股静脉。B超引导下穿刺针置入血管后置入导丝,在导丝引导下扩张皮肤及血管,并置入远端灌注管、动静脉导管,调整插管深度至适宜位置后。动静脉导管与ECMO膜肺连接,实施ECMO支持。最后整理管道,局部皮肤固定。若多次穿刺失败,中转改切开置管,该例患者仍纳入在穿刺置管组对象作为分析,并记录总置管时间。
1.3 统计方法收集患者一般资料,基础疾病,两组患者的置管时间、置管成功率以及肢体并发症,后者包括置管部位出血、感染、缺血坏死。应用SPSS 19.0软件进行数据处理。定量参数用均数±标准差(±s)表示,比较用t检验。计数(定性)资料用率或构成比表示,比较采用卡方检验或Fisher 精确概率检验。P<0.05,差异有统计学意义。
2 结果
2.1 基本资料及建立地点50例实施ECPR 支持的患者中,切开组15例,穿刺组35例。两组患者在男性比例、年龄比较均无统计学差异。两组的主要基础疾病均为急性心肌梗死。建立ECMO主要地点:切开组为急诊科,穿刺组为重症医学科。见表1。
2.2 置管效果及肢体并发症比较切开组置管成功率为100%;穿刺组置管成功率77.1%,8例患者需要中转切开置管(t=4.082,P=0.043))。经皮穿刺组置管时间和切开组置管时间两组间无统计学差异(t=-1.124,P=0.267)。切开置管部位大出血1例,需要再次外科手术止血。穿刺置管组出现置管部位感染1例,下肢缺血坏死3例。见表2。
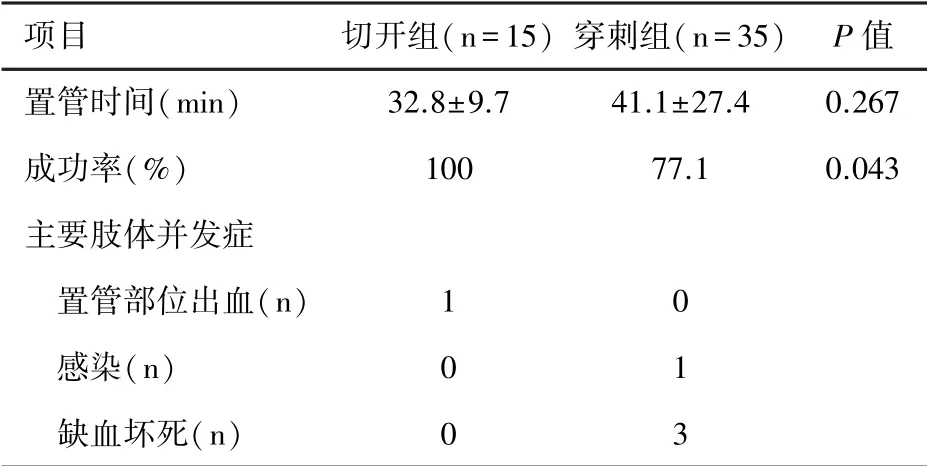
表2两组置管效果及肢体并发症比较
3 讨论
ECMO能为全身重要脏器提供氧供,并改善神经功能恢复,是难治性心脏骤停的有效治疗措施。2015年美国心脏学会在发布了心肺复苏指南,指出CCPR仅能为心脏和大脑分别提供10%~30%和30%~40%的氧供支持[1]。CCPR 持续时间超过10 min,患者的生存率即会下降,超过30 min,生存率下降更加明显,约7%~10.9%[5-6]。而随着ECPR 技术的不断发展和完善,ECPR 可以提高心肺复苏患者的生存率并促进其神经功能恢复,国际体外生命支持组织结果显示,ECPR 生存出院率可达到27.6%[7]。
建立ECMO的血管通路建议选择切开置管方式,能保证置管的成功率与效率。ECPR 的有效实施,必须建立在快速有效的ECMO置管的前提下。外周置管建立ECMO包括切开置管与经皮穿刺置管,由于置管医生职业背景差异,选择的置管方式不同。国内大型心脏中心通常由外科医生采取腹股沟区切开置管,而本院ICU医生职业背景多为内科医生,多选择经皮穿刺置管的方式。B超引导下经皮穿刺置管建立ECMO支持具有较多优点:①简单快速、易操作;②创伤小、置管部位出血少;③ICU医师经过培训可掌握,所以近年来越来越多ECMO中心采取床边B超引导下的穿刺置管术。而ECPR 时建立静脉-动脉ECMO或静脉-静脉ECMO则具有以下特点:①时间更紧迫;②建立地点复杂;③建立地点可能缺乏彩超的等设备;④同时实施胸外心脏按压;⑤动脉搏动消失;⑥大剂量血管收缩药物导致动脉过度收缩等,均增加经皮穿刺置管的难度。本院在建立ECMO支持的过程中,选择经皮穿刺置管仍有22.8%的失败率,考虑与以上因素有关。在遇到院内或者院外条件有限或患者心脏骤停难以判断动静脉的情况下,尤其是缺乏彩超设备时,仅能根据解剖位置进行穿刺,在反复的穿刺过程中容易误穿动静脉,穿刺置管的失败率较高。因此,在ECPR紧急置管时,推荐切开置管的方式,有助于保证置管成功率。本科室ICU团队中的置管组员均具备穿刺置管能力,其中两名ICU医师具有外科职业背景,通过不断的锻炼与总结,已能熟练掌握切开置管,并采取小切口等方式,有效减少创面及出血量。本中心经验,两种置管方式置管时间无统计学差异,提示切开置管效率不劣于穿刺置管。另外一项国外研究表明[8],与外科切开置管比较,经皮穿刺置管局部感染的发生率较低(16.5%vs.27.8%,P=0.001),但然而撤机时肢体并发症明显增多(14.7%vs.3.4%,P=0.001),主要为置管部位的持续出血,常需要外科干预止血,提示外科切开置管在减少撤机后肢体并发症方面有一定优势。
综上所述,与穿刺置管比较,切开置管时间相似,但成功率更高,可能更适合在ECPR 时建立血管通路。

