基于表型和SSR标记的金平草果遗传多样性分析
马孟莉 王田涛 雷 恩 孟衡玲 张 薇 张婷婷 卢丙越
(红河学院生命科学与技术学院/云南省高校滇南特色生物资源研究与利用重点实验室,661100,云南蒙自)
草果(Amomum tsao-koCrevost et Lemaire)是姜科豆蔻属(AmomumL.)多年生草本植物,全珠具有辛辣味,其果实是一种常用的中药,具有清湿化痰和温脾祛寒的功效,草果也是主要的调味品之一[1-2]。草果主要分布于我国云南、广西、贵州以及越南北部等地区,是热带、亚热带森林中一种重要的经济作物[3]。云南省是草果的主产区,产量和种植面积约占中国的95%。据2016年数据统计,云南省草果种植面积22.93万hm2,其中红河州6.93万hm2。红河州金平县因种植面积大且草果质量好,被称为“草果之乡”,种植历史有400余年[4]。
遗传多样性的研究对草果资源的保护和利用具有重要意义。表型性状具有易于识别和掌握、简单直观和快速等优点,被广泛应用于植物遗传多样性研究[5-8]。随着分子生物学技术的发展,DNA分子标记技术因其不受环境及发育阶段影响而被广泛用于遗传多样性研究。SSR分子标记具有重现性好、共显性、分布范围广的优点。从表型性状和分子水平两方面共同分析植物的遗传多样性,对其种质资源的利用与保护具有十分重要的意义。
作为中药和调味品的草果,之前的研究主要集中在精油提取、化学成分分析和药理作用等方面[9-11],而关于草果种质资源遗传多样性方面的研究报道较少,限制了草果优异种质筛选及育种利用。近年来,随着人们对草果资源鉴定及保护意识的加强,关于草果遗传多样性方面的研究逐渐增多。Zhang等[12]对云南省9个产区草果果实性状进行表型分析,结果表明,果实脊数、单果种子数和果实垂直直径的变异最大。谢正万等[13]利用12个草果单株对适用于草果遗传多样性分析的RAPD引物进行了筛选;Yang等[14]利用9对SSR标记初步分析了云南3个居群的60个草果样品的遗传多样性;胡一凡等[15]利用7对SSR引物对云南草果的遗传多样性进行了系统分析,结果表明,云南草果的遗传多样性水平较高,其中来自金平的JP1(10个样本)和JP2(10个样本)两个居群各项多样性参数均最高,遗传多样性最为丰富,这与金平县作为“草果之乡”,栽培草果历史悠久,是国内草果原产地之一的报道相符[4]。鉴于前人研究样本数量偏少且未对金平地区的草果进行表型分析,本研究利用13个表型性状和5对SSR分子标记对云南省草果主产区红河州金平县44份草果样本进行遗传多样性分析,以期为草果资源的保存和可持续利用提供理论依据。
1 材料与方法
1.1 样品采集与表型测定
试验于2016年在红河学院生命科学与技术学院进行。44个样本随机从2015年采自云南省金平县阿得博乡草果山(22°54′36″N,103°13′12″E)的152份草果样本中选取。根据前期实地调研,采样地草果种植历史悠久,种植面积大,类型丰富。因此,为保证样本的代表性,将植株形态、果实性状等作为参考依据,且样本之间的直线距离不小于50m,所有样本经红河学院云南省高校滇南特色生物资源研究与利用重点实验室的张薇副教授鉴定为姜科豆蔻属植物草果,标本存放于红河学院生命科学与技术学院。每个样本随机选择3个果穗,统计每个果穗上的小花数及挂果数,计算挂果率(每穗挂果数/每穗小花数)。每个样本随机选取10个果子用数显游标卡尺测量鲜果长、鲜果宽,用万分之一天平称量鲜果重,3次重复;果实置于100℃恒温烘箱中烘至恒重,每个样本选取10个干果分别用数显游标卡尺测量干果长、干果宽,用万分之一天平称量干果重、干果皮重和种子团重,并统计单果种子数,3次重复。在采样同时,收集每个样本幼嫩的叶片,置于含有硅胶的5mL离心管中,用于后续DNA的提取。
1.2 DNA提取和PCR扩增
采用CTAB法提取草果基因组DNA,并用NanoDrop 2000超微量分光光度计检测DNA浓度和质量,将不同草果样本基因组DNA稀释至20ng/μ L的工作溶液,并保存于4℃冰箱中备用。
5对SSR引物序列选自Yang等[14]的研究结果,引物序列见表1。10 μ L聚合酶链式反应(PCR)体系包含:1.0 μ L 模板 DNA(20ng/μ L)、0.8 μ L SSR 引物(0.2 μ mol/L)、0.8 μ L dNTPs(2.5mol/L)、1.2 μ L 10×PCR 缓冲液(含 Mg2+)、0.2 μ LTaqDNA 聚合酶(2.5U/μ L)、6 μ L ddH2O,反应体系所用试剂均购自北京庄盟国际生物基因科技有限公司。所有扩增均在PCR仪上进行。反应程序为95℃预变性5min;95℃ 30s,55℃~59℃ 30s,72℃ 30s,共 30 个循环;最后72℃延伸10min,4℃保温。扩增产物在8%非变性聚丙烯酰胺凝胶(丙烯酰胺∶甲叉双丙烯酰胺=19∶1)上分离,电泳结束后用1% AgNO3染色,待条带清晰后拍照保存。
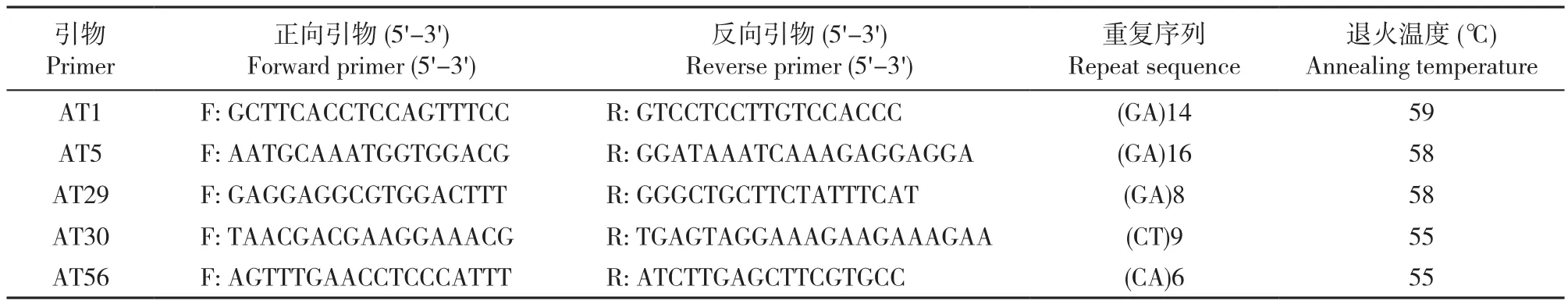
表1 SSR引物信息表Table 1 List of SSR markers used
1.3 数据分析
采用Excel 2016统计各性状数据,计算各性状的最小值、最大值、平均值、标准差、变异幅度和变异系数等基本统计参数。采用Shannon-Weaver多样性指数(H′)评价各性状的遗传多样性,H′=-Σ(Pi)(lnPi),Pi表示第i种变异类型出现的频率。利用SPSS 19.0软件对草果表型性状进行主成分分析。
根据PCR扩增结果,选择重复性好、谱带清晰的SSR标记记录。在相同迁移位置上有条带记为“1”,无条带记为“0”,缺失用“—”表示。利用最终获得的数据矩阵,用POPGENE 1.32软件包计算多态带百分比(PPB),观测等位基因数(Na),有效等位基因数(Ne),观测杂合度(Ho),期望杂合度(He)和 Shannon′s信息指数(I)。使用PowerMarker V3.25计算多态性信息含量(PIC)。参考Prevost等[16]的方法计算每对引物的解析度(Rp):Rp=ΣIb,其中条带信息Ib=1-(2×|0.5-p|),p指44个样本中含有该片段的频率。利用NTSYS-2.10e软件中的SIMQUAL模块计算样本之间的遗传相似性系数,采用非加权平均数法(UPGMA)进行样本聚类分析,获得树状图。
2 结果与分析
2.1 草果表型多样性分析
在13个数量性状中,挂果率、每穗花数、种子团重、干果长宽比和干果重的变异系数均在20.00%以上,其中挂果率的变异系数最大,变异系数为50.00%。鲜果宽的变异系数最小,为7.64%。13个性状的H′为1.74~2.16,其中鲜果长(2.16)、干果长宽比(2.07)、每穗花数(2.04)、单果种子数(2.03)、干果宽(2.01)和果皮重(2.00)的H′均在2.00以上,这些性状表型多样性水平较高(表2)。进一步通过主成分分析对13个性状进行降维,提取的前4个主成分累积贡献率达到81.615%(表3)。第1主成分贡献率为37.369%,主要为干果皮重、鲜果重、干果重、单果种子数、鲜果宽和干果宽等性状,其特征向量绝对值都在0.700以上,主要反映草果质量,与产量密切相关;第2主成分解释了总变异的25.049%,主要贡献来自干果长宽比、鲜果长宽比、干果长和鲜果长,这些性状与果实的形状有关,故第2主成分为果型因子;第3主成分和第4主成分的贡献率分别为12.152%和7.046%,第3主成分的贡献主要来自每穗花数,第4主成分的贡献则主要来自挂果率。

表2 草果数量性状多样性分析Table 2 Diversity analysis of quantitative traits of Amomum tsao-ko

表3 基于表型性状的草果主成分分析Table 3 Principal component analysis based on phenotypic traits of Amomum tsao-ko
2.2 草果SSR多样性分析
5对SSR引物在44个草果样本中共扩增出23个条带,多态带百分比为100%。其中AT29和AT30扩增条带数最多,AT56最少,平均每对引物可以扩增出4.6个多态性条带。所检测样本的Ne介于 1.646~4.418,平均为 3.410;Ho介于 0.150~0.731,平均为 0.491;He介于 0.398~0.789,平均为 0.679;I最高为 1.581,最低为 0.582;PIC 为 0.405~0.763,平均为0.672。这些参数说明金平草果具有较高的遗传多样性水平,其中AT29引物的解析度最大,对不同草果样本的区分能力最强(表4)。
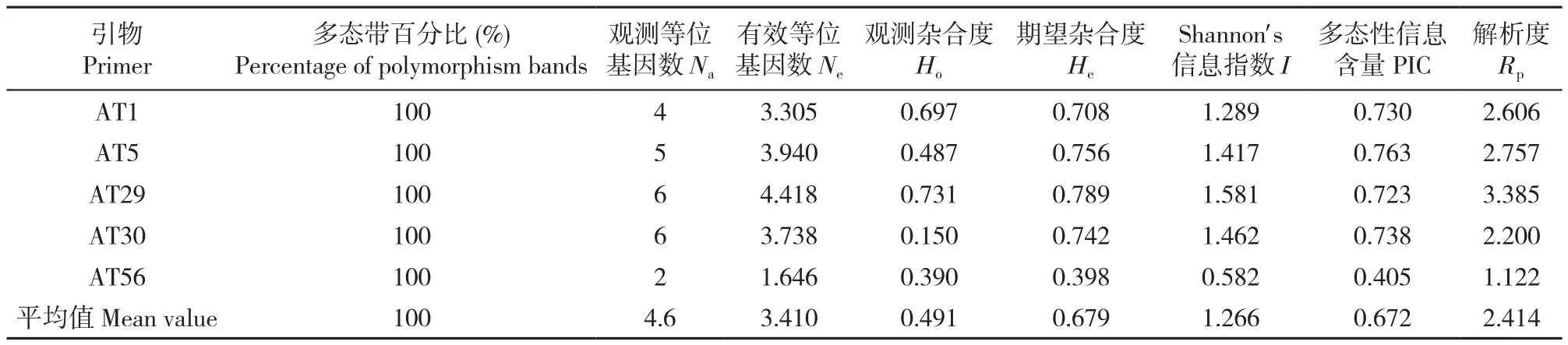
表4 草果SSR引物多态性分析Table 4 Polymorphism analysis of Amomum tsao-ko with SSR primers
2.3 基于SSR标记的聚类分析
基于SSR标记的草果样本间的遗传相似系数介于0.273~0.929。UPGMA聚类分析显示,在相似性系数0.60处可将44个样本分为2大类。类群I包括34个样本,类群II包括10个样本。以相似性系数0.619为阈值,类群I可进一步分为2个亚群,亚群IA由26个样本组成,亚群IB由8个样本组成,亚群IB又可分为2组(IB1和IB2)。以遗传相似系数0.662为阈值时,IA亚群可分为IA1(22个样本)和IA2(4个样本)2组,以遗传相似系数0.681为阈值时,IA1又进一步分为IA1a(11个样本)和IA1b(11个样本)2个亚组。类群II在相似性系数0.670处可分为2个亚群IIA和IIB。在IA1a中,J1、J7和J8以及J10和J23具有较高的相似性,IA1b亚组中的J15和J35也具有较高的遗传相似性(图1)。
3 讨论
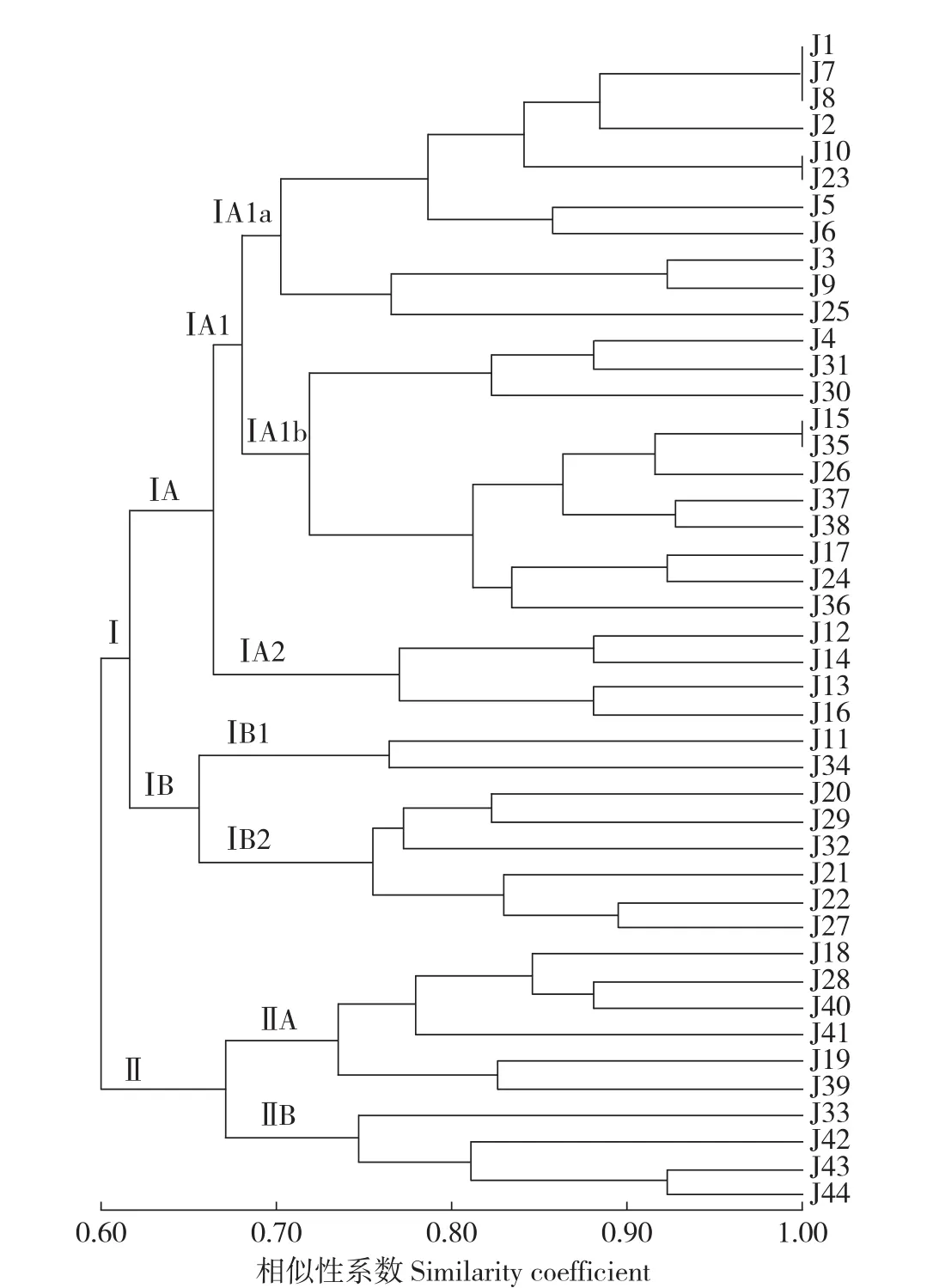
图1 基于SSR标记的44份草果样本的聚类图Fig.1 Cluster diagram of 44 Amomum tsao-ko individuals based SSR markers
所调查的草果表型中鲜果长和干果长宽比的H′最高,这2个性状与草果果实形状密切相关,说明草果在果实形状上具有丰富的类型,雷恩等[17]依据草果的果实形状和挥发气味将草果栽培种分为圆红辛辣型、圆黄苹果型、椭红辛辣型和梭红辛辣型,可见草果果实形状可作为区分不同草果类型的重要依据。在13个被测性状中挂果率的变异系数最大,为50.00%,表明草果挂果率在个体间差异明显,是影响产量稳定的重要因素,雷恩等[18]研究草果产量构成时也发现增加草果挂果率对稳定和提高草果植株产量具有重要的意义。主成分分析提取的前4个主成分可反映13个性状的大部分信息,贡献率分别占到37.369%、25.049%、12.152%和7.046%,累积贡献率达81.615%。在第1主成分中干果皮重、鲜果重、干果重、单果种子数、鲜果宽和干果宽等性状荷载值最高,且性状之间呈正相关关系,说明果实宽、单果种子数多的类型果实重量较大;第2主成分中干果长宽比、鲜果长宽比、干果长和鲜果长贡献最大,属于果型因子,该主成分中种子团重和干果重与干果宽等性状呈负相关关系,表明长果型草果果重偏低。挂果率是决定产量最重要的因素,但该性状与果实重、果实长和果实直径等与产量密切相关的性状呈负相关关系,在草果高产品种选育及栽培上要协调好这些性状之间的关系,通过优化各产量构成因素指标达到增产的目的。此外,草果精油及其成分是评价草果品质的重要方面,研究产量构成和精油含量及其成分之间的关系对高产优质草果种质(品种)的选育具有重要意义,是后续研究的重点。
本研究利用5对SSR引物对金平草果种质资源进行了遗传多样性分析。结果表明,这些样本具有较高的遗传多样性,Na=4.6、Ho=0.491和He=0.679,高于Yang等[14]利用SSR标记分析保山居群(Na=2、Ho=0.339、He=0.456)、法斗居群(Na=2、Ho=0.372、He=0.444)和马关居群(Na=2、Ho=0.250、He=0.432)的各项参数。胡一凡等[15]利用SSR标记分析云南不同产地草果遗传多样性得出,金平居群草果的遗传多样性水平最高,其中JP1 居群的Na、Ne、Ho、He和H(I)分 别 为 2.143、1.753、0.368、0.395和 0.603;JP2居群的分别为2.143、1.817、0.297、0.431和0.648,2个居群的各项遗传参数均低于本研究的结果,这与金平悠久的草果栽培历史,是我国草果原产地之一情况相一致。在本研究中,根据相似系数,44个草果样品被分为2个类群。类群Ⅰ为主类群,由34个草果样本组成,下面又由多个亚群组成,进一步说明金平草果类型丰富,多样性水平较高。
根据前人及本研究的结果可以判断金平县是我国草果的原产地。近年来,由于草果病虫害严重、加之草果栽培管理粗犷、产量易受环境条件影响等原因,导致部分农民放弃种植草果,严重威胁到草果遗传多样性的维持。鉴于金平草果丰富的多样性,系统收集金平范围内的草果种质,在当地建立草果种质资源圃,对草果资源保护和育种利用具有重要意义。
4 结论
通过13个数量性状指标和5对SSR标记分析金平草果遗传多样性水平,结果表明,金平草果具有丰富的表型变异和SSR标记多样性。13个数量性状的变异系数为7.64%~50.00%,H′为1.74~2.16;5对SSR标记在44个样本中共扩增出23个条带,多态位点百分率为100%,I和平均PIC分别为1.266和0.672;聚类分析将44个样本分为2大类,类群Ⅰ包括34个样本,类群Ⅱ包括10个样本。

