气调冷藏对牦牛肉保鲜效果的影响
亚本勤,熊伟,李根正,张龙翼,姜勇,罗张威,刘达玉
(1.新希望六和食品控股有限公司,四川 成都 610106;2.四川省农业科学院农产品加工研究所,四川 成都 610106;3.成都大学肉类加工四川省重点实验室,四川 成都 610106)
随着人们生活水平的不断提高,消费者对冷鲜肉的品质要求也越来越高。冷鲜肉以其肉嫩、味美、营养、卫生等特点,成为现代肉类消费的主流[1]。健康优良的肉原料、科学卫生的屠宰加工工艺、健全的冷链体系、有效的保鲜技术,是保证高质量的冷却肉不可缺少的各项重要环节[2]。然而,国内市场销售的牛肉多经散户或非正规屠宰场屠宰,屠宰设备落后,屠宰工艺不规范,而且在牛肉进入农贸市场销售时,不仅容易缩短牛肉货架期,而且会使其存在较大食用安全隐患[3-4]。
牦牛肉具有营养丰富、食用安全性高、污染小等特点,深受消费者喜爱[5]。但四川牦牛多生长于四川西部高原及山区偏远地区,储运及市场供给有诸多困难[6]。因此,建立适当的牦牛肉储运工艺,对延长牦牛肉的供给期和货架期,有极高的经济价值和意义。目前牛肉的储运多采用冷链物流的形式,但在冷链储运中零下低温会造成牛肉品质下降[7-8]。气调是一种通过调节和控制食品所处环境中的气体组成的保鲜方法[9]。气调保鲜过程中,氧气可维持肉的鲜红色,使肌红蛋白处于氧饱和状态,同时为嗜氧菌提供了良好的条件;CO2可有效延长微生物的迟滞期,抑制细菌、真菌的活性[10-11]。刘敬斌[12]研究了冰点温度时气调贮藏对牛肉的品质影响,结果发现 O2、CO2和 N2的体积比为 2∶50∶48 时,牛肉的保鲜效果最好。马骋等[13]研究了不同含氧量气调包装对牦牛背肌肉保鲜品质的影响,结果发现CO2和N2的体积比为6∶4 时,牦牛肉牛肉有较好的保鲜效果。为了建立适于牦牛肉的大型气调储运工艺,使冷链物流与气调储运结合,本文结合刘敬斌和马骋的研究结果,以冷却牦牛肉为原材料,研究不同气调条件下,牦牛肉在贮藏期的品质变化,以期为冷鲜牛肉的贮运保鲜和市场销售提供参考。
1 材料与方法
1.1 材料
牦牛:四川西部高原地区;宰后24 h 内的排酸牦牛肉:在新希望六和食品控股有限公司生产线采样;3.4 m×3 m×2.7 m 气调冷库:四川省农业科学院农产品加工研究所提供,由烟台意塞奥气调设备有限公司建设;超纯水:成都大学肉类加工四川省重点实验室制备;试剂均为分析纯。
1.2 试验方法
1.2.1 气调贮藏的气体组合
选择 O2范围在 15 %~75 %,CO2范围在 15 %~75 %,N2为10%。具体组合见表1。

表1 气调贮藏的气体组合Table 1 Gas combination of modified atmosphere storage
1.2.2 气调处理
试验前所用与肉块接触的工器具用75%的酒精喷洒消毒,紫外灭菌30 min。宰后冷却至中心温度为25 ℃的原料牛肉,在无菌试验条件下,修去筋腱、软硬骨、淤血、浮毛、外来杂质,按照肌纤维方向将肉切成5 kg 左右的肉块,放入气调库中,按表1 比例充气。定期(0、3、7、12、18、25 d)取样检测指标。
1.2.3 保鲜效果测试
失重率:使用LE104E/02 分析天平称量已分割规整的新鲜牛肉质量,记录为ma,g;牛肉按组合气调处理后取出称量质量,记录为mb,g。失重率计算方式如式1。
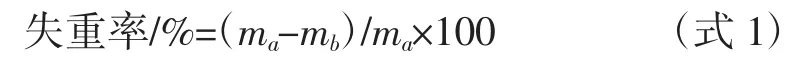
注:失重率小于5%,汁液损失较小,牛肉品质完好;失重率大于5%小于10%,汁液有一定的损失,牛肉品质被一定程度破坏;失重率大于10%,汁液损失严重,牛肉品质破环程度较大。
pH 值:参照GB 5009.237-2016《食品安全国家标准食品pH 值的测定》测定[14]。
挥发性盐基氮:参照GB 5009.228-2016《食品安全国家标准食品中挥发性盐基氮的测定》测定[15]。
菌落总数:参照GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》测定[16]。
1.2.4 数据处理
采用Excel 2016 进行数据记录与处理。
2 结果与分析
2.1 气调贮藏对牛肉失重率的影响
不同气调比例对不同贮藏期牛肉的失重率影响见表2。
表2 中数据显示,随着贮藏期的增加,A、B、C、D组气体组合保藏的牛肉失重率随着保藏天数增加均有一定增加。以失重率5%、10%为临界点评价牛肉汁液损失程度和牛肉品质好坏。当牛肉贮藏7 d 时,气调A、B、C、D 组失重率均小于 5%;贮藏 12 d 时,仅有 A组失重率小于5%,B、C、D 组失重率均在5%~10%之间;贮藏 18 d,A、C、D 组失重率在 5%~10%之间,B 组失重率已超 10%。贮藏 25d,A、B、C、D 组的牛肉均大于10%。

表2 气调贮藏对牦牛肉失重率的影响Table 2 Effect of modified atmosphere storage on the weight loss rate of yak meat
由此可见,A 组牛肉气调贮藏12 d 能保持汁液损失较小,牛肉品质完好,且18 d 还能保持良好水分。C、D 组牛肉气调贮藏7 d 能保持汁液损失较小,牛肉品质完好,且18d 还能保持良好水分,整体贮藏保鲜效果C 组优于D 组。B 组牛肉气调贮藏7 d 能保持汁液损失较小,牛肉品质完好,但12 d 后汁液损失就较为严重。综合比较,以损失率为评价指标,气调贮藏保鲜效果 A 组>C 组>D 组>B 组。牛肉在低温贮藏期有一定的质量损失,可能是脂肪氧化、微生物生长产气、低温肌肉细胞破坏以及肌纤维间的水分流出等原因造成的。脂肪氧化、微生物生长与氧气含量有关,油脂氧化产生醛类等挥发性物质从而使牛肉失重[17],当气体组分中氧气含量较低时,脂肪氧化减缓,失重率较低[18];微生微生物生长会产生CO2等气体,从而使牛肉失重,高氧和低氧都能抑制微生物生长,这可能是引起失重差异的原因[19]。
2.2 气调贮藏对牛肉pH值的影响
不同气调比例对不同贮藏期牛肉的pH 值影响见表3。

表3 气调贮藏对牦牛肉pH 的影响Table 3 Effect of modified atmosphere storage on pH of yak meat
续表3 气调贮藏对牦牛肉pH 的影响Continue table 3 Effect of modified atmosphere storage on pH of yak meat
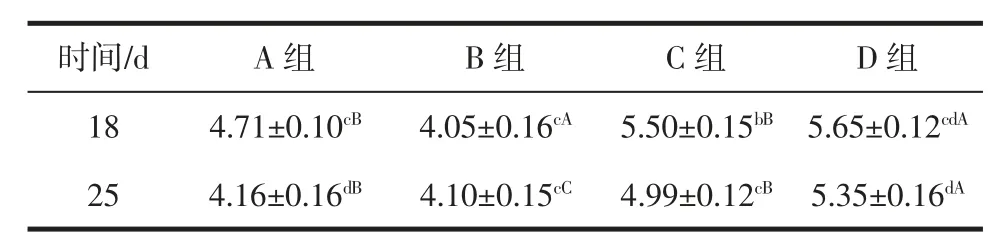
由表3 中数据显示,随着贮藏期的增加,气调A组牛肉 pH 值呈下降趋势,B、C、D 组牛肉 pH 值呈先上升后下降趋势。当牛肉在A 组气调条件下贮藏0~3 d时,pH 值无显著变化;贮藏7 d,pH 值略有下降;贮藏12 d 后较 0~3 d,牛肉 pH 显著下降(P<0.05),且 pH<5。当牛肉在B 组气调条件下贮藏0~3 d 时,pH 值无显著变化;贮藏 7 d,pH 值显著上升(P<0.05);贮藏 12 d 后,pH 值显著下降(P<0.05),且 pH<5。当牛肉在 C 组气调条件下贮藏0~3 d 时,pH 值无显著变化;贮藏7 d,pH值显著下降(P<0.05),且7d~18d pH 值无显著差异。当牛肉在D 组气调条件下贮藏0~3 d 时,pH 值显著上升(P<0.05);贮藏 3 d~7 d,pH 值无显著变化;贮藏 12 d后,pH 值显著下降(P<0.05),但贮藏 25 d,牛肉 pH 值还保持在5.00 以上。
产生这种变化的原因是当牛屠宰后,肌肉仍然进行着新陈代谢,糖原在缺氧条件下酵解,生成乳酸,pH值迅速降低。随着冷藏时间的延长,蛋白质也开始分解,产生碱性物质,最终使pH 值上升。此外贮藏气调气体成分二氧化碳溶解在牛肉中也会影响牛肉pH 值的测定[20]。牛肉贮藏期间,pH 值受到肉质本身因素及微生物的影响有所变化,可以间接考察牛肉品质的变化情况。由于肉类在低pH 值得情况下能较好的保持新鲜感,在pH 值为5.45~6.0 之间都能有较好的品质,因此不能单纯以pH 值得变化来确定牛肉保鲜效果的优劣。相对比来看氧浓度高的要比氧浓度低的pH 值控制要差一点。
2.3 气调贮藏对牛肉挥发性盐基氮含量的影响
不同气调比例对不同贮藏期牛肉的挥发性盐基氮含量影响见表4。
表4 中数据显示,随着贮藏期的增加,气调A、B、C、D 组牛肉挥发性氨基氮含量均有增加趋势。气调A组牛肉贮藏3 d 后挥发性盐基氮含量开始增加;3 d~7 d挥发性盐基氮含量继续增加,但增加量不显著,且贮藏7 d 时小于 10 mg/100 g;贮藏 12 d~25 d,牛肉挥发性盐基氮含量,增加趋势显著(P<0.05),但贮藏 25 d 时小于20 mg/100 g。气调B 组牛肉贮藏3 d 后挥发性盐基氮含量开始增加;3 d~7 d 挥发性盐基氮含量继续增加,但增加量不显著,且贮藏7 d 时小于10 mg/100 g;贮藏 12 d 时,显著增加到(17.68±0.36)mg/100 g;贮藏18 d 后,挥发性盐基氮含量已超20 mg/100 g。气调C组牛肉贮藏3 d 后挥发性盐基氮含量开始增加;3 d~7 d 挥发性盐基氮含量继续增加,但增加量不显著,且贮藏 7 d 时小于 10 mg/100 g;贮藏 12 d~18 d,挥发性盐基氮含量已超过10 mg/100 g 但小于20 mg/100 g;贮藏25 d 后,挥发性盐基氮含量大于20 mg/100 g。气调D 组牛肉贮藏0~3 d 挥发性盐基氮含量无显著变化;贮藏7 d~18 d,挥发性盐基氮含量已超过10 mg/100 g但小于20 mg/100 g;贮藏25 d 后,挥发性盐基氮含量大于20 mg/100 g。
以挥发性盐基氮含量10、20 mg/100 g 为临界点,评价牛肉新鲜程度。小于10 mg/100 g 表示牛肉比较新鲜;10 mg/100 g~20 mg/100 g 牛肉有一定程度上的腐败,但腐败程度较小;大于20 mg/100 g 表示牛肉已严重腐败。由此可以看出,A、B、C 气调条件均适合牛肉短期贮藏保鲜。以同等贮藏天数综合比较A、B、C 气调条件的保鲜效果,A 组优于C 组优于B 组。
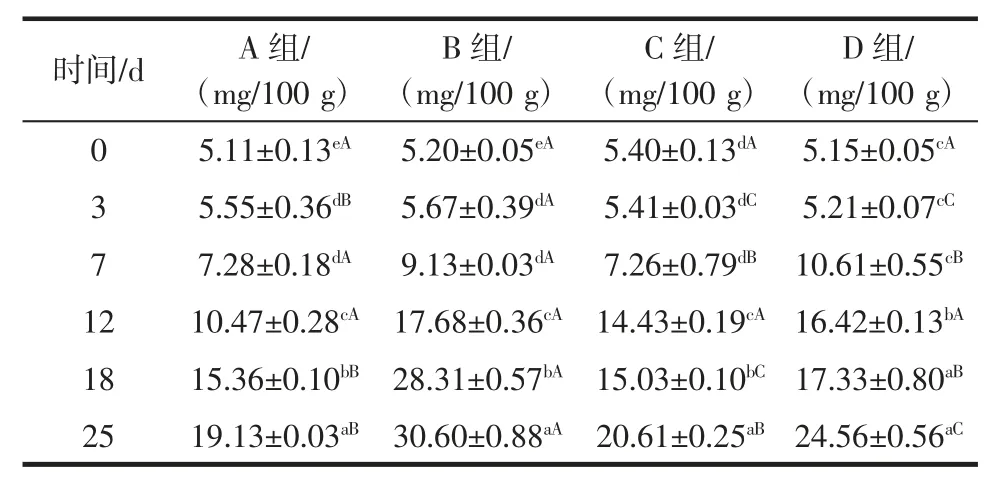
表4 气调贮藏对牦牛肉挥发性盐基氮含量的影响Table 4 Effect of modified atmosphere storage on nitrogen content of yak meat volatile base

表5 气调贮藏对牦牛肉菌落总数的影响Table 5 Effect of modified atmosphere storage on the total number of yak meat colonies
2.4 气调贮藏对牛肉菌落总数的影响
不同气调比例对不同贮藏期牛肉菌落总数影响如表5。
由表5 中数据显示,随着贮藏期的增加,气调A、B、C、D 组牛肉挥菌落总数均有增加趋势。气调A 组牛肉贮藏 3 d 后菌落总数显著增加(P<0.05);3 d~7 d菌落总数继续增加,但增加量不显著,且贮藏7 d时小于4 log10 CFU/g;贮藏12 d~18 d,牛肉菌落总数为4 到 6 log10 CFU/g 间;贮藏 25 d 后,菌落总数大于6 log10 CFU/g。气调B 组牛肉贮藏3 d 时,牛肉总数已显著增加(P<0.05),此时菌落总数已大于4 log10 CFU/g;贮藏 3 d~18 d,菌落总数为 4 到 6 log10 CFU/g 间;贮藏25 d 后,菌落总数大于6 log10 CFU/g。气调C 组牛肉贮藏0~7 d,牛肉菌落总数无显著差异,且在牛肉贮藏7 d 时菌落总数小于 4 log10 CFU/g;贮藏 12 d~18 d,牛肉菌落总数显著增加(P<0.05),18 d 时菌落总数小于6 log 10 CFU/g;25 d 后菌落总数大于6 log10 CFU/g。气调D 组牛肉贮藏0~7 d,牛肉菌落总数无显著差异,且在牛肉贮藏7 d 时菌落总数小于4 log10 CFU/g;贮藏12 d~25 d,牛肉菌落总数显著增加(P<0.05),25 d 时菌落总数小于6 log10 CFU/g。
以菌落总数4 log10 CFU/g、6 log10 CFU/g 为临界点评价牛肉腐败程度。小于4 log10 CFU/g 表示牛肉极为新;4 log10 CFU/g~6 log10 CFU/g 为次鲜肉;大于6 log10 CFU/g 为腐败肉。由此可见,牛肉在气调A、C、D组条件下贮藏7 d 均能保持牛肉的新鲜程度,但次鲜肉D 组更具有贮藏优势。气调B 组条件不适宜贮藏牛肉,在此环境下,牛肉中的微生物极易生长。气调包装具有明显的抑菌效果,其中气体配比为60%氧,20%二氧化碳、20%氮气效果最佳。20%二氧化碳就起到一定的抑菌作用,当二氧化碳低于40%时,其抑菌能力随着浓度的增加而增大,但二氧化碳高于40%时其抑菌效果就没有显著的增加,相反随着氧含量的增加,肉样的腐败过程加剧。
2.5 气调贮藏对保鲜期的影响
气调贮藏对牛肉保鲜期的影响如表6。

表6 气调贮藏对牦牛肉保鲜期的影响Table 6 Effect of modified atmosphere storage on yak meat preservation period
表6 中数据显示,以失重率为评价指标,A 组气调贮藏12 d 能保持牛肉新鲜,12 d~18 d 牛肉为次鲜肉,25 d 后变质;B 组气调贮藏 7 d 能保持牛肉新鲜,7d~12 d 牛肉为次鲜肉,18 d 后变质;C 组气调贮藏 7 d 能保持牛肉新鲜,7 d~18 d 牛肉为次鲜肉,25 d 后变质;D 组气调贮藏7 d 能保持牛肉新鲜,7 d~18 d 牛肉为次鲜肉,25 d 后变质。以挥发性盐基氮含量为评价指标,A 组气调贮藏 7 d 能保持牛肉新鲜,7 d~25 d 牛肉为次鲜肉;B 组气调贮藏 7 d 能保持牛肉新鲜,7 d~12 d 牛肉为次鲜肉,18 d 后变质;C 组气调贮藏7 d 能保持牛肉新鲜,7 d~18 d 牛肉为次鲜肉,25 d 后变质;D 组气调贮藏3 d 能保持牛肉新鲜,3 d~18 d 牛肉为次鲜肉,25 d 后变质。以菌落总数为评价指标,A、C、D 在 7 d 内均能保持牛肉新鲜;B 组在第一次测量时,菌落总数已经过高,不易保鲜贮藏;A、C 组次鲜肉能保持到18 d;A、B、C、D 组牛肉均在 25 d 后完全变质。
3 结论
通过比较新鲜冷藏牛肉在A、B、C、D 组气调比例下的贮藏时,牛肉的失重率、pH 值、挥发性盐基氮含量、菌落总数以及在不同气调组合下的保鲜期,结果发现,A 气调条件(O2为 15%,CO2为 75%,N2为 10%)适宜牛肉贮藏保鲜。在该气体组合下,新鲜牛肉能在0 ℃~4 ℃条件下贮藏7 d 仍然保持较好的品质,继续保藏7 d~18 d 牛肉品质出现下降;贮藏25 d 后,牛肉不能食用。总之,气调辅助冷藏能较好地延长新鲜牛肉的冷藏品质保持时间。

