土传真菌病害拮抗菌的筛选及其生防效果研究
崔文会,孙 雪,梁承宇,袁晓明,李保国*,刘 莉*
1.上海理工大学医疗器械与食品学院,上海 200093;2.中国科学院上海高等研究院,上海 201210;3.光明食品集团上海崇明农场有限公司,上海 202179
近年来我国农作物的土传病害日趋严重,对农作物的产量和品质造成了严重的影响。土传病害是指由存在于土壤中的病原物在条件适宜时侵染植物根部或茎部而造成的病害。土传病害的致病菌栖息于土壤中,难以根治,甚至被称为植物癌症[1]。土传病原体的类型包括真菌、细菌和线虫等,引发包括纹枯、枯萎、立枯、猝倒、根腐、软腐、根肿和丛根等类型病害[2]。与细菌、线虫等类型引起的土传病害相比,土传真菌病害更易于传播,涉及作物类型广泛,对作物产量危害极大[3]。据估计植物病害造成的直接经济损失中的70%~80%是病原真菌的侵染所引起,当前全球范围内每年因真菌引起的作物病害导致粮食减产1.25亿吨,造成上千亿美元的经济损失。对以人口众多、农业为主的发展中国家影响更为严重,不仅导致作物减产、环境破坏、生态失衡和经济损失,还严重影响人类的可持续发展[4]。
目前,国内外通常采用物理、化学及生物方法防治植物病害。物理防治费时费力,且防治效果有限、受环境条件影响较大,因此应用受到限制;化学防治由于其使用方便、效果明显而被广泛使用,但长期大量使用化学药剂会使病害产生抗药性,造成环境污染,破坏生态平衡,且存在农药残留,对人畜副作用大[5];生物防治与其它方法相比,具有安全、有效和持久的特点,特别是避免了化学防治带来的一系列问题,近年来备受关注。因此,更好地利用有益微生物防治植物病害是目前最为切实可行的策略之一。生物防治是利用活体生防菌株及其代谢的活性成分来控制病害发生的一种技术,生防菌株可在作物植株及根际定植生长,形成生物屏障保护作物免受病原菌侵害;其代谢活性物质一方面抑制杀死病原真菌,另一方面诱导植株提高病害抗性,菌株所分解和转化的营养元素又可以被作物加以利用,进而提高作物品质、增加产量[6]。目前多数研究集中在某单一作物的土传真菌病害的生物防治上,针对引起多种作物土传真菌病害的报道较少。本研究针对3种主要粮食作物的常见土传病害,旨在筛选出能够拮抗不同类型土传真菌病害的广谱生防菌株,为主要粮食作物土传真菌病害生防菌剂的开发和应用奠定基础。因生物防治是利用活体生防菌株及其代谢产物的活性成分来控制病害的发生,因此需要对生防菌株的活性物质进行探究,包括抑菌活性物质的种类和其抑菌活性的稳定性。
1 材料与方法
1.1 材料
1.1.1供试菌株
指示病原真菌:水稻稻瘟病菌(Magnaportheoryzae)、小麦赤霉病菌(Fusariumgraminearum)、小麦全蚀病菌(Gaeumannomycesgraminisvar.tritici)由海南大学热带农林学院农药实验室提供;水稻纹枯病菌(Rhizoctoniasolani)由吉林省农业科学院植物保护研究所提供;大豆疫霉病菌(Phytophthorasojae)、小麦纹枯病菌(Rhizoctoniacerealis)购自中国农业微生物菌种保藏管理中心。
1.1.2培养基
LB培养基:酵母膏5.0 g/L,蛋白胨10.0 g/L,NaCl 10.0 g/L,pH为7.0。固体培养基时另添加15 g/L~20 g/L琼脂粉,121 ℃灭菌20 min。
PDA培养基:马铃薯浸出液200 g/L,葡萄糖20 g/L。固体培养基时另添加15 g/L~20 g/L琼脂粉,115 ℃灭菌30 min。
1.2 仪器与设备
AxyPrep基因组提取试剂盒、Taq酶、DNA Ladder Mix、dNTP 均购自上海生工生物工程股份有限公司;其余试剂均为上海国药集团化学试剂有限公司的分析纯试剂。
全自动电热培养箱:上海智城分析仪器制造有限公司;分光光度计:德国BECKMAN COULTER公司;电子天平:德国Sartorius公司;高压蒸汽灭菌器:日本三洋公司;S1000-PCR扩增仪:美国BIO-RAD;ZWY-2102C恒温振荡摇床:上海智城分析仪器制造有限公司;L550医用离心机:湖南湘仪实验室仪器有限公司。
1.3 方法
1.3.1拮抗微生物的分离纯化
采用五点取样法,在崇明稻田土壤靠近植株根系部,去除表层0 cm~5 cm的表土,采集5 cm~20 cm土壤剖面,混匀后取1 kg,收集了15份土样,装入无菌塑料袋带回,4 ℃冰箱保存。
每份土样称取10 g,置于三角锥形瓶中,加入90 mL灭菌水和少许灭菌玻璃珠,30 ℃、200 r/min振荡培养20 min,室温静置20 min,将土壤中的微生物分离出来,此为10-1土壤悬液。吸取1 mL 10-1土壤悬液于9 mL无菌水中,另用无菌吸管吹吸3次,混匀,制成10-2土壤悬液[7]。以此类推依次制成10-3~10-8不同稀释度的土壤悬液。吸取100 μL不同浓度梯度的土壤悬浮液均匀涂布在LB培养基上,30 ℃培养24 h~72 h后,根据菌落大小、颜色、边缘光滑程度等形态学特征对细菌进行分离纯化得到单菌落。
1.3.2拮抗微生物的筛选
抗菌活性用平板对峙法[8]测定。将6种病原菌进行活化培养5 d,用打孔器在菌落边缘区域打孔制成直径为6 mm的病原菌菌饼,放置到PDA平板中央,同时将分离得到的单菌落点接在距离平板中心25 mm处,每皿接种4个菌株,以只放置病原菌菌饼的PDA平板作为对照,重复3次,30 ℃培养箱中培养至对照组中的病原菌菌丝长满培养基,观察实验组平板上是否出现拮抗带,测量相对拮抗菌方向病原菌菌丝生长的直径(D)和抑菌带宽度(d),利用公式(1)计算抑菌率。
抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
(1)
1.3.3拮抗微生物的鉴定
1.3.3.1形态学观察
首先将CX-2菌株划线接种于LB培养基平板,30 ℃培养48 h后观察菌落形态特征。挑取培养基上的菌落进行革兰氏染色[9],显微镜下观察其菌体形态特征。
1.3.3.2生理生化特性鉴定
生理生化测定参照《伯杰氏细菌学鉴定手册》[10]和《常见细菌系统鉴定手册》[11]。
1.3.3.3分子生物学鉴定
将筛选到的菌株采用16S rDNA基因序列分析的方法进行鉴定,本实验使用AxyPrep细菌基因组DNA小量制备试剂盒,提取相关的原核微生物基因组,扩增引物对使用27F(5′-AGAGTTTGATC-CTGGCTCAG-3′)及1492R(5′-GGTTACCTTGTTACG-ACTT-3′),PCR反应体系为:Taq酶10 μL,模板1 μL,引物各0.5 μL,补ddH2O至20 μL。
PCR反应程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,以上循环进行30次,72 ℃补延伸10 min,最后16 ℃降温5 min结束。
PCR产物用1.5%的琼脂糖凝胶电泳进行检测条带后,由上海生工生物工程股份有限公司纯化测序。根据基因测序结果,采用BLAST搜索程序从GenBank数据库中调出同源性高的相关菌株的基因序列,利用MEGA 7.0软件进行序列多重比对后,采用Neighbor-Joining法构建系统进化树,从而确定菌株CX-2的分类。
1.3.4无菌滤液的抑菌活性
CX-2菌株无菌滤液的制备:将菌株转接到装有5 mL液体LB的试管中,30 ℃、200 r/min下培养24 h,吸取3 mL菌液,移入装有50 mL LB培养液的250 mL三角瓶中,30 ℃、200 r/min下培养96 h,然后将上述发酵液10 000 r/min下离心15 min,取离心后的上清液,用孔径为0.22 μm的细菌过滤器过滤,得到无菌滤液,用以验证CX-2菌株无菌滤液的抑菌活性。
无菌滤液抑菌效果的测定采用菌丝生长速率法[12]。吸取100 μL无菌滤液均匀涂布于PDA平板上,然后在平板中心放置直径为6 mm的病原菌菌饼,对照组涂布等体积的无菌水后放置相同直径的病原菌菌饼,重复3次,5 d后观察并记录对照组和实验组病原菌菌饼的直径大小,并计算抑菌率。
1.3.5挥发性气体的抑菌活性
采用平板倒扣法[13]测定挥发性气体的抑菌活性,将直径6 mm的病原菌菌饼放置在PDA培养基平板中央。取100 μL CX-2菌株的发酵液在LB培养基平板上均匀涂布,然后将两平板对扣,封口膜密封,用100 μL无菌水替代菌株发酵液作为对照组,每个处理设3个重复。5 d后观察病原菌菌丝的生长情况并测量病原菌菌饼直径,计算抑菌率。
1.3.6无菌滤液的稳定性
1.3.6.1无菌滤液的热稳定性
将制备好的无菌滤液分别在不同温度下处理1 h,温度恢复至室温25 ℃后,用菌丝生长速率法,测定无菌滤液对水稻稻瘟病菌的抑菌活性[14],吸取100 μL经过不同温度处理的无菌滤液均匀涂布于PDA平板上,然后在平板中心放置直径为6 mm的病原菌菌饼。对照组(T=25 ℃)涂布等体积的无菌水后放置相同直径的病原菌菌饼,重复3次,5 d后观察并记录对照组和实验组病原菌菌饼的直径大小,计算抑菌率。
1.3.6.2无菌滤液的酸碱稳定性
用1 mol/L的NaOH和1 mol/L的HCl调节无菌滤液的pH为2~12,静置24 h后调回原发酵液的pH 6.4备用[14]。测定不同酸碱度处理后无菌滤液对水稻稻瘟病菌的抑菌活性,以未调整pH(6.4)的无菌发酵液为空白对照,重复3次,计算抑菌率。
1.3.6.3无菌滤液对蛋白酶K的稳定性
为了对无菌滤液中抑菌活性物质的种类进行初步探究,在菌株CX-2的无菌滤液中加入蛋白酶K,使酶的最终浓度为1 mg/mL,37 ℃处理1 h,测定处理后无菌滤液对水稻稻瘟病菌的抑菌活性[14],以不加入酶的无菌滤液作为空白对照,重复3次,计算抑菌率。
1.3.7数据处理与分析
采用Origin 8.5软件和Excel 2016对数据进行统计分析。
2 结果与分析
2.1 拮抗菌株的筛选
通过平板对峙实验,从土壤样品中共分离得到5株对所选6种病原真菌均表现出拮抗效果的菌株,菌株编号分别为CX-2、SJK-2、SJK-3、JK-1、XL-1。抑菌效果见表1。由表1可看出,CX-2菌株对6种病原真菌表现出的效果最好,尤其是对小麦纹枯病菌和小麦全蚀病菌的抑菌率高达80%以上,分别为81.71%和91.27%。
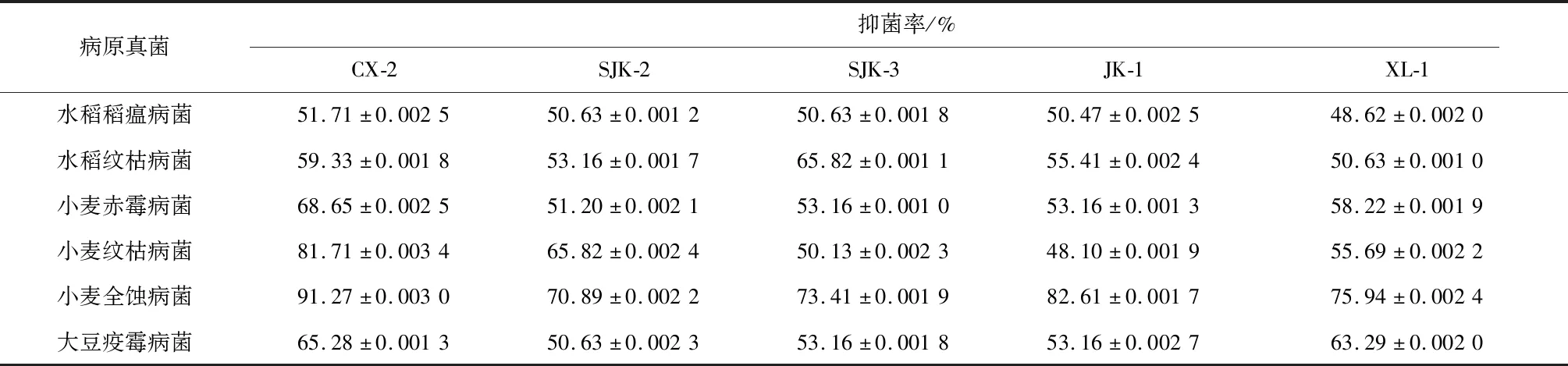
表1 5株拮抗菌对6种土传病原真菌的抑菌活性
选取CX-2菌株进行后续研究,对该菌株的抑菌活性物质和抑菌活性物质的稳定性进行进一步探究。
图1为CX-2菌株对6种病原真菌的平板对峙抑菌效果,从图1中可以看出CX-2菌株对6种病原真菌的菌丝生长均有抑制效果,产生了清晰可见的抑菌带。
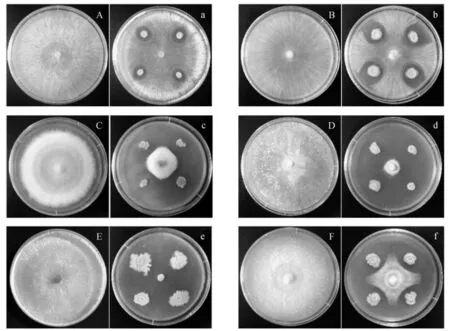
A和a:水稻稻瘟病菌;B和b:水稻纹枯病菌;C和c:小麦赤霉病菌;D和d:小麦纹枯病菌;E和e:小麦全蚀病菌;F和f:大豆疫霉病菌。
其中A、B、C、D、E、F为对照组;a、b、c、d、e、f为实验组。
图1 CX-2对6种供试植物病原真菌的抑制效果
2.2 CX-2菌株分类鉴定
2.2.1形态学鉴定
拮抗菌CX-2在LB培养基上培养48 h后,菌落呈圆形,表面及边缘粗糙,呈乳白色,蜡状(图2A)。革兰氏染色显示该菌体为阳性杆状菌株(图2B),且能产生芽孢(图2C)。
2.2.2生理生化特性鉴定
菌株CX-2的生理生化特性表现为可以利用D-葡萄糖、L-阿拉伯糖、D-甘露糖,不产生H2S、能分泌明胶酶、V-P反应和吲哚试验均呈阳性、甲基红试验呈阴性,能与硝酸盐产生还原反应、可水解淀粉,接触酶试验和氧化酶试验均呈阳性(表2所示)。其特征符合《常见细菌系统鉴定手册》中关于芽孢杆菌属细菌的描述。

表2 菌株CX-2的生理生化特征
2.2.3分子生物学鉴定
CX-2菌株16S rDNA基因PCR扩增测序后得到长度为1 452 bp的片段,与GenBank中序列在线比对,与多株贝莱斯芽孢杆菌Bacillusvelezensis16S rDNA序列的同源性高达99%以上,与MK310268、MG727659等B.velezensis的亲缘关系最近,处于系统发育树的同一分支(见图3)。基于分子生物学鉴定结果,结合形态学和生理生化特性,鉴定该菌株为贝莱斯芽孢杆菌Bacillusvelezensis。

图3 CX-2菌株的系统发育树
2.3 无菌滤液的抑菌活性
CX-2无菌滤液对6种病原真菌抑菌率如表3所示,CX-2的无菌滤液能够发挥很好的抑制作用,对全部6种病原真菌的抑制率达到了71%以上,对小麦纹枯病菌和小麦全蚀病原菌的抑菌率分别为90.13%和94.34%。说明CX-2菌株的无菌滤液中含有抗菌活性物质,从而起到对病原菌的抑制作用。
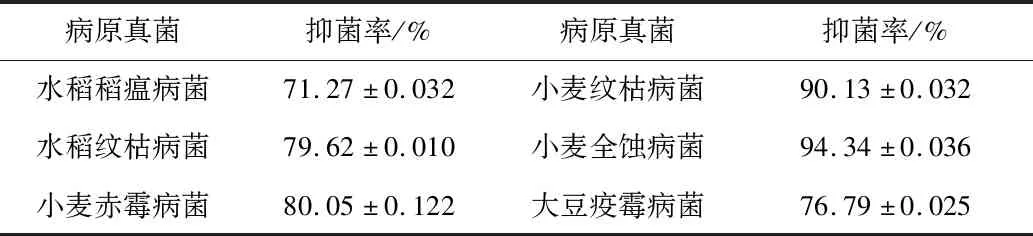
表3 CX-2无菌滤液对6种土传病原真菌的抑菌效果
2.4 挥发性气体的抑菌效果
CX-2菌株产生的挥发性物质对6种病原菌的抑制效果如表4所示,由表4可以看出,CX-2菌株所产生的挥发性物质对全部6种病原真菌的抑菌率集中在45%~77%之间,对大豆疫霉病菌发挥最大的抑菌效果,抑菌率为76.62%。由此推测,CX-2菌株所产生的挥发性气体中含有抑菌活性物质,可以对6种病原菌起到抑制作用。
2.5 无菌滤液的稳定性
2.5.1无菌滤液的热稳定性
无菌滤液经过不同温度处理后对水稻稻瘟病菌的抑菌率变化情况见图4,与对照组(T=25 ℃)的抑菌活性相比无明显差异。经4 ℃低温处理与40 ℃~100 ℃高温处理后,对水稻稻瘟病菌的抑菌率都略有降低,但抑菌率仍维持在50%以上,表明无菌滤液中的抗菌活性物质具有较强的热稳定性。
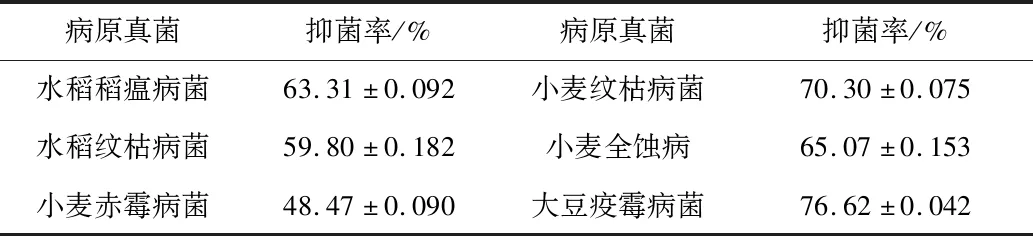
表4 CX-2挥发性气体对6种土传病原真菌的抑菌效果
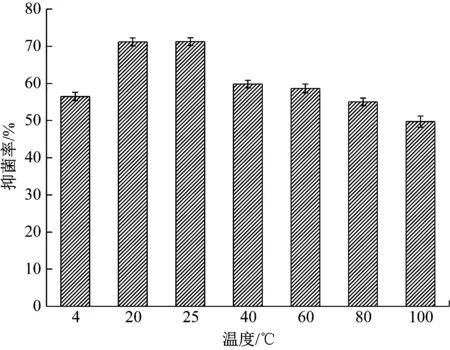
图4 温度对无菌滤液活性的影响
2.5.2无菌滤液的酸碱稳定性
对pH为6.4的原始无菌滤液进行酸、碱调节后,其对水稻稻瘟病菌的抑菌活性如图5所示,由图5可以看出,CX-2的无菌滤液在pH为5~9时表现出较高的抑菌活性,当pH为2、3及11、12时,无菌滤液丧失了对水稻稻瘟病菌的拮抗活性,说明较低或较高的pH会破坏无菌滤液中抗菌活性物质的抑菌活性,由此可知,理想发酵液的pH应维持在5~9之间。
2.5.3无菌滤液对蛋白酶K的稳定性
室温下未经蛋白酶K处理的无菌滤液对水稻稻瘟病菌的抑菌率为71.24%,经蛋白酶K处理1 h后,对水稻稻瘟病菌的抑菌率为70.79%,与对照组相比,抑菌活性没有明显的降低,说明无菌滤液中的抑菌活性物质对蛋白酶K不敏感,CX-2菌株的抗菌活性物质可能为非蛋白类物质。
3 结论
本研究从土壤中分离获得一株对所选6种病原真菌均有拮抗效果的菌株,通过对菌株的形态、生理生化特性及分子生物学特征分析研究,鉴定为贝莱斯芽孢杆菌Bacillusvelezensis。在平板对峙实验中,CX-2菌株对全部6种病原真菌均有抑制作用,其抑菌活性具有广谱性。另外CX-2菌株的无菌滤液和挥发性气体均有一定的抑菌效果,说明菌株CX-2的无菌滤液和挥发性气体中存在抗菌活性物质,其中无菌滤液对全部6种病原真菌的抑制率达到了71%以上,对小麦纹枯病菌和小麦全蚀病原菌的抑菌率均在90%以上,分别为90.13%和94.34%;CX-2菌株所产生的挥发性物质对大豆疫霉病菌发挥最大的抑菌效果,抑菌率为76.62%。而且无菌滤液的热稳定性好;其pH在5~9之间时可以发挥稳定的抑菌活性;另外无菌滤液对蛋白酶K的稳定性良好。综上所述,本研究筛选获得的贝莱斯芽孢杆菌BacillusvelezensisCX-2,其活菌、无菌滤液和所产生的挥发性气体均对所选6种病原菌具有拮抗活性,抑菌活性物质可能为非蛋白类物质,无菌滤液抑菌活性稳定,可用于防治引起水稻、小麦和大豆常见土传病害的生物防治,具有开发成生防菌剂的潜力。
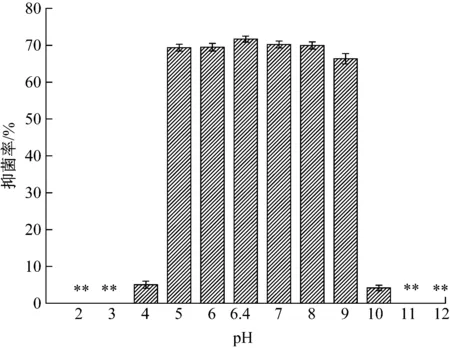
备注:“**”代表无抑菌活性
图5 pH对无菌滤液活性的影响

