CHO细胞表达抗血管内皮生长因子单克隆抗体工艺优化
冯 炜,史劲松
江南大学 药学院,无锡 214122
血管内皮生长因子(vascular endothelial growth factor,VEGF)是重要的促血管生长因素,可提高血管的通透性[1],是诱导肿瘤血管形成的作用最强、特异性最高的血管生长因子[2]。因此,抑制血管内皮生长因子可以抑制肿瘤的生长[3]。抗VEGF治疗的第一代药物是诺华公司的Lucentis和罗氏公司的Avastin,前者价格昂贵,而后者价格低廉,在很多国家作为非标签用药,市场巨大[3, 4]。抗VEGF治疗的第二代药物是德国拜耳的Eylea和我国成都康弘生物科技有限公司的朗沐,此类药物是一种融合蛋白,可以与VEGF竞争性结合VEGF受体,抑制VEGF产生作用,作用比第一代的抗VEGF药物更强。Eylea目前在海外市场已经占据相当大的市场份额,而朗沐在我国已开始临床三期试验,表现出显著的治疗效果[5-8]。然而,前两代抗VEGF治疗的药物都只适用于眼底病治疗的药物,应用范围受到很大的限制。近年来,单克隆抗体类药物发展迅猛,已被广泛用于恶性肿瘤、免疫学疾病和罕见病等多个适应症的治疗[9],目前已有超过300种单克隆抗体药物处于临床试验阶段[10]。与第一代和第二代抗VEGF药物相比,抗VEGF单克隆抗体的应用范围更加广泛。本研究利用已经构建好的中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO)细胞株表达抗VEGF人源化单克隆抗体(VEGF-MA),并对培养基和培养条件进行优化,以期获得更高的目的蛋白产量。
1 材料与方法
1.1 细胞株
本研究所用细胞株为重组CHO细胞。目的产物为VEGF-MA,93%的序列为人源,7%的序列为鼠源(位于可变区的互补决定区CDR),每个轻链由214个氨基酸组成,每个重链由453个氨基酸组成,相对分子量为149 000。
1.2 培养基
(1) 基础培养基:本研究选取14种基础培养基,编号以及浓度如表1所示。
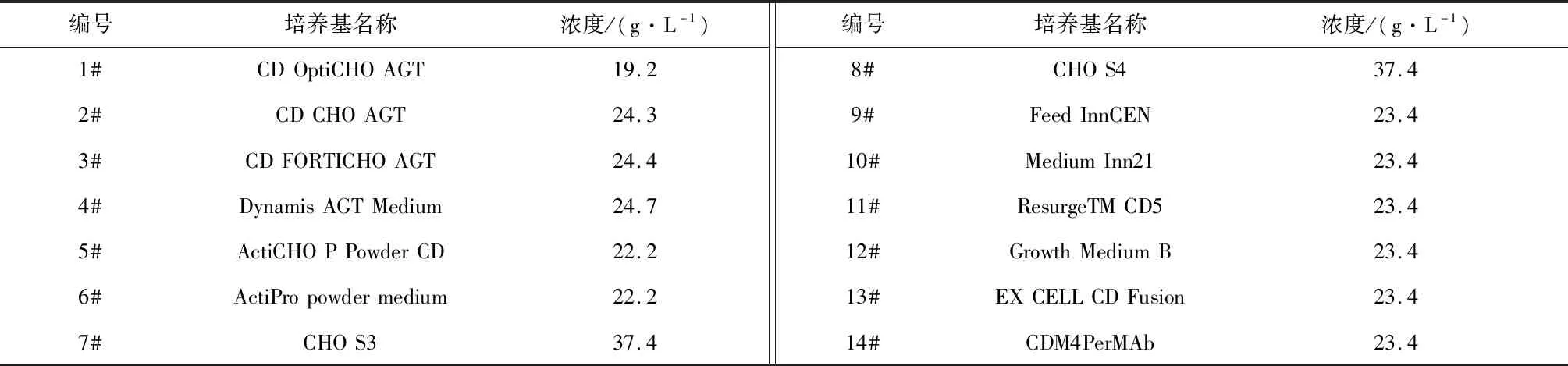
表1 基础培养基
(2) 补料培养基:本研究选取10种补料培养基,编号以及浓度如表2所示。
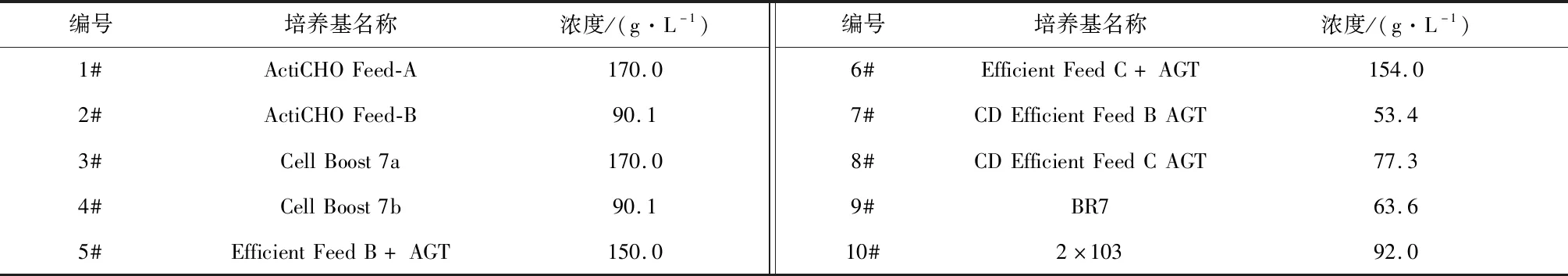
表2 补料培养基
(3) 外源添加物:本研究选取7种能够促进VEGF-MA表达的外源添加物,为方便添加,将其配制成溶液,溶液浓度以及编号如表3所示。
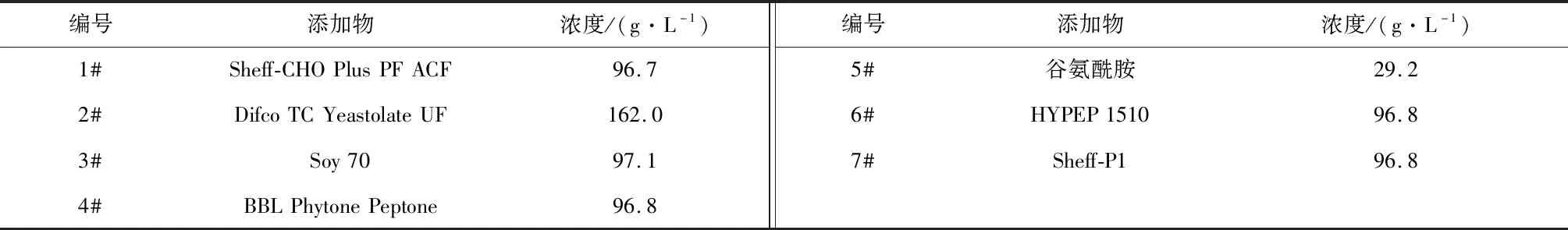
表3 外源添加物
1.3 细胞培养
1.3.1细胞复苏及摇瓶扩增
从液氮罐中取出冻存细胞37 ℃水浴解冻,将解冻后的冻存液转入装有8.5 mL CD CHO培养基的离心管中,充分混匀,1 000 r/min离心5 min,弃去上清。将细胞沉淀重新悬浮于5 mL CD CHO培养基中,以0.30×106个/mL~0.90×106个/mL的密度接种于装有25 mL CD CHO培养基的250 mL三角瓶中。将三角瓶置于CO2摇床中培养,CO2浓度、温度和转速分别为6%、36.5 ℃和130 r/min。每三天对摇瓶中的细胞计数一次,按(0.4×106~0.6×106)个/mL的密度接种至新鲜培养基,逐级传代扩增至0.25 L~2 L摇瓶中。
1.3.2摇瓶培养
用基础培养基将细胞按一定的接种细胞密度接入250 mL挡板摇瓶中,接种体积80 mL,摇床培养参数为:6% CO2,36.5 ℃,130 r/min。其他工艺参数按照实验设计进行设定。按相关实验方案进行补料,补料体积为初始培养重量的4%,外源添加物体积为初始培养重量的1%。葡萄糖浓度低于2.0 g/L时,添加200 g/L的葡萄糖溶液将葡萄糖浓度提高至4.0 g/L。根据通气产生的泡沫情况,适量添加消泡剂。
1.3.33 L发酵罐培养
用基础培养基将摇瓶种子细胞按一定比例稀释至接种细胞密度设定值,接入3 L发酵罐,发酵罐初始培养体积1.0 L。设置发酵罐搅拌转速为280 r/min,DO设定值为40%,与O2通气量进行关联控制,氧气通气流量范围为(0~500) mL/min,根据活细胞密度调整空气流量设定值,空气流量控制范围为(10~100) mL/min。其他工艺参数按照实验设计进行设定。pH通过添加通碳酸氢钠溶液和CO2进行关联调节。每天取样检测活细胞密度、细胞活率,第3 d、5 d、7 d、9 d、11 d补料,补料体积为初始培养重量的4%,外源添加物体积为初始培养重量的1%。葡萄糖浓度低于2.0 g/L时,添加200 g/L的葡萄糖溶液将葡萄糖浓度提高至4.0 g/L。根据通气产生的泡沫情况,适量添加消泡剂。
1.4 检测方法
1.4.1VEGF-MA浓度检测
VEGF-MA浓度检测方法见参考文献[11]。
1.4.2VEGF-MA纯化
VEGF-MA纯化方法见参考文献[12,13]。
1.4.3糖基化水平检测
糖基化水平检测方法见参考文献[14-16]。
1.4.4蛋白纯度检测
蛋白纯度检测方法见参考文献[14-16]。
1.4.5电荷异质性检测
电荷异质性检测方法见参考文献[14-16]。
2 结果与讨论
2.1 培养基优化
2.1.1基础培养基优化
首先选取14种细胞培养中常用的基础培养基,种类如表1所示。分别在不同的培养基中培养CHO细胞,考察抗VEGF抗体的生产性能,目的在于选择最优的基础培养基。目的蛋白产量是体现生产性能的主要指标,在上述14种基础培养基中培养CHO细胞7 d后,发酵液中的VEGF-MA浓度如图1所示。从中可以看出,最优的批次所使用的基础培养基为5#,VEGF-MA的产量为0.70 g/L。此外,使用7#、9#和11#三种基础培养基时,也可以获得较高的目的蛋白产量(0.60 g/L以上)。除目的蛋白产量外,目的产物质量也是体现生产性能的重要指标。目的产物质量可以依靠其电荷异质性、糖基化组分和蛋白纯度三个指标判断。通常情况下,电荷异质性≤35.0%、糖基化组分处于50.0%~60.0%之间以及蛋白纯度≥85.0%的目的产物被认为质量合格。在上述14个批次结束时刻的发酵液中分离纯化抗VEGF抗体,测定其电荷异质性、糖基化组分和蛋白纯度,结果如表4所示。可以看出,5#基础培养基条件下的VEGF-MA质量较高。综合目的产物产量及质量,选用5#培养基,即ActiCHO P Powder CD,作为后续研究中所用的基础培养基。
2.1.2补料培养基优化
选取如表2所示的10种补料培养基,在使用ActiCHO P Powder CD基础培养基的条件下,按照1.3.2小节所述的方法进行补料操作,以筛选最优的补料培养基。培养14 d后,细胞培养液中的VEGF-MA产量和质量分别如图2和表5所示。综合考虑VEGF-MA的产量和质量,选取8#补料培养基,即CD Efficient Feed C AG,作为后续研究中使用的补料培养基。补加CD Efficient Feed C AG后,对目的产物质量影响不明显,且VEGF-MA的产量达到2.55 g/L。
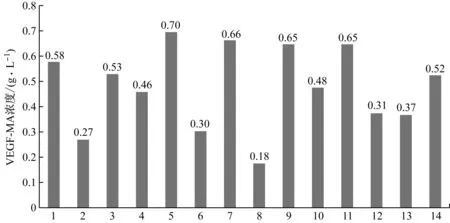
图1 不同基础培养基条件下的VEGF-MA产量
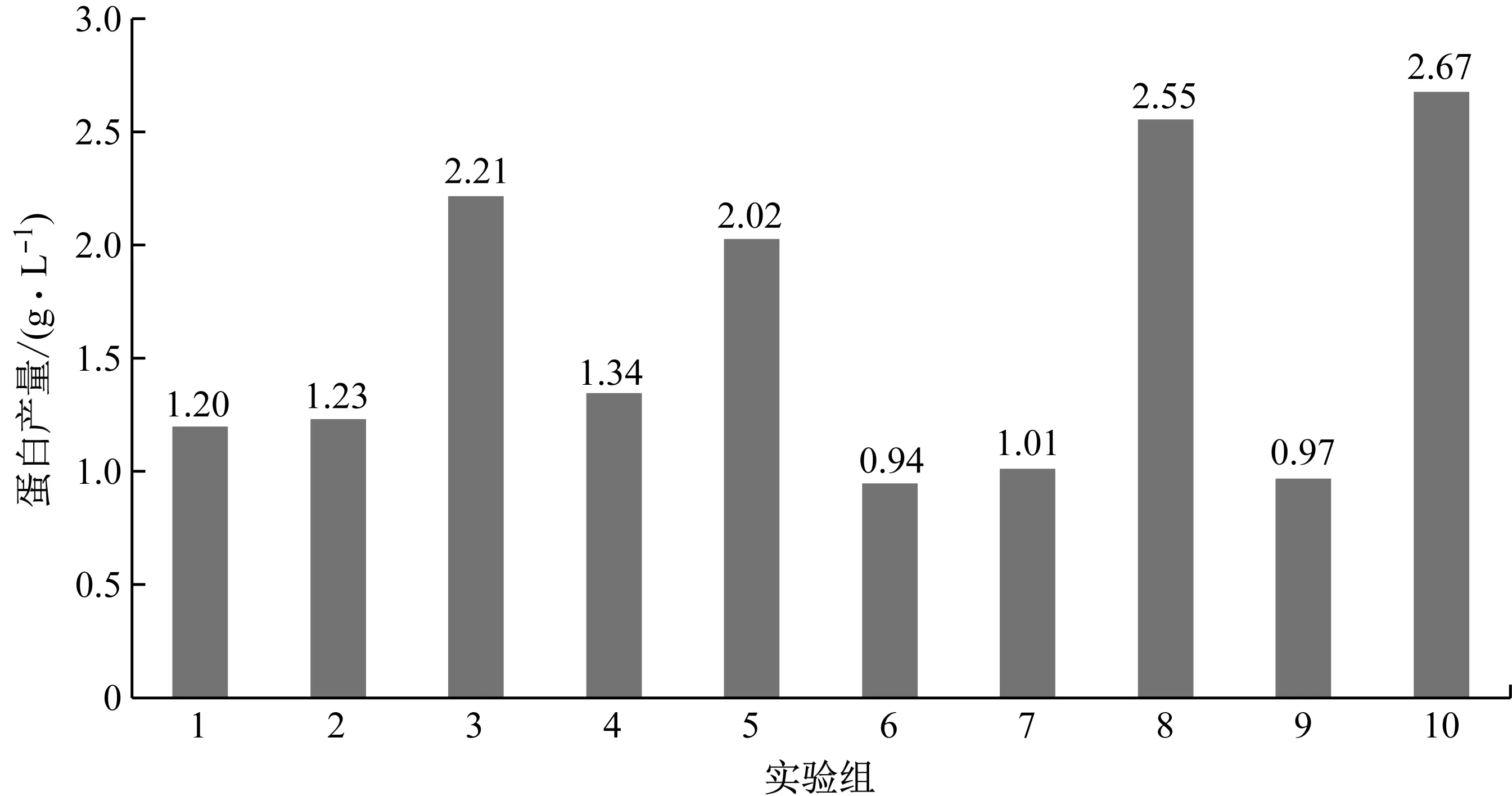
图2 添加不同补料培养基条件下的VEGF-MA产量
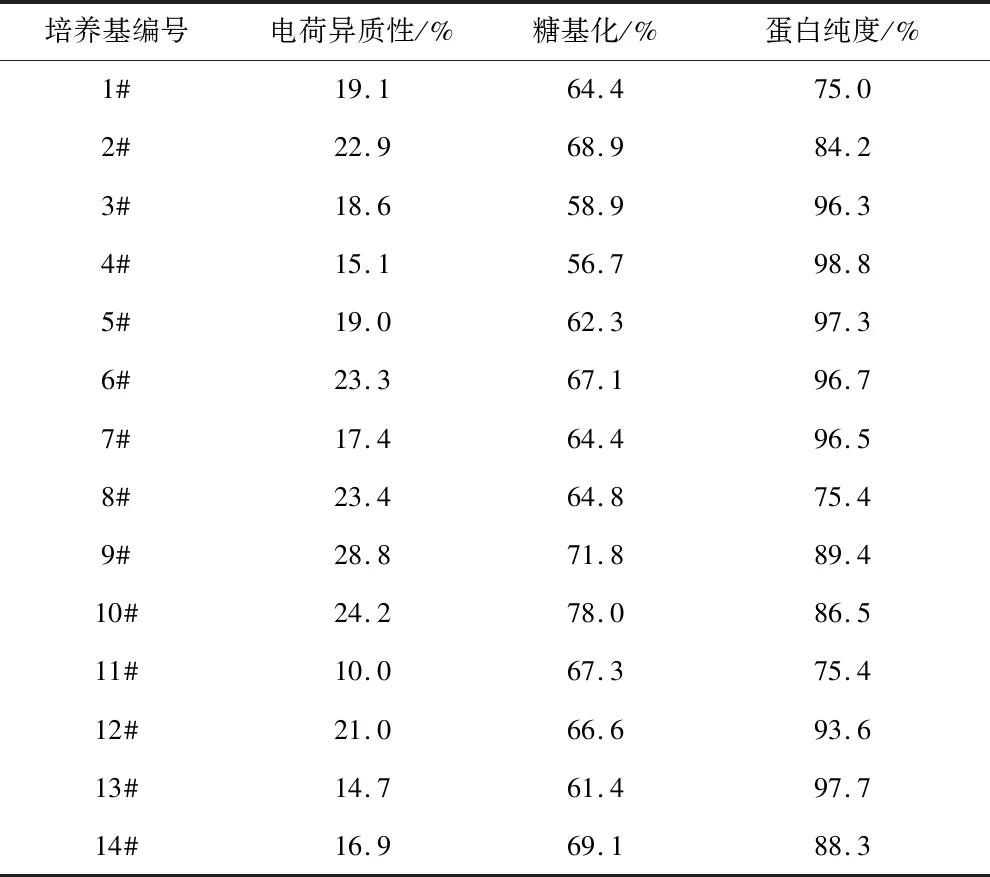
表4 不同基础培养基下的VEGF-MA质量
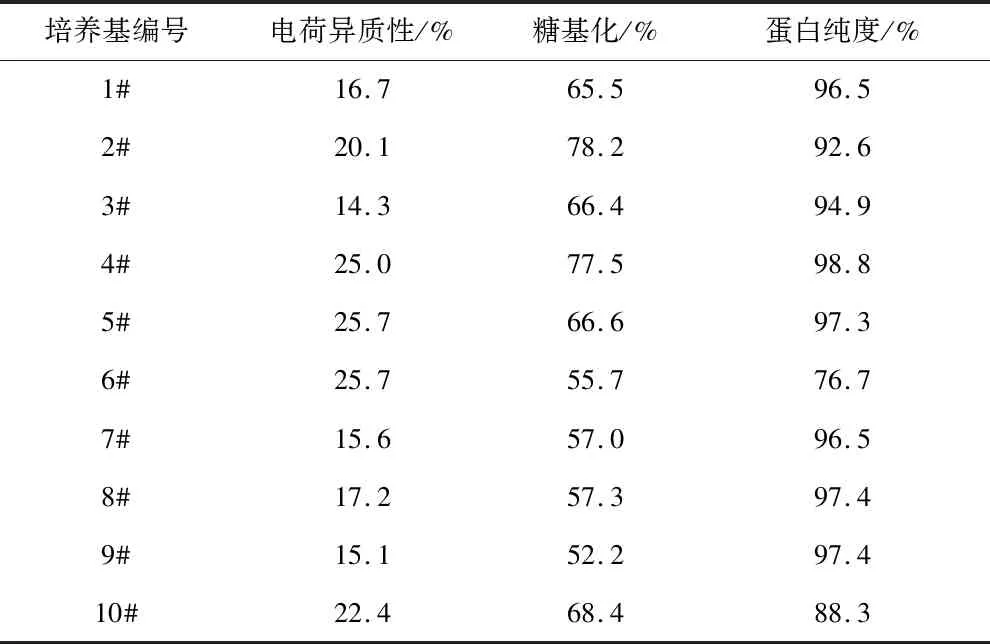
表5 添加不同补料培养条件基下的VEGF-MA质量
2.1.3外源添加物优化
选取如表3所示的7种外源添加物,考察在补加不同外源添加物条件下VEGF-MA的生产性能。在使用ActiCHO P Powder CD基础培养基和CD Efficient Feed C AG补料培养基的条件下,培养14 d后,细胞培养液中的VEGF-MA产量和质量分别如图3和表6所示。从中可以看出,添加各种外源添加物条件下,VEGF-MA产量均有不同程度的提高。综合考虑VEGF-MA的产量和质量,选取1#外源添加物,即Sheff-CHO Plus PF ACF。添加该物质后,对目的产物质量影响不明显,且VEGF-MA产量由2.54 g/L提高至3.20 g/L。
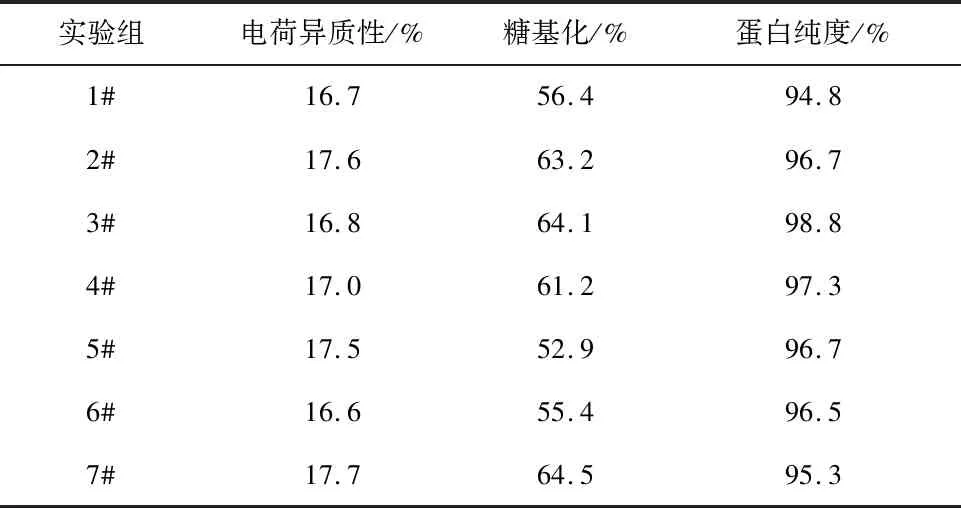
表6 补加不同外源添加物条件下的VEGF-MA质量

图3 补加不同外源添加物条件下的VEGF-MA产量
2.2 3 L发酵罐培养条件优化
2.2.1接种密度优化
将上述研究中所获得的培养基组合用于3 L发酵罐中培养CHO细胞生产VEGF-MA的过程,即使用ActiCHO P Powder CD基础培养基CD Efficient Feed C AG补料培养基,并添加Sheff-CHO Plus PF ACF。共进行三个批次的发酵实验,培养14 d后VEGF-MA产量均在3.20 g/L左右(图4),且VEGF-MA电荷异质性、糖基化水平和蛋白纯度均达到质量标准(表7)。在后续的研究中,将以这三个批次作为对照,在3 L发酵罐中对接种密度、pH、溶解氧浓度(DO)、前期培养温度和后期培养温度做进一步优化。
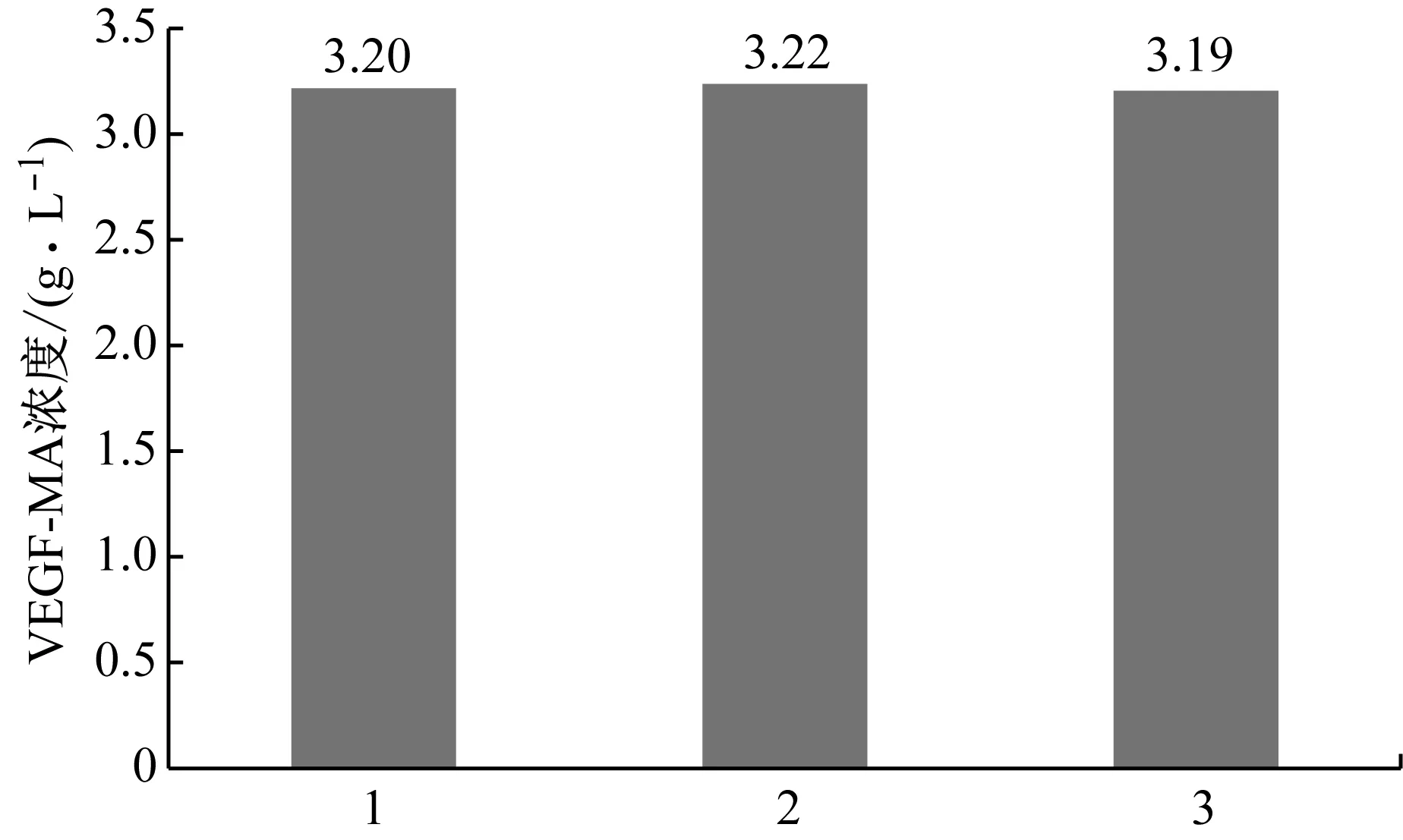
图4 最优培养基配比条件下的VEGF-MA产量
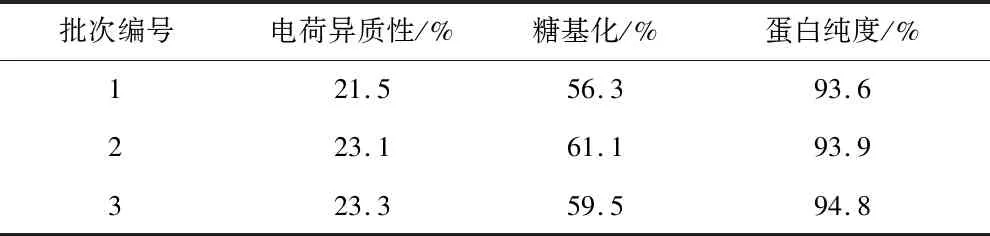
表7 最优培养基配比条件下的VEGF-MA质量
首先优化接种密度,分别考察0.7×106个/mL、1.0×106个/mL和1.3×106个/mL三个接种密度条件下的VEGF-MA生产性能,VEGF-MA产量和质量和分别如图5和表8所示。可以看出接种密度对VEGF-MA产量、电荷 异质性、糖基化水平和VEGF-MA纯度均没有显著影响。因此,在后续研究中,仍然使用1.0×106个/mL的接种密度。
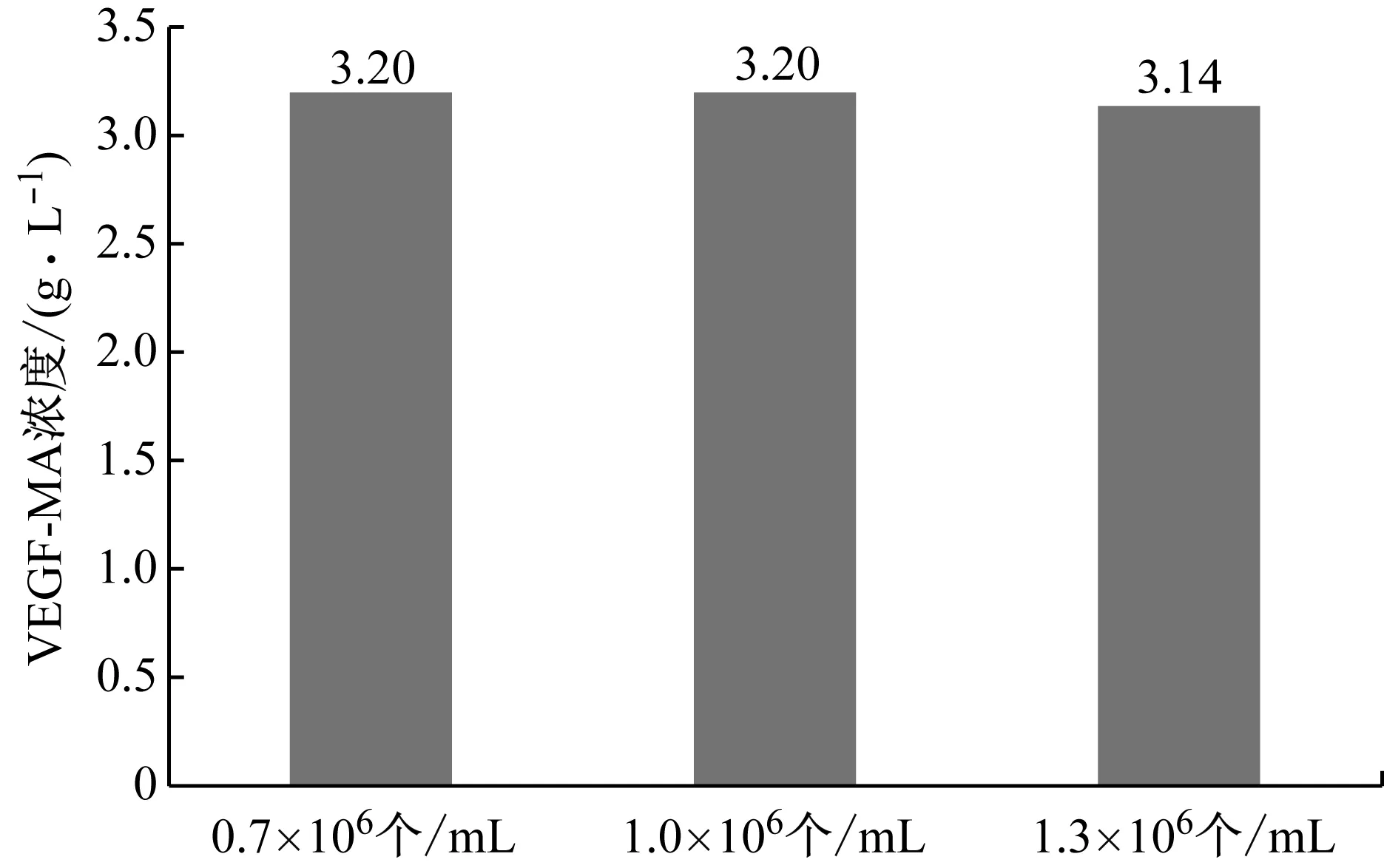
图5 不同接种密度条件下的VEGF-MA产量
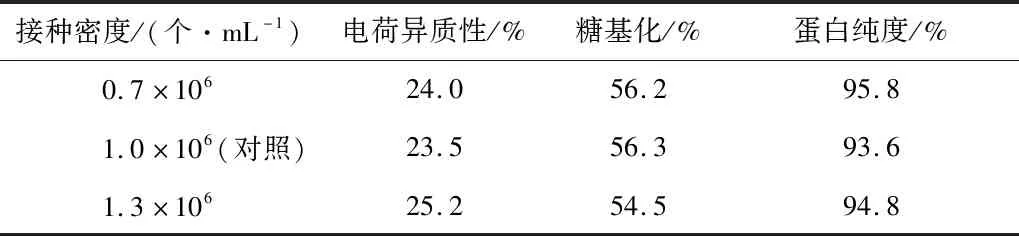
表8 不同接种密度条件下的VEGF-MA质量
2.2.2pH优化
对细胞培养过程中的pH进行优化,分别考察pH设定为7.00(对照)、7.10和7.15条件下的VEGF-MA生产性能,VEGF-MA产量和质量和分别如图6和表9所示。pH设定为7.10时VEGF-MA产量最高,达到表达量3.70 g/L。此时的电荷异质性、糖基化水平和VEGF-MA均处在标准的范围内。因此,在后续的研究中都将选用7.10作为pH的设定值。
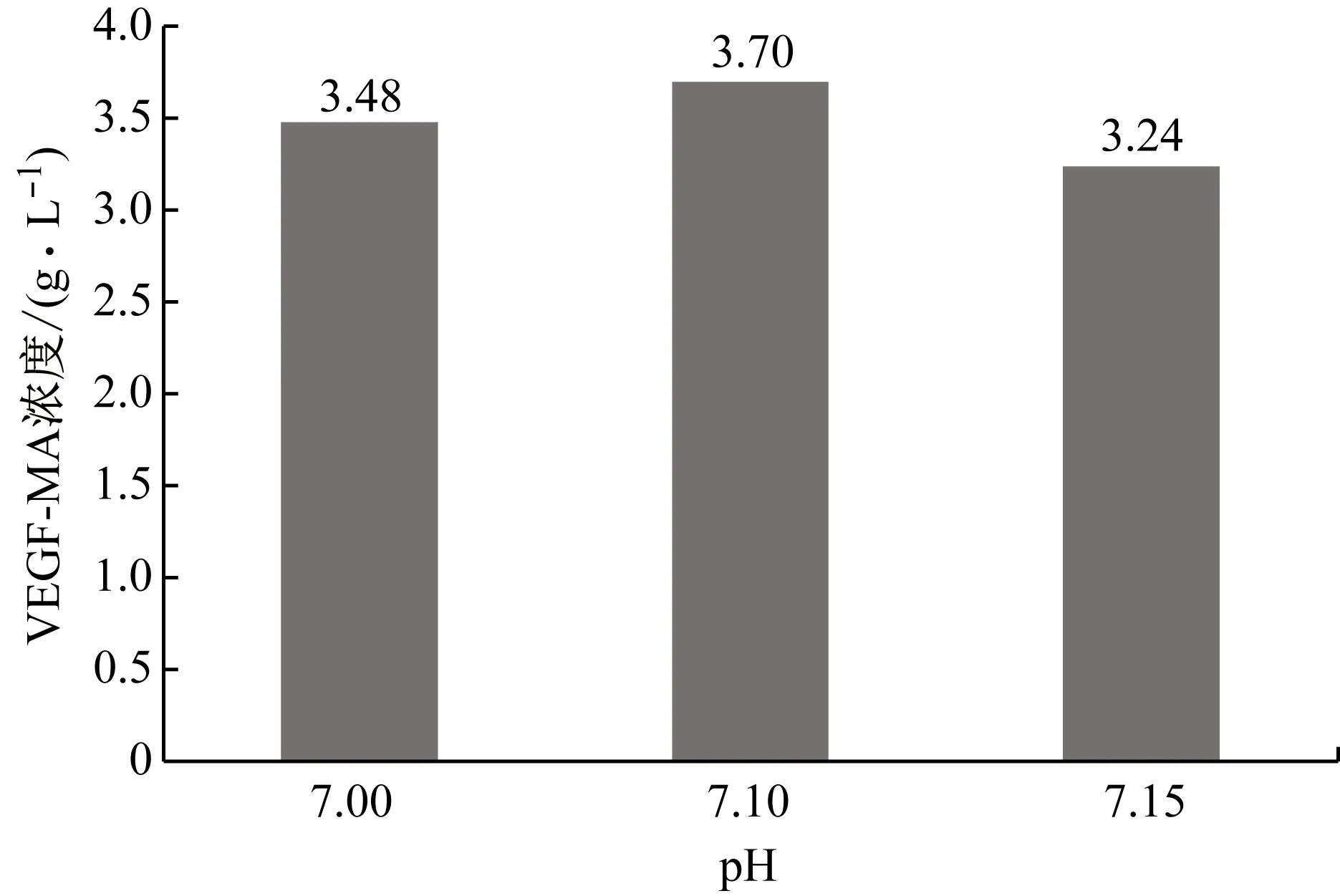
图6 不同pH条件下的VEGF-MA产量
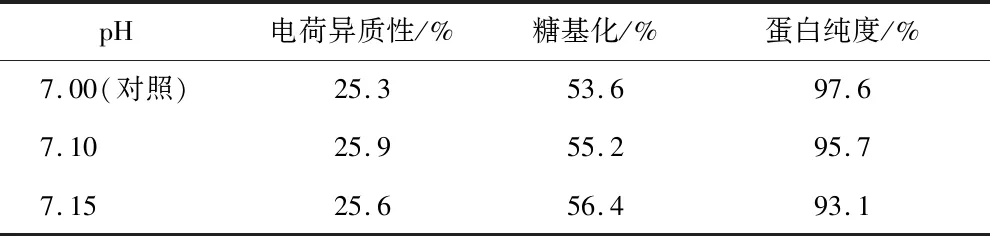
表9 不同pH条件下的VEGF-MA质量
2.2.3DO优化
对细胞培养过程中的DO进行优化,分别考察DO为20%(对照)、40%和80%条件下的VEGF-MA生产性能,VEGF-MA产量和质量和分别如图7和表10所示。从中可以看出,DO对VEGF-MA产量、蛋白异质性和糖基化水平并无显著影响,但DO为40%时VEGF-MA纯度最高。因此,在后续的研究中,均使用40%的DO水平。
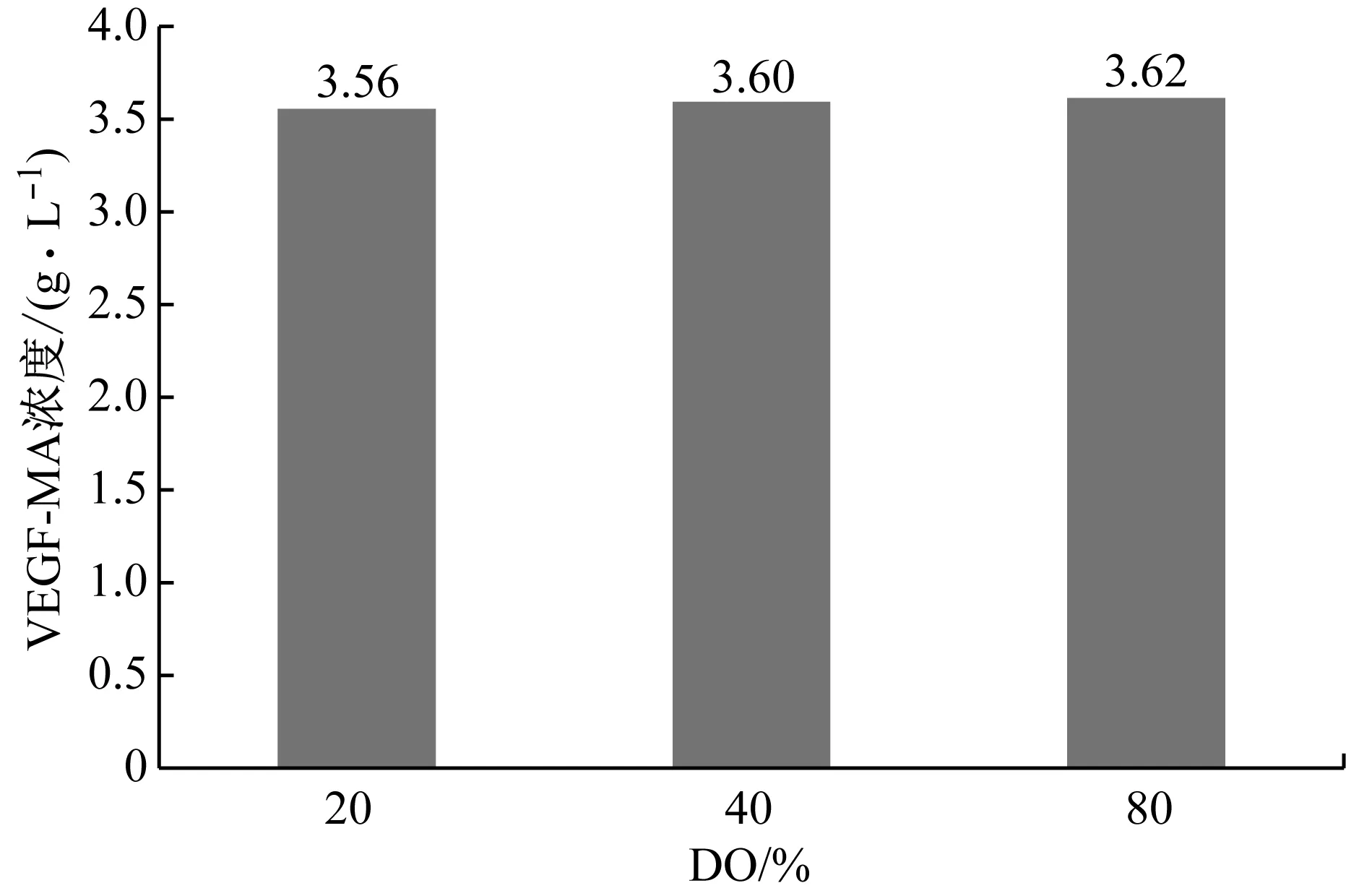
图7 不同DO条件下的VEGF-MA产量
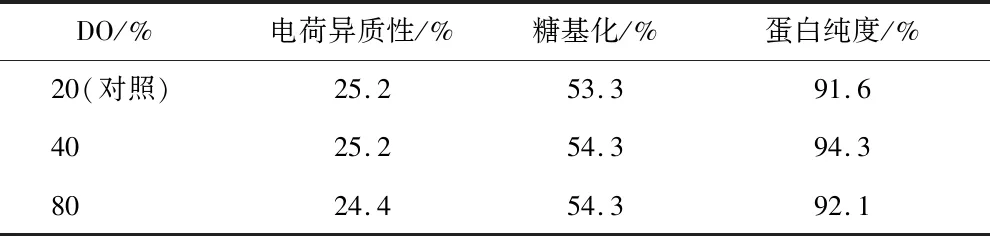
表10 不同DO条件下的VEGF-MA质量
2.2.4前期培养温度优化
在培养CHO细胞表达目的蛋白的过程中,培养前期通常采用较高的温度,而在培养后期适当降温,本研究首先对培养前期的温度进行优化。考察培养前期温度分别为36.0 ℃(对照)、36.5 ℃和37.0 ℃条件下VEGF-MA的生产性能,结果如图8和表11所示。36.5 ℃条件下,VEGF-MA浓度和纯度分别为3.26 g/L和96.6%,均高于其他两个批次。因此,在后续的研究中将继续采用36.5 ℃的前期培养温度。
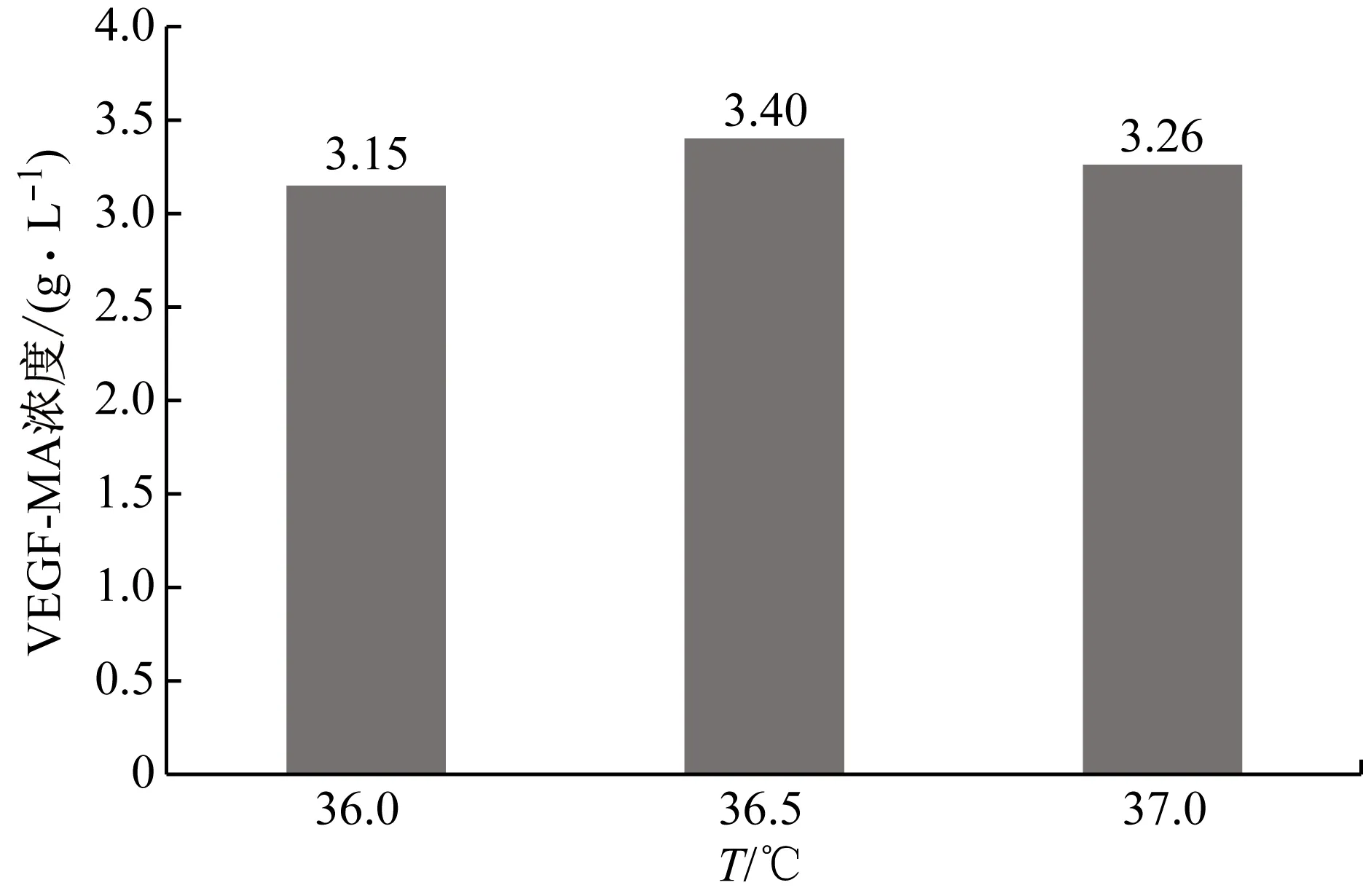
图8 不同前期培养温度条件下的VEGF-MA产量
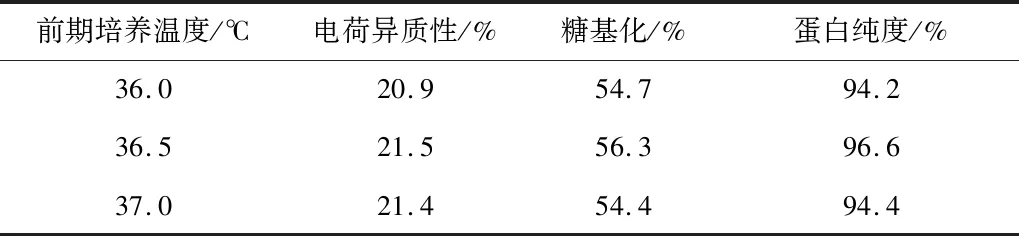
表11 不同前期培养温度条件下的VEGF-MA质量
2.2.5后期培养温度优化
对培养后期的温度进行优化。考察培养后期温度分别为32.0 ℃、33.0 ℃(对照)和34.0 ℃条件下VEGF-MA的生产性能,结果如图9和表12所示。后期培养温度为34.0 ℃时能够获得最高的VEGF-MA产量(4.10 g/L),而此时的VEGF-MA质量也能达到标准。因此可以确定,最佳的后期培养温度为34.0 ℃。
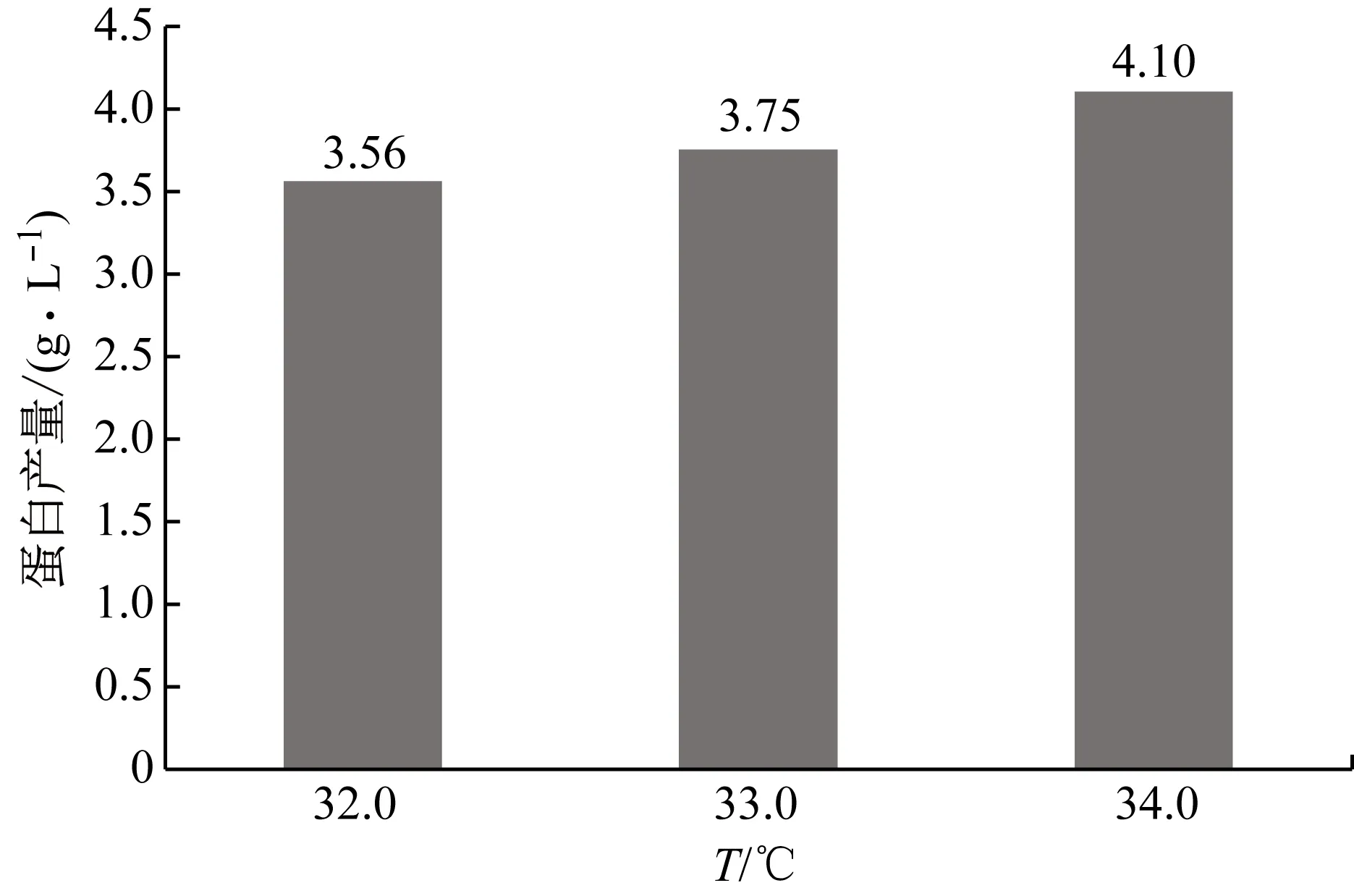
图9 不同后期培养温度条件下的VEGF-MA产量
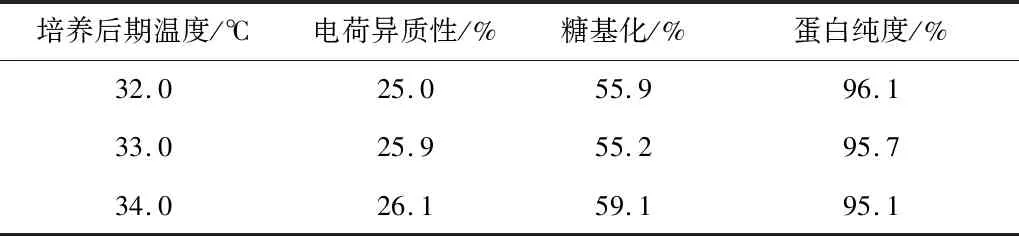
表12 不同后期培养温度条件下的VEGF-MA质量
3 结论
(1) 培养重组CHO细胞生产VEGF-MA的最优基础培养基、补料培养基和外源添加物分别为ActiCHO P Powder CD、CD Efficient Feed C AG和Sheff-CHO Plus PF ACF。在此条件下的VEGF-MA的产量为3.20 g/L。
(2) 3 L发酵罐下的最优培养条件:接种密度为1.0×106个/mL、pH为 7.10、溶解氧浓度为40%、前期培养温度为36.5 ℃、后期培养温度为34 ℃。在此条件下VEGF-MA的产量能够达到4.10 g/L的较高水平,且VEGF-MA质量较高。

