不同蛋白酶对灰树花蛋白的水解度及水解产物的抗氧化活性
杨明容 陈少美

摘 要:为明确不同蛋白酶对灰树花蛋白的水解度及水解产物的抗氧化活性,采用胃蛋白酶、胰蛋白酶、胃蛋白酶+胰蛋白酶、碱性蛋白酶、木瓜蛋白酶分别水解灰树花蛋白,并测定不同蛋白酶对灰树花蛋白水解产物的抗氧化活性。结果表明:5种蛋白酶对灰树花蛋白的水解度由高到低的顺序依次为碱性蛋白酶>胃蛋白酶+胰蛋白酶>胃蛋白酶>胰蛋白酶>木瓜蛋白酶,以碱性蛋白酶的水解度最高,水解度达35.48%;碱性蛋白酶、胃蛋白酶、胃蛋白酶+胰蛋白酶的水解产物抗氧化活性均随着浓度的增加而提高,相同浓度下3种蛋白酶中以碱性蛋白酶水解产物的抗氧化活性最强,当其浓度为0.5 mg·mL-1和1.0 mg·mL-1时,对DPPH自由基的清除率达90%以上,与对照Vc相当。
关键词:灰树花;蛋白;蛋白酶;水解产物;抗氧化活性
中图分类号:S646 文献标志码:A 文章编号:0253-2301(2020)02-0021-03
DOI:10.13651/j.cnki.fjnykj.2020.02.004
Abstract:In order to determine the hydrolysis degree of different proteases to the protein of Grifola frondosa and the antioxidant activity of the hydrolysates, the pepsin, trypsin, pepsin+trypsin, alkaline protease and papain were used to hydrolyze the protein of Grifola frondosa respectively, and the antioxidant activity of different proteases to the hydrolysates of the protein of Grifola frondosa was determined. The results showed that the hydrolysis degree of the five proteases to the protein of Grifola frondosa was from high to low in the order of alkaline protease>pepsin+trypsin>pepsin>trypsin>papain, and the hydrolysis degree of alkaline protease was the highest, reaching 35.48%. The antioxidant activity of the hydrolysates of alkaline protease, pepsin and pepsin+trypsin increased with the increase of concentration, and the antioxidant activity of the hydrolysates of alkaline protease was the strongest among the three proteases at the same concentration, when the concentration was 0.5 mg·mL-1 and 1.0 mg·mL-1, the clearance rate of DPPH free radical was more than 90%, which was similar to that of the control Vc.
Key words:Grifola frondosa;Protein;Protease;Hydrolysate;Antioxidant activity
灰樹花Grifola frondosa是一种隶属于多孔菌科、树花菌属的珍稀药、食两用真菌[1]。该菌多生长于高山阔叶林橡树、栗树或常绿针、阔混交林中,在我国的食用历史悠久,主要分布在河北、吉林、广西、四川等地[2]。灰树花富含优质蛋白、氨基酸、维生素、膳食纤维等,现代科学已从分子水平上证实了灰树花的营养保健功能及其药用价值[3-5]。蛋白质是灰树花中高含量的功能性成分,灰树花蛋白中含有18种氨基酸,其中8种是人体必需的氨基酸,特别是色氨酸含量很高,对于平衡人体的营养成分具有重要作用[6]。近年来,有研究表明灰树花中特定的蛋白组分还具有抗肿瘤[7]、抗病毒[8]、降血压[9]等功效。灰树花多糖的抗氧化作用已有报道[10],但灰树花蛋白水解产物的抗氧化活性鲜有研究。为此,笔者测定了不同蛋白酶对灰树花蛋白的水解度及水解产物的抗氧化活性,以期为灰树花蛋白的应用提供参考。
1 材料与方法
1.1 材料与试剂
灰树花蛋白(实验室自行制备);木瓜蛋白酶(800 U·Mg-1,上海源叶生物有限公司产品);碱性蛋白酶(200 U·mg-1,上海源叶生物有限公司产品);胰蛋白酶(250 U·mg-1,国药化学试剂产品);胃蛋白酶(1200 U·g-1,国药化学试剂产品);DPPH (Sigma公司产品)。
1.2 仪器与设备
高速冷冻离心机(美国贝克曼公司),细胞超声粉碎机(昆山市超声仪器有限公司),紫外分光光度计(北京普析通用仪器有限责任公司),冷冻干燥机(宁波新芝生物科技股份有限公司),pH 计(上海雷磁仪器厂),恒温磁力水浴锅(金坛江南仪器厂)。
1.3 试验方法
1.3.1 灰树花蛋白的制备 灰树花蛋白的制备参照陈少美等[11]的方法 。
1.3.2 灰树花蛋白水解物的制备 灰树花蛋白水解物的制备参照吴伟菁等[12]的方法。
1.3.3 蛋白酶水解度测定 采用胃蛋白酶、胃蛋白酶+胰蛋白酶、胰蛋白酶、木瓜蛋白酶和碱性蛋白酶分别对灰树花蛋白进行酶解。蛋白酶对灰树花蛋白的水解度测定采用甲醛滴定法[13] 。
1.3.4 灰树花蛋白水解产物的抗氧化活性测定 称取一定量的DPPH,用无水乙醇将其配制成浓度为0.04 mg·mL-1的溶液。分别量取2 mL不同浓度(0.1、0.5、1.0 mg·mL-1)的蛋白酶溶液(碱性蛋白酶、胃蛋白酶+胰蛋白酶、胃蛋白酶),加入2 mL DPPH溶液,混合均匀,10000 r·min-1离心20 min(10℃),取上清液测定在517 nm处的吸光值为A1;同时,分别在2 mL不同浓度的蛋白酶溶液中加入2 mL无水乙醇,测定吸光值为A2;2 mL DPPH溶液中加入2 mL无水乙醇,测得的吸光值为A0。Vc作为阳性对照。样品对DPPH自由基的清除率用以下公式计算:
DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100
1.3.5 数据统计与分析 试验数据采用SPSS 24.0软件进行处理与分析,采用单因素方差分析,应用LSD法进行多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 不同蛋白酶对灰树花蛋白的水解度
从表1可看出,不同蛋白酶对灰树花蛋白的水解度由高到低的顺序依次为:碱性蛋白酶>胃蛋白酶+胰蛋白酶>胃蛋白酶>胰蛋白酶>木瓜蛋白酶,碱性蛋白酶对灰树花蛋白的水解度最高(35.48%),木瓜蛋白酶对灰树花蛋白的水解度最低(7.72%),其他蛋白酶的水解度介于两者之间。
2.2 灰树花蛋白水解产物的抗氧化活性
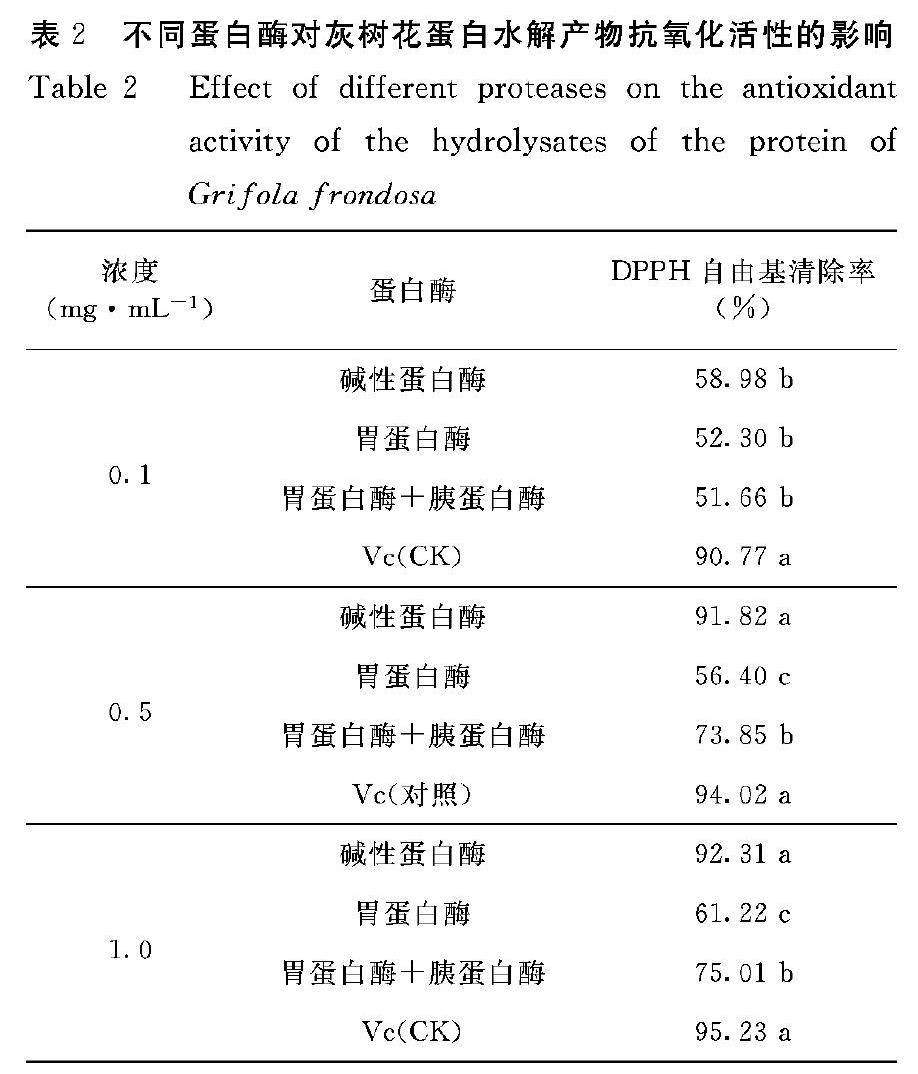
DPPH是一种很稳定的以氮为中心的自由基,其乙醇溶液呈紫色,在517 nm 处具有特征吸收峰,若测试物能将其清除,则表示测试物具有降低羟自由基、烷自由基或氧化自由基、打断脂质过氧化链反应的抗氧化活性。根据不同蛋白酶对灰树花蛋白的水解度大小,分别对水解度较高的3种蛋白酶(碱性蛋白酶、胃蛋白酶+胰蛋白酶、胃蛋白酶)进行了抗氧化活性测定(表2)。从表2可看出,不同蛋白酶对灰树花蛋白水解产物清除DPPH自由基的能力存在差异,同种蛋白酶水解产物对DPPH 自由基的清除率随着浓度的增加而提高。相同浓度下,3种蛋白酶中以碱性蛋白酶水解产物对DPPH自由基的清除率最高,当其浓度为0.5 mg·mL-1和1.0 mg·mL-1时,清除率达90%以上,与对照Vc相当。
3 讨论与结论
本研究结果表明,5种不同蛋白酶对灰树花蛋白的水解能力存在一定差异,其水解度由高到低的顺序依次为:碱性蛋白酶>胃蛋白酶+胰蛋白酶>胃蛋白酶>胰蛋白酶>木瓜蛋白酶,以碱性蛋白酶对灰树花蛋白的水解能力最强,其水解度达35.48%,木瓜蛋白酶的水解度最低(7.72%)。存在这种现象的原因可能在于碱性蛋白酶的水解位点较多,而木瓜蛋白酶对底物具有特异性选择。
DPPH自由基的清除能力可能与疏水性氨基酸的含量高低有关,良好的DPPH自由基清除活性往往伴随着高含量的疏水性氨基酸或肽[14-15]。本研究中,碱性蛋白酶、胃蛋白酶及胃蛋白酶+胰蛋白酶3种蛋白酶的水解产物均具有一定抗氧化活性,且抗氧化活性随着蛋白酶浓度的增加而提高。在相同浓度下,以上3种蛋白酶中以碱性蛋白酶水解产物的抗氧化活性最强,当其浓度为0.5 mg·mL-1和1.0 mg·mL-1时,对DPPH自由基的清除率高达90%以上,与对照Vc相当。由于碱性蛋白酶的切割位点为疏水性氨基酸,因此这可能是其对DPPH自由基清除效果较佳的主要原因。由于酶解反应具有复杂性,本研究涉及的蛋白酶水解产物的具体组成、结构等尚未明确,仍需进一步研究。
参考文献:
[1]刘佳,包海鹰,图力古尔.灰树花化学成分及药理活性研究进展[J].菌物研究,2018,16(3):150-157.
[2]韩省华,林胜龙,张东平.灰树花在百山祖山区的发生及其规律[J].食药用菌,1994,13(2):36.
[3]于荣利,张桂灰,秦旭升.灰树花研究进展[J].上海农业学报,2005,21(3):101-105.
[4]甘长飞.灰树花及其药理作用研究进展[J].食药用菌,2014,22(5):264-267.
[5]吴智艳,闫训友.灰树花生理活性物质的研究进展[J].北方园艺,2006(6):174-175.
[6]陈贵堂,王丽敏,姚舒愉,等.灰树花子实体多糖和蛋白的同步提取工艺优化[J].食品科技,2014,39(7):248-251,257.
[7]KODAMA N,MIZUNO S,NANBA H,et al.Potential antitumoractivity of a lowmolecularweight protein fractionfrom Grifola frondosa through enhancement of cytokine production[J].Journal of MedicinalFood,2010,13(1):20-30.
[8]GU C Q,LI J W,CHAO F,et al.Isolation,identification and function of a novel antiHSV1 protein from Grifola frondosa[J].Antiviral Research,2007,75(3):250-257.
[9]CHOI H S,CHO H Y,YANG H C,et al.Angiotensin Iconverting alzyme inhibitor from Grifola Frondosa[J].Food Research International,2001,34:177-182.
[10]孙欣怡.灰树花胞外多糖和胞内锌多糖的提取优化及抗氧化研究[D].泰安:山东农业大学,2014.
[11]陈少美,薛小兰.菌草灰树花蛋白质提取工艺优化研究[J].福建农业科技,2018(2):30-32.
[12]吴伟菁,纪美茹,李再贵.不同苦荞蛋白酶解产物抗氧化活性研究[J].粮油食品科技,2018,26(5):6-10.
[13]姚玉静,崔春,邱李平,等.pHstat法和甲醛滴定法测定大豆蛋白水解度准性比较[J].食品工业科技,2008(9):268-270.
[14]RAJAPAKSE N,MENDIS E,JUNG W K,et al.Purification of a radical scavenging peptide from fermented mussel sauce andits antioxidant properties[J].Food Research International,2005,38(2):175-182.
[15]WANG J S,ZHAO M M,ZHAO Q Z,et al.Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J].Food Chemistry,2007,101(4):1658-1663.
(責任编辑:林玲娜)

