胃底腺癌11例临床病理分析*
张 静 刘 鑫 张贺军 丁士刚
(北京大学第三医院消化科,北京 100191)
胃底腺癌(gastric adenocarcinoma of the fundic gland type,GA-FG)由日本肿瘤病理学者Tsukamoto等[1]于2007年首次报道,日本消化学者Ueyama等[2]于2010年建议单独列为胃腺癌中的一种新类别。胃底腺癌作为一种罕见的泌酸黏膜肿瘤,具有特殊的临床病理特征,国内报道很少。胃底腺癌的诊断有赖于组织病理学,治疗尚无统一意见,大多数病灶行内镜下切除即可,也有进展为具有转移潜能的侵袭性肿瘤的个案报道[3],因此,临床上需要增加对该类肿瘤的认识。2016年3月~2019年3月,我院经内镜黏膜下剥离切除术(endoscopic submucosal dissection,ESD)病理诊断胃底腺癌11例,本研究回顾性分析此11例临床特点及内镜病理特征。
1 临床资料与方法
1.1 一般资料
本组11例,男4例,女7例。年龄55~80(63.9±8.0)岁。体检行白光内镜检查发现4例,腹痛2例,上腹不适2例,纳差1例,烧心嗳气2例。1例有胃癌家族史。腹部查体1例有剑突下轻压痛,余均正常。
血红蛋白121~149(138.2±9.3)g/L(0例<120 g/L),白蛋白38.6~48.4(43.5±2.5)g/L(1例<40 g/L);甲胎蛋白(alpha fetoprotein,AFP)1.99~5.64(3.51±1.26)ng/ml(0例>20 ng/ml),癌胚抗原(carcinoembryonic antigen,CEA)0.95~4.66(2.53±1.22)ng/ml(0例>5 ng/ml),糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)0.60~35.23(11.83±10.89)U/ml(0例>39 U/ml),7例女性的糖类抗原125(carbohydrate antigen 125,CA125)7.54~14.04(10.62±1.99)U/ml(0例>35 U/ml)。
1.2 方法
查阅11例ESD内镜图像资料:①由一名副主任医师依据2002年巴黎分型[4]明确病灶形态,将胃底腺癌形态分为Ⅰ型、Ⅱa型、Ⅱb型。其中Ⅰ型指隆起型病灶且高度超过闭合的活检钳(2.5 mm),Ⅱa型指浅表隆起型病灶且高度小于闭合的活检钳(2.5 mm),Ⅱb型指浅表平坦型病灶。②记录白光内镜下病灶部位、长径、色泽、质地(活检钳触碰病灶)等情况。③记录超声内镜下病灶回声和来源。④记录富士公司智能分光比色内镜(Fuji intelligent chromo endoscopy, FICE)下小凹结构。
依据内镜下切除术后病理诊断结果,将胃底腺癌分为黏膜内癌和黏膜下层癌。记录长径、有无幽门螺杆菌(Helicobacterpylori,HP)感染、Ki67等情况。
2 结果
2.1 内镜特征(图1)
2.1.1 白光内镜 病灶均为单发,长径6~10(7.9±1.1)mm。病灶位于贲门2例,胃底6例,胃体1例,胃角1例,胃窦1例。质软8例,质硬2例,1例质地不详。色泽同周围黏膜3例,色红6例,苍白2例。黏膜表面光滑4例,不平7例(2例绒毛状不平)。病灶形态Ⅰ型3例,Ⅱa型7例,Ⅱb型1例。
2.1.2 超声内镜 5例行超声内镜检查。低回声3例,中低回声2例。累及黏膜层4例,累及局灶黏膜下层1例。
2.1.3 FICE 8例行FICE检查。小凹规整2例,不规整6例。
2.2 病理特征(图2)
11例胃底腺癌均在我院行ESD及病理诊断。长径3~7(4.7±1.7)mm。病灶类型:主细胞样细胞增多2例,主细胞样腺瘤性增生1例,主细胞癌1例,余7例不详。浸润深度:累及黏膜层5例,累及黏膜下层4例,2例不详。HP阴性10例,阳性1例。Ki67极少数(+)1例,5%(+)3例,10%(+)5例,20%(+)1例,40%(+)1例。
3 讨论
胃癌是我国常见的恶性肿瘤,其发病率在男性中居第2位、女性中居第3位,其病死率在男性和女性中均居第2位[5]。随着免疫组化等技术的发展,对肿瘤细胞表型分类的划分更为精细。Tsukamoto等[1]于2007年报道了第1例具有主细胞表型的胃腺癌,Ueyama等[2]于2010年建议将胃底腺癌作为一种新的胃癌类型。按照泌酸腺体的分化特征,胃底腺癌可分为三类:主细胞为主型、壁细胞为主型和混合型,且对主细胞为主型(gastric adenocarcinoma of the fundic gland chief cell predominant type,GA-FG-CCP)报道最多。目前国外对于胃底腺癌的独特临床病理特征已有报道[1,2,6~9](表1),国内尚缺乏相关研究。本文通过回顾性收集我院胃底腺癌的资料,结合相关文献,以期增加临床医师对该疾病的认识。
胃底腺癌的发病机制不详。不同于慢性胃炎-萎缩-肠上皮化生-异型增生-肠型胃癌的组织学进展过程[10],胃底腺癌更多源自非萎缩、无慢性炎症的深层胃黏膜,而且与幽门螺杆菌感染无明显关系。在分泌性卷曲相关蛋白(secreted frizzled-related protein,SFRP)等相关基因甲基化的介导下,Wnt/β-连环蛋白信号通路的异常激活被认为与胃底腺癌的形成有关。正常情况下,β-连环蛋白在含糖原合成酶激酶3b(glycogen synthase kinase 3β,GSK3b)、轴抑制蛋白(axis inhibition protein,AXIN)的复合物作用下发生磷酸化并被蛋白酶体降解,当Wnt与细胞表面受体结合并活化时,GSK3b会从该复合物中分离,使β-连环蛋白聚集并转移至细胞核内启动靶基因的转录。SFRP通过与Wnt竞争结合受体来下调Wnt信号。甲基化使该拮抗功能丧失,利于β-连环蛋白的积聚,使大量靶基因不适当转录进而易于形成肿瘤[6]。Hidaka等[11]观察到AXIN和CTNNB1在胃底腺癌中更易出现错义突变或无义突变,提示Wnt/β-连环蛋白通路激活。此外,GNAS突变也可以作为一种替代机制引起Wnt/β-连环蛋白信号激活[7]。
本组胃底腺癌女性稍多(7/11),年龄(63.9±8.0)岁。缺乏特异性临床表现,以体检偶然发现居多(4/11),营养指标和肿瘤标志物无异常。Ueyama等[2]报道GA-FG-CCP以男性居多(6/10),平均年龄65.5岁,随访至少10个月未出现死亡。Chiba等[8]同样指出GA-FG-CCP以男性患者居多,占80%(16/20),年龄(68.8±2.0)岁。可见,胃底腺癌好发于中老年人,预后好。分析性别比不同的原因,可能与胃底腺癌罕见而致样本量少有关。
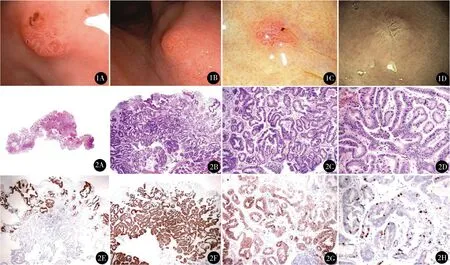
图1 胃底腺癌的内镜表现:A.贲门下穹窿部可见Ⅱa型病变,类圆形,大小约0.6 cm,色偏红,表面欠光整,小凹结构规整,活检质软,易出血;B.贲门下方小弯前壁侧见Ⅱa型病变,0.6 cm×0.8 cm,表面不平,上皮结构略不规则,未见血管扭曲;C.胃底穹窿部可见Ⅱa型病变,中心略凹陷(活检后改变),1.0 cm×0.8 cm,蓝激光内镜观察迂曲扩张的血管显露,局部表面结构消失,小凹结构欠清晰、略紊乱;D.胃体下部前壁可见Ⅱa型病变,中心浅糜烂(既往活检所致),0.8 cm×0.7 cm,FICE可见表面增粗树枝状血管 图2 胃底腺癌的病理表现:A~D.HE染色(A.×40,B.×100,C.×200,D.×400),组织内见胞浆弱嗜酸性,胞核稍增大、大小略不一致、核浆比增大的上皮细胞增生,可见假复层结构,所构成的腺体排列密集、形态不规则,结构紊乱较明显,黏膜肌内可见肿瘤细胞,病变符合胃底腺型胃癌表现,病变光镜下最长径约7 mm;E~H.免疫组化(E.×100,F.×100,G.×200,H.×400),E.Muc-5AC(-),F.Muc-6(+),G.Syn弱(+),H.Ki67阳性率约10%
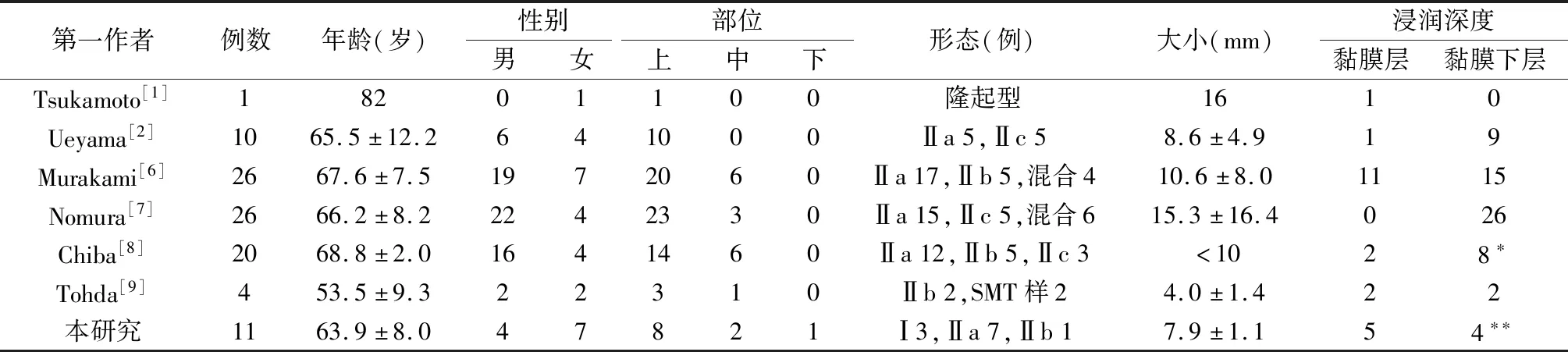
表1 文献报道的胃底腺癌特征
*该研究中仅有9例10处病灶行ESD,余者定期内镜随访
**本研究2例病灶的浸润深度不详
SMT:黏膜下肿物
在内镜特征方面,本组胃底腺癌均为单发,绝大多数位于贲门(2例)和胃底部(6例),胃镜下肿瘤小(≤1 cm),以隆起型病灶最为多见。Chen等[12]报道1例罕见的多发胃底腺癌,其临床病理特征与单发病灶基本一致。Ueyama等[2]报道2004~2009年东京顺天堂大学附属医院10例GA-FG-CCP,病灶全部位于胃上部,肿瘤平均8.6 mm,Ⅱa型与Ⅱc型各5例。Tohda等[9]报道2010~2014年胃底腺癌4例,其中3例位于胃上部,内镜下长径<5 mm,2例呈黏膜下肿物(submucosal tumor,SMT)样,2例Ⅱb型。Chiba等[8]报道2011~2014年日本宫城癌症协会20例GA-FG-CCP,70%(14例)位于胃上部,60%(12例)呈Ⅱa型,其中10例拒绝ESD而行定期内镜随访(17.3±1.9)月,未见病灶形态有明显变化。综合上述研究,胃底腺癌多数位于胃上部,常见隆起型形态,体积小且生长相对缓慢。此外,由于肿瘤细胞定位于黏膜深层,其上覆盖有非肿瘤性上皮细胞,所以病灶色泽多与周围黏膜相同,也可呈褪色样改变。
当内镜下见有上述特征的病灶时,需要鉴别其他疾病:对于褪色病变,需要鉴别未分化腺癌、黏膜相关淋巴组织淋巴瘤、萎缩性胃炎;对于SMT样病变,需考虑类癌的可能性。在良性胃息肉样病变中,增生性息肉和炎症性息肉倾向于胃内各部分均匀分布[13],其发生可能与HP相关的炎症有关,而胃底腺息肉的多发比例高于增生性息肉[13],其发生与质子泵抑制剂的长期应用和胃泌素升高有关。对于胃底腺癌与传统胃腺癌的鉴别,需要免疫组化的结果进行区分,如主细胞表达胃蛋白酶原Ⅰ,壁细胞表达H+/K+-ATP酶α亚基,黏液颈细胞和幽门腺表达MUC6等,尤以胃蛋白酶原Ⅰ对胃底腺癌诊断相对特异且在胃癌中表达较少[2]。
在病理特征方面,本组胃底腺癌病灶多累及黏膜层(5/11)或黏膜下层(4/11),Ki67指数低[≤10%(+)占9/11],大部分(10/11)无幽门螺杆菌感染。GA-FG-CCP的肿瘤细胞源自主细胞,其主要位于胃底腺体底部,因此可在早期即浸润至黏膜下层,但病灶本身生长缓慢,极少侵犯淋巴血管发生转移[14]。多项国外研究[1,10,12]表明胃底腺癌Ki67在10%以内,提示生长缓慢、侵袭性小。然而,Okumura等[3]2018年报道首例发生淋巴结转移的GA-FG,证实GA-FG可能发展为具有转移潜能的侵袭性肿瘤。目前对于此类病灶的治疗尚无统一意见,单纯内镜随访可能存在肿瘤进展风险,大多数病灶可行内镜下切除,甚至极少数患者可能需要接受外科手术。此外,GA-FG可产生自无HP感染的胃黏膜,也可产生自HP根除后的萎缩黏膜,这与肠型胃癌和弥漫型胃癌与HP感染的关系存在很大差别。Ishibashi等[15]的研究显示HP根除能通过使胃底腺数量减少、胃小凹上皮变薄进而影响GA-FG的外观,在放大内镜联合窄带成像下病灶呈现出枯树枝样锥形血管改变。
综上所述,胃底腺癌是一种罕见疾病,缺乏特殊的临床表现,多在胃镜体检时偶然发现。对于胃上部隆起型小病灶,需考虑到胃底腺癌的可能,进一步确诊需要依靠组织病理检查。总结现有文献资料,提示内镜下切除是治疗该疾病的有效方法,并建议定期内镜随访,目前尚无死亡病例报道。

