丹参二萜醌类活性成分通过PKCδ/PKD1μ 信号通路抗胰腺癌作用研究
叶晓鸥
目前,胰腺癌唯一的治愈手段为手术切除[1],但由于患者确诊时,体内常伴有胰腺癌细胞的浸润和转移,手术切除往往无法完全根治[2]。吉西他滨配合化疗是胰腺癌的主要治疗方式,但化疗耐药会阻碍吉西他滨发挥药效[3]。在临床上丹参二萜醌类被用来治疗心血管疾病[4],且其化合物能够诱导肿瘤细胞的凋亡[5]。本研究观察丹参二萜醌类化合物隐丹参酮、丹参新酮、去氢丹参新酮抗胰腺癌AsPC-1,BxPC-3细胞的作用机制。
1 材料与方法
1.1 材料 胰腺癌AsPC-1 细胞、BxPC-3 细胞均采购于中科院上海细胞所。隐丹参酮(cryptotanshinone,CPT)分子式为C19H20O3,相对分子质量296.35,采购于Selleck(中国上海蓝木化工有限公司)(批次S 228502)。丹参新酮(miltirone)分子式为C19H22O2,相对分子质量282.382,由浙江省中医院中心实验室尹一飞老师馈赠。去氢丹参新酮(dehydromiltirone)分子式为C19H20O2,相对分子质量280.367,由浙江省中医院中心实验室尹一飞老师馈赠。
1.2 细胞培养 胰腺癌AsPC-1 和BxPC-3 细胞用含10% gibco 胎牛血清RPMI1640 培养液,置于37℃、5% CO2、饱和湿度的培养箱中常规培养。
1.3 CCK-8 法检测细胞增殖能力 常规培养胰腺癌AsPC-1 和BxPC-3 细胞,并按照不同浓度的隐丹参酮(0、5、10、15、30、50μM)、丹参新酮(0、5、10、15、20、30μM)、去氢丹参新酮(0、5、10、15、20、30μM)分别进行处理。加入CCK-8 并在培养箱中孵育后,检测吸光度值(OD 值),并计算细胞存活率。
1.4 PI/Annexin-V 流式细胞术检测细胞凋亡 按照AsPC-1 组和BxPC-3 组进行分组,组内分别设置有空白对照组、隐丹参酮组(30μM)、丹参新酮组(15μM)、去氢丹参新酮组(15μM),分别作用于对数生长期的胰腺癌AsPC-1 和BxPC-3 细胞24h,经AnnexinV-FITC/PI 染色后,流式细胞仪检测细胞凋亡情况。
1.5 Western blot 检测PKC 同工酶磷酸化 隐丹参酮组(30μM)和空白对照组;丹参新酮组(15μM)和空白对照组;去氢丹参新酮组(15μM)和空白对照组分别作用于对数生长期的胰腺癌AsPC-1 和BxPC-3细胞4h 后,收集细胞提取细胞总蛋白Western blot检测PKC 信号通路相关位点的磷酸化水平。
1.6 SiRNA 转染 对AsPC-1 和BxPC-3 细胞进行siRNA 转染,以沉默PKCδ。转染后siRNA 的阴性对照组为si-nc 组,成功沉默PKCδ thr505 位点的细胞设置为siRNA 组,并将未经任何处理的的细胞设置为空白组(con)。按照上述分组分别将处于对数期的细胞接种于6 孔板中于细胞培养箱中培养4h 后,收集细胞提取细胞总蛋白Western bloting 法检测PKCδ thr505、PKD1 ser744/748 位点的磷酸化情况。
1.7 统计学方法 应用SPSS 19.0 统计软件进行数据分析,实验数据以均数±标准差表示,采用单因素方差分析及Dunnett t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 隐丹参酮、丹参新酮、去氢丹参新酮显著抑制胰腺癌AsPC-1 和BxPC-3 细胞增殖 不同浓度的隐丹参酮(0、5、10、15、30、50μM)、丹参新酮(0、5、10、15、20、30μM)、去氢丹参新酮(0、5、10、15、20、30μM)作用对数生长期的胰腺癌AsPC-1、BxPC-3、Panc-1、MIAPaCa-2 细胞24h 后CCK-8 法检测细胞存活率。结果显示,隐丹参酮浓度为30μM 时AsPC-1 细胞存活率为(40.1±5.0)%,BxPC-3 细胞存活率为(36.2±5.4)%,Panc-1 细胞存活率为(89.3±6.5)%,MIAPaCa-2 细胞存活率为(92.2±4.9)%;丹参新酮浓度为15μM 时AsPC-1 细胞存活率为(52.1±5.1)%,BxPC-3 细胞存活率为(47.2±5.7)%,Panc-1 细胞存活率为(95.3±5.5)%,MIAPaCa-2 细胞存活率为(93.2±5.9)%;去氢丹参新酮为15μM 时AsPC-1 细胞存活率为(46.1±5.0)%,BxPC-3 细胞存活率为(42.2±5.4)%,Panc-1 细胞存活率为(92.3±4.8)%,MIAPaCa-2 细胞存活率为(91.2±4.3)%。上述实验结果表明,隐丹参酮、丹参新酮、去氢丹参新酮对As-PC-1、BxPC-3 细胞增殖有明显的抑制作用,且呈浓度及时间依赖性(P<0.01)。
2.2 隐丹参酮、丹参新酮、去氢丹参新酮显著促进胰腺癌AsPC-1 和BxPC-3 细胞凋亡发生 按照As-PC-1 组和BxPC-3 组进行分组,组内分别设置有空白对照组、隐丹参酮组(30μM)、丹参新酮组(15μM)、去氢丹参新酮组(15μM),分别作用于对数生长期的胰腺癌AsPC-1 和BxPC-3 细胞24h,经AnnexinV-FITC/PI 染色后,流式细胞仪检测细胞凋亡情况。结果显示,空白对照组、隐丹参酮组、丹参新酮组、去氢丹参新酮组分别作用于对数生长期的胰腺癌AsPC-1 细胞24h,细胞的凋亡率分别为(4.6±3.4)%、(29.1±4.6)%、(50.3±7.1)%、(41.2±4.3)%;空白对照组、隐丹参酮组、丹参新酮组、去氢丹参新酮组分别作用于对数生长期的胰腺癌BxPC-3 细胞24h,细胞凋亡率分别为(5.3±4.8)%、(29.5±4.2)%、(32.1±5.4)%、(51.9±4.5)%。上述实验结果表明,相对于空白对照组,隐丹参酮组、丹参新酮、去氢丹参新酮均能显著促进胰腺癌AsPC-1 和BxPC-3 细胞凋亡发生,且差异有显著统计学意义(P<0.01)。
2.3 隐丹参酮、丹参新酮、去氢丹参新酮显著抑制胰腺癌AsPC-1 和BxPC-3 细胞PKD1 ser916、PKCδ thr505、PKD1 ser744/748 位点的磷酸化 隐丹参酮组(30μM)和空白对照组;丹参新酮组(15μM)和空白对照组;去氢丹参新酮组(15μM)和空白对照组分别作用于对数生长期的胰腺癌AsPC-1 和BxPC-3细胞4h 后,收集细胞提取细胞总蛋白Western blot法检测PKC 信号通路相关位点的磷酸化水平。结果显示,隐丹参酮组、丹参新酮组、去氢丹参新酮组PKD1 ser916、PKCδ thr505、PKD1 ser744/748 位点的磷酸化水平均下调,其它PKC 蛋白磷酸化水平未发生明显变化(见图1)。
2.4 隐丹参酮、丹参新酮、去氢丹参新酮均能在1h内显著抑制胰腺癌AsPC-1 和BxPC-3 细胞PKCδ thr505、PKD1 ser744/748 位点磷酸化 隐丹参酮组(30μM)、丹参新酮组(15μM)、去氢丹参新酮组(15μM)分别按照0、30min、1、2、4h 的时间梯度作用于对数生长期的胰腺癌AsPC-1 和BxPC-3 细胞,收集细胞提取细胞总蛋白Western blot 法检测PKCδ thr505、PKD1 ser744/748 位点的磷酸化情况。结果显示,隐丹参酮下调AsPC-1 细胞PKCδ thr505、PKD1 ser744/748 位点磷酸化在作用2h 后效果显著,对BxPC-3 细胞p-PKCδ thr505、p-PKD1 ser744/748 的下调作用则在30min~1h 时有明显效果;丹参新酮、去氢丹参新酮则均能在1h 显著抑制胰腺癌AsPC-1和BxPC-3 细胞PKCδ thr505、PKD1 ser744/748 位点磷酸化(见图2)。
2.5 SiRNA 沉默处理胰腺癌AsPC-1 和BxPC-3 细胞PKCδ 后,PKD1 ser744/748 位点磷酸化水平明显下调 对AsPC-1 和BxPC-3 细胞进行siRNA 转染,以沉默PKCδ。转染后siRNA 的阴性对照组为si-nc组,成功沉默PKCδ thr505 位点的细胞设置为siRNA 组,并将未经任何处理的细胞设置为空白组(con)。按照上述分组分别将处于对数期的细胞接种于6 孔板中于细胞培养箱中培养4h 后,收集细胞提取细胞总蛋白Western bloting 法检测PKCδ thr505、PKD1 ser744/748 位点的磷酸化水平。结果显示,siRNA 沉默胰腺癌AsPC-1、BxPC-3 细胞PKCδ 后,胰腺癌AsPC-1、BxPC-3 细胞PKD/PKCμ ser744/748 的磷酸化水平下调(见图3)。

图1 Western blot 实验检测PKC 相关位点磷酸化水平

图2 Western blot 检测PKCδ 和PKD1 磷酸化水平
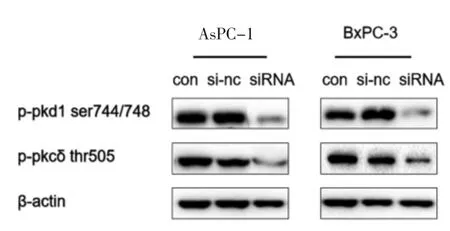
图3 Western blot 检测经过siRNA 转染后AsPC-1、BxPC-3细胞PKC 相关位点磷酸化水平
3 讨论
蛋白激酶C(protein kinase C,PKC)是一组由单一多肽链组成的磷脂依赖性Ca2+激活的蛋白丝氨酸/苏氨酸。前期实验和文献调研发现,PKC 在调控细胞增殖、分化、凋亡以及血管形成等诸多方面都起到重要作用,研究表明,PKC 能够被具有促肿瘤增殖作用的佛波脂所激活,提示PKC 在肿瘤的增殖过程中可能起重要作用,因此被认为可能是肿瘤治疗中的一个新靶点[6]。研究表明,PKCδ 特异性抑制剂能显著性抑制胰腺癌Panc-l 和结肠癌HT29 细胞的肿瘤再增殖;PKCα 调节的肝癌细胞、乳腺癌细胞的侵袭转移能力通过p38 信号通路介导[7];PKCβII 选择性抑制剂betalIV5-3 能够减少人前列腺癌内皮细胞增殖和血管生成[8];而PKCδ 的激活则引起促进肿瘤形成的SHH 信号通路及非经典的Writ 信号通路的活化[9]。
文献报道,PKD/PKCμ SER916 位点可以作为监测PKD 活性的指标[10],当p-PKD/PKCμ SER916 的表达受到抑制时,p-PKCδ thr505/p-PKD1 ser744/748 的表达会同时受到抑制。实验结果显示,隐丹参酮(30μM)、丹参新酮(15μM)、去氢丹参新酮(15μM)分别作用于胰腺癌AsPC-1 和BxPC-3 细胞24h 后,p-PKD1 SER916 的水平均有下调,以此推测p-PKCδ thr505/p-PKD1 ser744/748 信号通路在该过程中发挥作用。后续实验证明,p-PKCδ 水平受到抑制,并因此下调PKD1 ser744/748 的磷酸化。
综上所述,隐丹参酮、丹参新酮、去氢丹参新酮均能抑制p-PKCδ thr505 的表达,继而p-PKD/PKCμ ser744/748 表达下调,从而显著促进胰腺癌AsPC-1 和BxPC-3 细胞凋亡发生。已有文献报道PKD1 ser744/748 的磷酸化可以调控JNK 信号通路[11],因此推测隐丹参酮、丹参新酮、去氢丹参新酮通过调控PKD1-JNK 信号通路,抑制胰腺癌AsPC-1 和Bx-PC-3 细胞的增殖。

