丛生蛋白异常表达对子宫内膜癌早期诊断的意义
胡庆伟 邓再兴 吴雯君 王培丽
子宫内膜癌是在无孕激素拮抗的雌激素长期作用下,子宫内膜发生增生、不典型增生继而癌变,这是一个长期的细胞生物学行为由正常演变为异常的过程。子宫内膜癌除了有年轻化的趋势,2008 年后更已成为发病率最高的女性生殖道恶性肿瘤[1]。早期的子宫内膜癌预后较好,晚期则出现贫血、消瘦及恶病质,对各种治疗不能满意。丛生蛋白(clusterin,CLU)与多种肿瘤关系密切,参与一些肿瘤的形成,但在子宫内膜癌前病变特别是早期癌变方面研究较少[2]。本研究检测CLU 在子宫内膜各种病变组织表达,探讨其在预警子宫内膜癌前病变和早期癌变的价值,报道如下。
1 资料与方法
1.1 一般资料 收集2016 年6 月—2017 年12 月浙江省湖州市妇幼保健院就诊妇科病患者的子宫内膜作为研究对象,经病理诊断分两组。研究组53 例,其中子宫内膜不典型增生28 例,子宫内膜癌25 例;对照组57 例,其中正常子宫内膜28 例,子宫内膜非不典型增生29 例。子宫内膜不典型增生根据显微镜下病变的范围分为局限型16 例和弥漫型12 例(局限型病变≤子宫内膜的1/3,弥漫型病变范围镜下>子宫内膜的1/3)[3]。子宫内膜癌均为子宫内膜样腺癌,根据2009 年FIGO 分期[4]分别为Ia 期14 例,Ib期7 例,II 期4 例。本研究经医院伦理委员会审核通过(批号2016-008),患者及家属均知情同意。
1.2 诊断标准 根据《女性生殖道病理学》(第6 版)[5]和WHO Classification of Tumours of Female Reproductive Organs[6]为诊断依据进行病理诊断。
1.3 纳入与排除标准 纳入标准:(1)子宫内膜组织标本均经手术治疗而获得,且病理符合研究要求;(2)在接受治疗前6 个月内未使用雌、孕激素或促性腺激素释放激素类似物等的激素类治疗;(3)心、肝、肾等重要器官无严重疾病,无血液系统疾病;(4)签署知情同意书。排除标准:(1)具有严重的家族遗传病史;(2)近6 个月有妊娠史或哺乳史;(3)放置宫内节育器者。
1.4 研究方法 受体蛋白表达的测定采用MaxVision一步法进行免疫组织化学染色。原液试剂购自Abcam 香港公司。免疫组化操作严格按使用说明书进行,具体操作如下:组织蜡块4μm 连续切片,脱蜡,新配制的3%过氧化氢灭活内源性酶15min,微波炉加热15min,修复抗原,自然冷却。然后滴加非免疫羊血清以阻断组织中的非特异性结合,接着依次滴加一抗(clustein 单抗,稀释度clustein 单抗1:200)、二抗(羊抗鼠IgG)、DAB 显色3~5min。苏木精复染,脱水,透明,中性树胶封片,显微镜下观察。用PBS 代替一抗作为阴性对照。
1.5 染色阳性结果判断[7]免疫组化切片严格质量控制,判读采用双盲法,由2 位高年资医生单独阅片。CLU 阳性为在腺上皮细胞的胞膜及胞质内出现黄褐色颗粒,按染色深浅及阳性细胞数多少,分为:无阳性细胞(-)、阳性细胞数<10%或染色极淡(±),评分为0 分;阳性细胞数10%~50%或染成浅棕色(+),评分为1 分;阳性细胞数50%~75%或介于深浅棕色之间(++),评分为2 分;阳性细胞数>75%或深棕色(+++),评分为3 分。
1.6 统计学方法 应用SPSS 22.0 统计软件进行分析,计量资料以均数±标准差表示,采用t 检验,计数资料的比较采用χ2检验,P<0.05 表示差异有统计学的意义。
2 结果
2.1 两组一般资料比较 研究组年龄(51.15±1.49)岁,体质指数(BMI)(23.16±0.28)kg/m2,对照组年龄(50.77±1.41)岁,BMI(22.41±0.29)kg/m2,两组一般资料比较,差异无统计学差异(P>0.05),具有可比性。
2.2 子宫内膜各种病变组织CLU 染色情况 正常子宫内膜增殖期,腺体排列规则,稀疏,腺上皮无异型,腺上皮未着色(见图1A)。子宫内膜非不典型增生,腺体排列较规则、稀疏,腺上皮轻度异型,腺上皮未着色(见图1B);子宫内膜不典型增生,腺体排列较子宫内膜非不典型增生不规则、相对密集,腺上皮中度异型,腺上皮细胞质均呈轻度黄褐色着色,判定为(+)(见图1C)。子宫内膜癌,腺体排列不规则、密集,部分呈筛状、乳头状、实性,腺上皮重度异型,腺上皮细胞质均呈中度弥漫性黄褐色着色,判定为(++)(见图1D)。染色阳性细胞数及强度子宫内膜癌比子宫内膜不典型增生更多、更强。
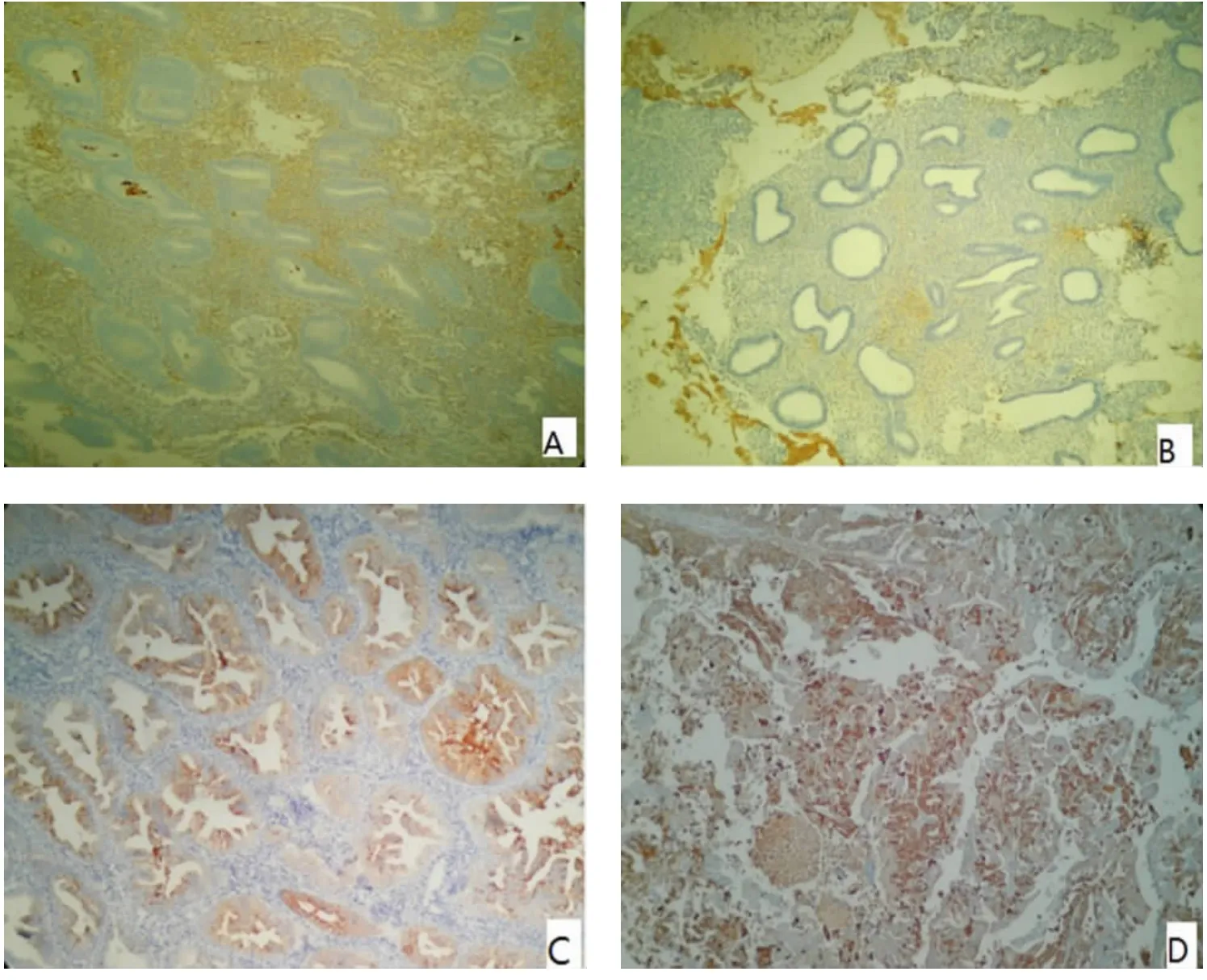
图1 丛生蛋白在子宫内膜各种组织表达(MaxVision 一步法染色DAB 显色,200 倍)
2.3 研究组和对照组子宫内膜组织CLU 表达 CLU在研究组与对照组表达经统计学检验差异有显著性(P<0.05)。见表1。

表1 研究组和对照组子宫内膜组织CLU 表达比较(例)
2.4 子宫内膜不典型增生和子宫内膜癌组织CLU表达 CLU 在子宫内膜不典型增生和子宫内膜癌各亚组组织表达差异有统计学意义(P<0.05)。CLU 在子宫内膜不典型增生的局限性与弥漫性组织表达比较,差异无统计学意义(P>0.05);在子宫内膜癌组的组织中,无论是Ia 期、Ib 期与II 期三者比较,抑或是Ia 期和Ia 期以上期别两组进行比较,CLU 表达差异均无统计学意义(P>0.05)。见表2。
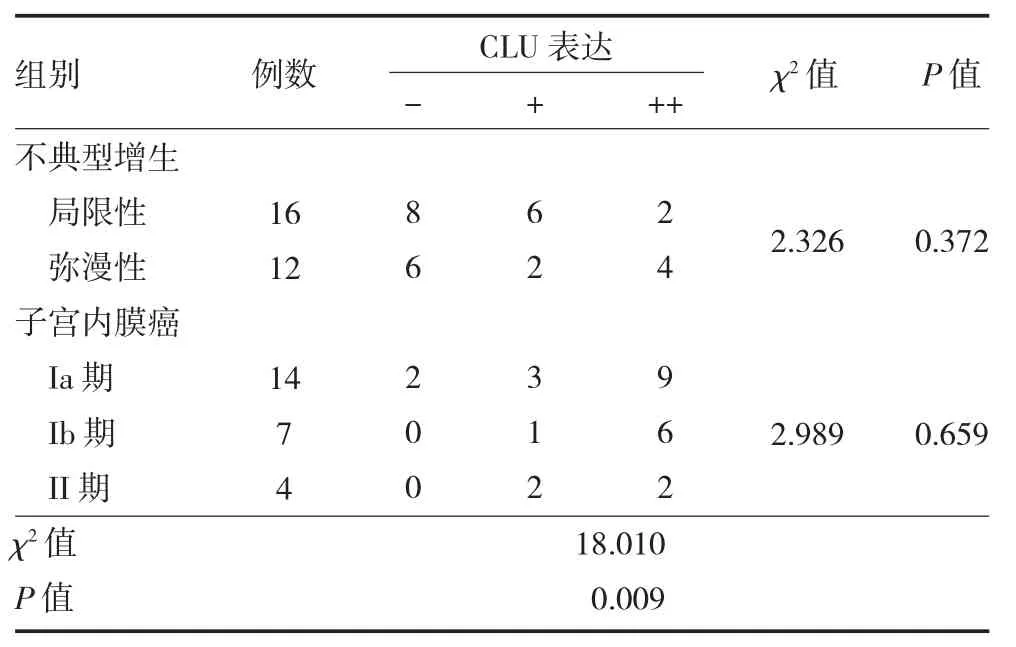
表2 子宫内膜病变各亚组组织CLU 表达(例)
3 讨论
CLU 最早在绵羊睾丸膜体液中被提取分离,是一个单拷贝基因,定位于8p21-p12,由高度保守的基因编码,也称异二聚体硫酸糖蛋白(SGP-2)[8]。CLU主要有两个蛋白亚型,分泌型丛生蛋白(sCLU)和核型丛生蛋白(nCLU),在特定情况下nCLU 会向sCLU转化[9],而电离辐射或转化生长因子-β(transforming growth factor-β,TGF-β)治疗可以诱导nCLU 的产生[8]。CLU 广泛分布于各种组织和器官,许多生物效能逐步被发现,如细胞相互作用、细胞凋亡、细胞保护、促进上皮间质转化、陪伴分子功能等[10]。
CLU 分布广泛,不同组织均存在CLU 受体,而且研究发现最可能通过转化生长因子b 受体Ⅰ型和Ⅱ型(TbR1 and TbR2)而存在[10]。另外,在细胞内激酶区域发现有CLU 结合;尽管TGF-bs 定位在子宫内膜,但只有TbR2 在子宫内膜腺体、平滑肌细胞和免疫细胞显示存在,说明子宫上皮细胞和内皮细胞是CLU 的主要来源,腺体、脉管和平滑肌细胞存在不同的选择性CLU 受体复合物。Brown 等[11]认为,晚分泌期CLU 的表达与此时孕酮水平下降、组织再生有关,上皮细胞可能促使CLU 增多。本研究发现CLU 在研究组组织表达明显高于对照组(P<0.05)。子宫内膜的持续增生继而发生癌变是内膜缺乏孕激素拮抗的后果,CLU 这种随着子宫内膜疾病进展而表达增多增强提示它的异常表达与子宫内膜癌前病变甚至癌变存在一定的相关性。
CLU 与肿瘤的发生和发展关系密切。CLU 敲除的小鼠对化学方法诱导更敏感,更易诱发皮肤肿瘤;组织特异性敲除还可使前列腺上皮细胞很高比率地转化为前列腺上皮肿瘤或分化成熟的腺癌[12-13]。Lee等[14]发现,在宫颈癌细胞系中通过PACAP 下调CLU的表达和分泌,可抑制裸鼠异种嫁接肿瘤的生长。CLU 在不同的肿瘤表达存在差异,除了少数肿瘤低表达外,大多数肿瘤均高表达。Won 等[15]在子宫内膜癌ECC-1 和KLE 细胞系检测到CLU 的表达,并且发现雌激素通过CLU 的高表达提高子宫内膜癌细胞系对紫杉醇的耐药性。本研究结果显示,随着病变的范围和严重程度的增加,子宫内膜从不典型增生进展到癌症,CLU 的表达增强(P<0.05),这提示CLU早期预测子宫内膜的癌变,可作为子宫内膜癌早期诊断的重要标志物。临床研究显示,sCLU 与肿瘤转移、再发相关,是预后不良的指标[8]。本研究结果还显示,无论是Ia 期、Ib 期与II 期三者的比较,抑或是Ia期和Ia 期以上期别两组进行比较,CLU 的表达均无统计学意义(P>0.05),没有得出相类结论可能与本研究的样本量尚不足有关。Zheng 等[16]研究肝细胞癌时发现肝细胞癌与非癌组织相比,无论mRNA 还是蛋白水平sCLU 表达均明显增高,与肿瘤的分化、分级有关;而且沉默sCLU 的基因转录可抑制肝癌细胞的集落形成和增殖,降低试管内AKT 和GSK-3β 磷酸化水平,明显抑制活体肝细胞癌异种移植。这些都提示致瘤性的sCLU 不仅是早期指标,还是新型的潜在的分子靶向疗法。
综上所述,CLU 的异常表达不仅与许多疾病相关,而且还与肿瘤的发生发展密不可分。本研究结果提示,CLU 的高表达与子宫内膜癌前病变及早期内膜癌存在相关性,可作为早期诊断子宫内膜癌的重要标志物。

