肠内营养支持治疗对老年晚期食管癌患者的临床应用研究
席晓莉,何天娇,张春艳,秦 花,何依群
(成都医学院第一附属医院 a.老年医学科,b.消化内科,c.内分泌科,d.肿瘤科,四川 成都 610500)
食管癌是常见的消化系统恶性肿瘤[1],其典型的临床症状为进行性吞咽困难,目前早期食管癌的治疗是以手术为主并辅以放化疗的综合治疗,但晚期(III~IV期)食管癌患者则以放化疗为主要方式。晚期食管癌患者由于长期进食困难及肿瘤本身的消耗,常伴有不同程度的营养不良[2],尤其是老年晚期食管癌患者常伴有明显消瘦及机体衰弱,不少患者放弃放化疗,选择姑息性的治疗,其预后及生活质量均较差。对于此类患者,如何改善营养状况,提高生活质量是临床治疗的重点,但目前尚无统一的营养支持标准。本研究就肠内营养支持治疗及自主进食联合肠外营养两种方案,对行姑息治疗的老年晚期食管癌患者的营养指标、营养并发症、免疫力及日常生活能力恢复的影响,报道如下。
1 资料与方法
1.1 一般资料2015年1月至2018年12月我院收治的89例老年晚期食管癌患者,纳入标准:①患者均为III~IV期食管癌,无法进行手术且不愿接受放化疗,仅行姑息治疗;②年龄大于65岁;③患者均为初次就诊,且既往未接受手术治疗、放化疗、免疫及靶向治疗;④随访资料完整。排除标准:①消化道先天畸形;②合并食管气管瘘、肺部感染、胃肠道功能障碍;③合并肝肾功能衰竭、糖尿病及严重心脑血管疾病。根据营养方式不同分为两组,将49例行肠内营养的患者作为观察组,男30例,女19例,年龄65~78岁[(71.24±4.28)岁];将40例自主进食联合肠外营养的患者作为对照组,男23例,女17例,年龄65~79岁[(71.47±4.94)岁],两组年龄、性别比较差异无统计学意义(P> 0.05),具有可比性。两组患者对本研究均知情同意并签署同意书,本研究方案经过医院伦理学会批准。
1.2 方法观察组入院后常规留置鼻肠管,选择肠内营养治疗,并根据患者具体情况,由营养科制定肠内营养方案,并使用肠内营养泵控制营养液输注速度及温度。对照组予以自主进食,能量不足部分经静脉营养补充,包括氨基酸、脂肪乳、葡萄糖及各种微量元素。
1.3 观察指标分析两组患者治疗前及治疗1个月后各项营养指标、Katz日常生活功能指数评分、免疫指标以及两种营养方式的并发症发生率。本研究分析的营养指标包括:血清总蛋白、白蛋白、血红蛋白、上臂围、肱三头肌皮褶厚度及体重指数。两种营养方式的并发症包括:胃肠道并发症(如恶心、呕吐、腹胀、肠痉挛、腹泻、胃潴留等)、机械性并发症(如导管堵塞及异位、深静脉导管静脉炎等)、感染性并发症(如胃肠道感染、误吸所致肺部感染及深静脉导管所致血液感染等)及代谢性并发症(包括电解质失衡、肝肾功能损害、葡萄糖不耐受及部分营养素缺乏或过剩等)。Katz日常生活功能指数评分是用于评定老年人基本日常生活能力,其内容包括:进食、穿衣、洗澡、移动、如厕及大小便控制,分值为0~6分,分值越高则说明患者的日常生活能力越高。老年晚期食管癌患者长期营养摄入不足,多伴有不同程度的免疫力下降,临床常使用IgA、IgM评估患者体液免疫,CD4+T细胞、CD4+/ CD8+评估患者细胞免疫。
1.4 统计学方法采用SPSS 17.0统计学软件分析数据。计量资料比较采用t检验。计数资料比较采用χ2检验或Fisher确切概率法。P< 0.05为差异有统计学意义。
2 结果
2.1 两组营养治疗前及治疗后1月的营养指标分析两组营养治疗前在血清总蛋白、白蛋白、血红蛋白、上臂围、肱三头肌皮褶厚度及体重指数方面的差异均无统计学意义(P> 0.05),见表1;营养治疗1月后两组上述各项营养指标比较,差异均有统计学意义(P< 0.05),见表2。
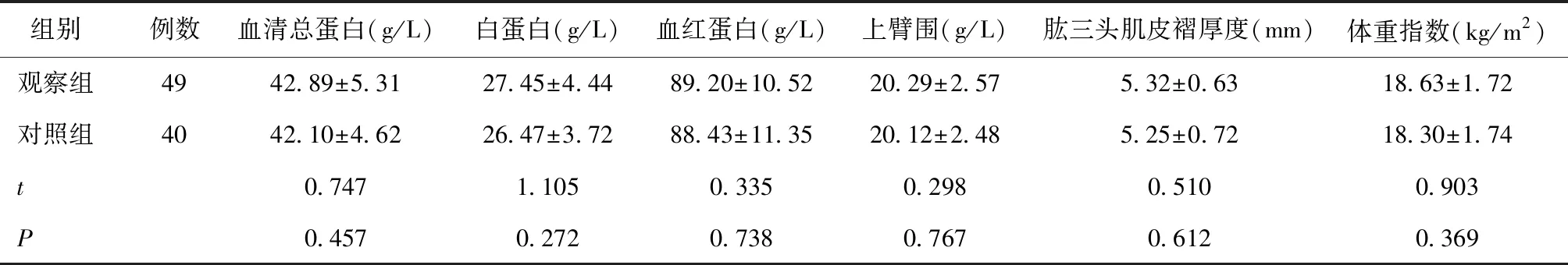
表1 两组治疗前的营养指标比较

表2 两组治疗1月后的营养指标比较
2.2 两组营养治疗过程中的并发症发生率比较两组患者在胃肠道并发症及机械性并发症方面差异均无统计学意义(P> 0.05),但在感染性并发症、代谢性并发症及总体并发症方面差异有统计学意义(P< 0.05),见表3。
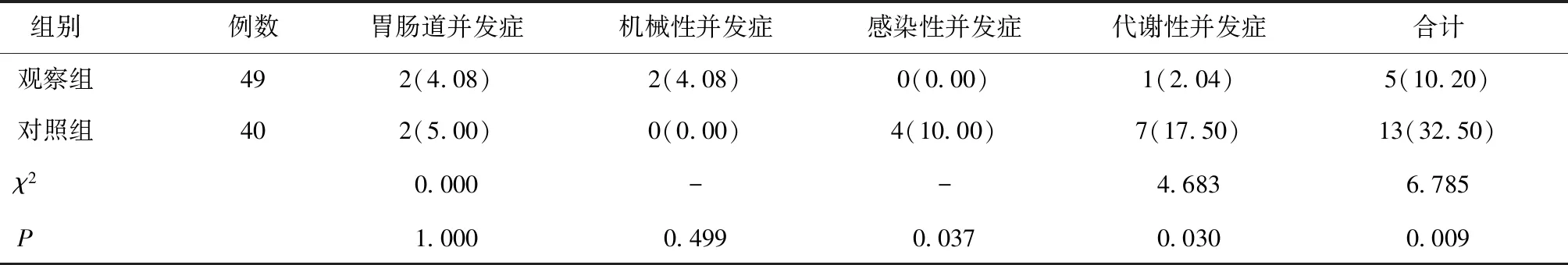
表3 两组营养相关并发症发生率比较 [n(%)]
2.3 两组治疗前及治疗1个月后免疫指标比较两组营养支持治疗前IgA、IgM、CD4+T细胞百分比、CD4+/ CD8+的差异无统计学意义(P> 0.05),治疗1个月后两组免疫指标差异有统计学意义(P< 0.05),见表4。
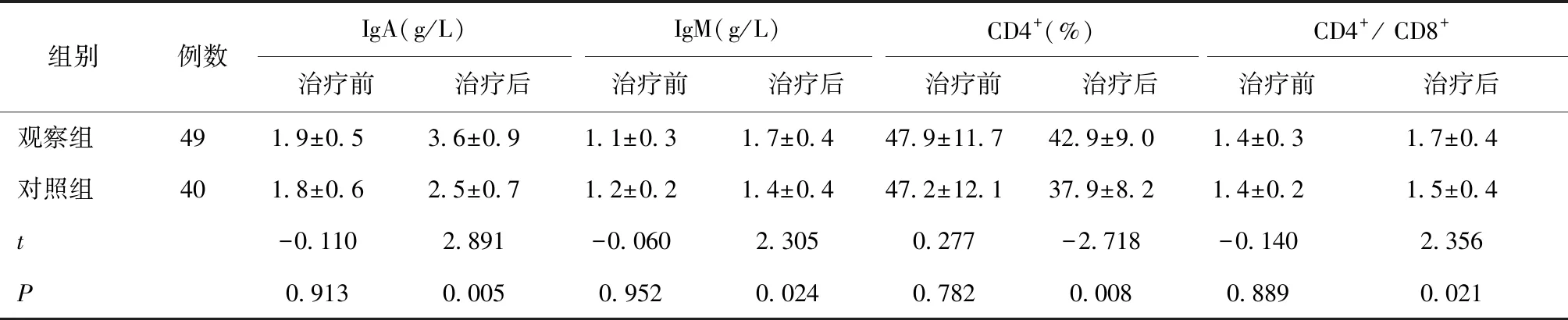
表4 两组治疗前及治疗1月后免疫指标比较
2.4 两组治疗前及治疗1个月后的Katz日常生活功能指数评分比较营养支持治疗前的Katz日常生活功能指数评分分别为:观察组(4.22±1.05)分,对照组(4.03±0.97)分,差异无统计学意义(t=0.923,P> 0.05),但在营养支持治疗1月后两组Katz日常生活功能指数评分分别为:观察组(5.43±0.79)分,对照组(4.90±0.77)分,差异有统计学意义(t=3.160,P< 0.05)。
3 讨论
随着我国人口老龄化的加剧,老年食管癌患者越来越多,多数此类患者由于进行性吞咽困难、长期营养摄入不足,导致许多重要器官功能衰竭、组织修复能力及机体营养储备能力下降。很多老年晚期食管癌(III~IV期)患者错过手术时机,且由于身体状况、精神状况、家庭经济以及远期预后不佳等因素拒绝行放化疗,而选择姑息治疗,此时营养支持治疗显得尤为重要,其能在很大程度上改善此类患者的生活质量[3]。因此,如何对老年晚期食管癌患者进行合理的营养支持,是治疗此类患者的关键。
目前临床研究已证实肠内营养及肠外营养治疗均能在一定程度上改善癌症晚期患者的营养状况、维持组织器官结构及功能、调节机体代谢、增强免疫力,改善患者预后[4]。本研究中,两组患者营养支持治疗前各项营养指标均无统计学差异,治疗1个月后各项营养指标的差异均有统计学意义,表明肠内营养支持治疗在改善老年晚期食管癌患者机体营养方面优于自主进食联合肠外营养。完全肠外营养在营养成分比例、热量等方面可控性强,但其并发症较多,可引起肠黏膜萎缩,削弱肠道屏障功能,从而导致肠道菌群失调,诱发肠源性感染,并可能造成肝功能损害,甚至导致患者多器官功能衰竭[5]。肠内营养支持治疗可将符合患者机体需求的混合营养液通过鼻肠管输注至十二指肠及空肠,其能有效改善胃储留,更符合肠道消化的正常生理过程,能够有效维持肠黏膜的完整性,避免肠道屏障功能恶化[6,7]。经肠道摄入的营养物质含有适当比例的糖类、蛋白质、脂肪、维生素及微量元素,其中一部分能经肝门静脉吸收,并在肝内合成、转化、解毒,有利于调节肝脏合成蛋白质,从而改善患者机体营养不良[8]。此外,肠内营养能促进肠道多种激素的合成和释放,维持胃肠道内、外分泌功能[9,10],从而改善肠道血供,促进肠道蠕动,并保护肠道黏膜屏障功能。本研究中,两组患者在感染并发症、代谢性并发症及总体并发症方面有统计学差异,也证实了自主进食联合肠外营养组的感染并发症、代谢性并发症及总体并发症发生率均高于肠内支持治疗的患者。
老年晚期食管癌患者长期营养不良,机体免疫力较差,从而导致恶病质及各种并发症[11]。人体免疫包括体液免疫和细胞免疫,其中IgA、IgM是介导体液免疫的重要免疫球蛋白,其能与特异性抗原相结合,发挥免疫功能[12],而CD4+T细胞是人体细胞免疫中重要的免疫细胞,其能激发机体对抗各种病原微生物,CD4+/ CD8+作为机体免疫调节的一项重要指标,在恶性肿瘤患者中其比值常呈降低趋势[13]。本研究中,两组患者营养支持治疗前IgA、IgM、CD4+T细胞百分比、CD4+/ CD8+均无统计学差异(P> 0.05),但在营养支持一个月后上述免疫指标均有统计学差异(P< 0.05),这表明肠内营养支持治疗在提升机体免疫力方面优于自主进食联合肠外营养的患者。对于终末期老年食管癌患者来说,减轻痛苦、改善生活质量、提高日常生活能力显得尤为重要。临床常使用Katz日常生活功能指数量表来评估老年人基本日常生活能力[14],本研究中两组患者营养支持治疗前的评分无统计学差异(P> 0.05),但在营养支持治疗1个月后两组患者Katz日常生活功能指数评分的差异有统计学意义(P< 0.05),这表明肠内营养支持治疗在改善老年晚期食管癌患者日常生活能力方面更具优势。
综上所述,肠内营养支持治疗能更好的改善老年晚期食管癌患者各项营养指标,降低营养治疗并发症,提升患者免疫力,改善患者基本日常生活能力。因此,此类患者如肠道消化及吸收功能正常,应首选个体化的肠内营养治疗方案。

