高血压脑出血患者高迁移率族蛋白-1、铁蛋白、血管内皮素-1的表达及其临床意义
康 康,范超平,蔡盈盈
(1.河南省信阳市中心医院神经内科,河南 信阳 464000;2.成都医学院第一附属医院老年医学科,四川 成都 610500)
高血压脑出血(HCH)引发的血肿常存在显著的占位效应,致使脑组织局部血液循环障碍,导致脑组织功能紊乱,若不能获得及时有效治疗,常易加重脑组织损伤,甚至导致患者死亡[1]。研究证明,脑组织损伤可导致高迁移率族蛋白-1(HMGB-1)、铁蛋白(SF)、血管内皮素-1(ET-1)等因子异常改变,并引发脑组织进一步损伤,掌握上述因子的变化对于评估患者病情,评价患者预后具有重要价值[2-3]。本研究分析HCH患者血清HMGB-1、SF、ET-1表达水平,探讨其对患者病情及预后评估的临床意义。现报道如下。
1 资料与方法
1.1 一般资料2015年7月至2018年6月河南省信阳市中心医院神经内科收治的HCH患者164例(试验组),纳入标准:符合《各类脑血管疾病诊断要点(1995)》[4]中HCH诊断标准,并经影像学证实为HCH患者;生存时间>7d患者;知情同意患者;首次HCH患者。排除标准:肝肾功能异常患者;合并脑疝及脑梗死患者;继发性HCH患者;免疫系统、血液系统及感染性疾病患者;恶性肿瘤患者。男94例(57.32%),女70例(42.68%);年龄51~77岁[(63.42±7.61)岁];发病至入院时间时间6~48 h[(18.75±2.10)h];高血压病程2~14年[(8.75±0.93)年];出血部位:额叶6例(3.66%),颞叶13例(7.93%),枕叶27例(16.46%),顶叶43例(26.22%),75例(45.73%);出血量22~36 ml[(28.64±3.07)ml]。依据格拉斯哥昏迷评分分为重度组(3~8分)31例(18.90%),中度组(9~11分)49例(29.88%),轻度组(12~15分)84例(51.22%)。选择同期我院体检的164例健康志愿者(健康组),男97例(59.15%),女67例(40.85%);年龄52~79岁[(63.85±7.70)岁],两组基线资料比较差异无统计学意义(P> 0.05)。
1.2 方法①检验方法:两组均于清晨空腹采集3 ml静脉血,室温存放30 min,不抗凝,3500 r/min离心机内离心5 min,取血清,以放射免疫法检测HMGB-1、ET-1,以ELISA法检测SF,检测严格依据试剂盒要求操作。②治疗方法:依据影像学表现及出血量对试验组患者行定位血肿穿刺引流、双侧侧脑室引流等方法治疗。③脑水肿、血肿体积检测:观察组患者确诊24 h,行头颅CT检查,依据检查结果计算脑水肿、血肿体积。脑水肿体积=层厚×层数×各部位水肿面积和;脑血肿体积=层厚×层数×各部位血肿面积和。
1.3 预后判断标准预后判断标准依据《各类脑血管疾病诊断要点(1995)》[4]相关标准制定。①优:HCH患者恢复良好,可进行正常生活,神经功能障碍轻度;②良:HCH患者中度残疾,可自理生活,工作可于保护下进行;③重度残疾:HCH患者意识清醒,不能自理生活;④植物生存;⑤死亡。预后良好:①+②;预后不良:③+④+⑤。
1.4 统计学方法采用SPSS 19.0统计软件分析数据。计量资料两组间比较采用t检验,多组间比较采用单因素方差分析;计数资料比较采用χ2检验;相关分析采用Spearson相关性分析。P< 0.05为差异有统计学意义。
2 结果
2.1 试验组、健康组血清HMGB-1、SF、ET-1水平比较试验组血清HMGB-1、SF、ET-1高于健康组(P< 0.05)。见表1。
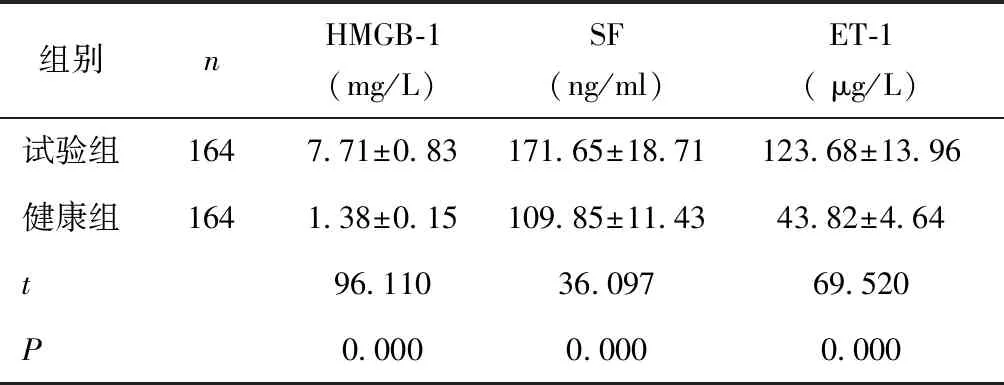
表1 试验组、健康组血清HMGB-1、SF、ET-1水平比较
2.2 重度组、中度组、轻度组血清HMGB-1、SF、ET-1水平比较重度组血清HMGB-1、SF、ET-1高于中度组和轻度组,中度组高于轻度组(P< 0.05)。见表2。
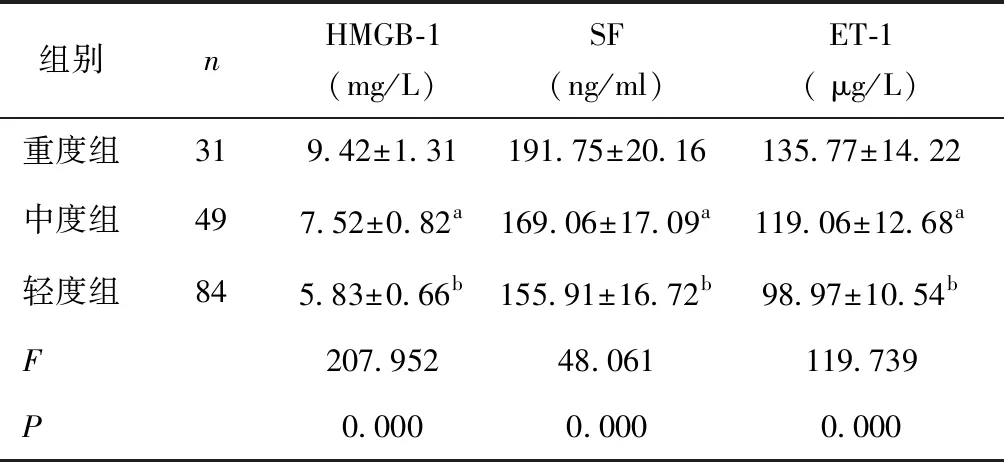
表2 重度组、中度组、轻度组血清HMGB-1、SF、ET-1水平比较
a与重度组、轻度组比较,P< 0.05;b与重度组比较,P< 0.05
2.3 预后不同患者血清HMGB-1、SF、ET-1水平比较预后良好患者血清HMGB-1、SF、ET-1低于预后不良患者(P< 0.05)。见表3。
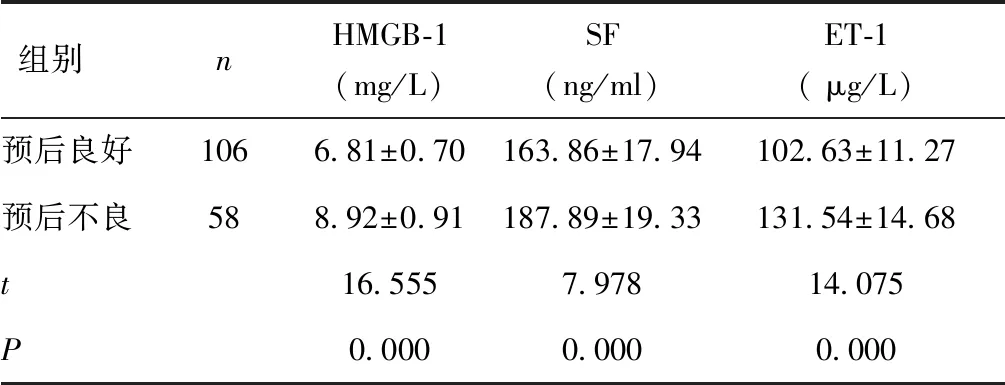
表3 预后不同患者血清HMGB-1、SF、ET-1水平比较
2.4 血清HMGB-1、SF、ET-1与HCH患者脑水肿、血肿体积相关性血清HMGB-1、SF、ET-1与HCH患者脑水肿、血肿体积均呈正相关(P< 0.05)。见表4。
3 讨论
高血压是导致脑出血的重要因素[5]。资料显示,HCH常易导致占位性改变、颅内压升高及脑组织破坏,危及患者生命。此外,HCH还可引发下丘脑功能损伤,释放多种细胞因子,致使心肌细胞、肝细胞等细胞发生功能性改变,导致机体微环境改变[6]。研究证明,发生HCH后,脑组织可大量释放多种细胞因子,损伤脑组织,破坏血脑屏障,推动疾病进展,危及患者生命[7]。
HMGB-1为非组蛋白,细胞稳态时多分布于细胞核,血清水平较低。在细胞受到信号刺激后,HMGB-1被乙酰化,并释放至细胞外[8]。资料显示,HMGB-1 B框基因具有促炎作用,可经诱发线粒体自噬释放细胞因子路径推动炎性反应[9]。HMGB-1可间接促进表达TGF-β、TNF-α、VEGF等因子,诱导细胞增殖、分化及凋亡。HMGB-1能够抑制TRAIL、CD95、BAK等导致细胞凋亡。HMGB-1具有较强的致死性,HMGB-1可抑制上皮细胞屏障功能,促进细胞凋亡[10]。研究证明,脑出血发生后,HMGB-1可被释放至细胞外引发炎性反应,并介导多种炎性反应的发生[11]。脑出血初期,HMGB-1可激活小胶质细胞,引发炎性反应,导致小胶质细胞凋亡。若给予HMGB-1抗体则能抑制激活小胶质细胞,避免其凋亡[12]。
SF是神经胶质损伤的标志物,可伴随脑损伤程度的增加大而升高[13]。研究证明,脑出血可导致脑血肿、水肿,随着脑血肿、水肿体积不断增大,坏死脑细胞数量也逐渐增多,破裂脑细胞可释放大量SF[14]。此外,血灶中的单核细胞、吞噬细胞也可大量合成SF[15]。经血红素加氧酶降解,SF可释放大量胆绿素及铁离子,铁离子氧化性较强,可导致Fenton反应,生成羟自由基,羟自由基攻击脑细胞膜中不饱和脂肪酸,引发脂质过氧化反应,抑制ATP、Ca2+、Mg2+多种酶活性,导致离子运转障碍,损伤血脑屏障,导致SF进入血液,致使血清SF水平升高[16]。研究证明,在脑组织代谢过程中,铁离子水平异常可导致脑功能损伤[17]。
ET-1为血管收缩物质,不但作用强,且作用持久[18]。资料显示,ET-1可通过结合其受体参与心脑血管等多种疾病的生理、病理进程[19]。EF-1转化酶可促使脑血管内皮分泌ET-1,ET-1与平滑肌内相应受体结合,提高蛋白激酶活性,提高三磷酸肌醇水平,增加细胞内Ca2+水平,促进血管收缩[20]。发生脑出血后,ET-1被脑血管内皮大量合成并释放,并产生强烈的促进脑血管收缩作用,导致脑组织继发性损伤[21]。ET-1还具有较强的正性肌力作用,可直接作用于脑血管,促进局部血管强烈收缩及血压升高,而血压升高又可推动HCH进展,加重病情[22]。
在本研究中,试验组血清HMGB-1、SF、ET-1均高于健康组,重度组血清HMGB-1、SF、ET-1均高于中度组、轻度组,中度组血清HMGB-1、SF、ET-1均高于轻度组,预后良好患者血清HMGB-1、SF、ET-1均低于预后不良患者,且血清HMGB-1、SF、ET-1与HCH患者脑水肿、血肿体积均呈正相关,提示血清HMGB-1、SF、ET-1与HCH病情严重程度及预后关系密切。
总之,HCH患者可大量表达HMGB-1、SF、ET-1并释放进入血液,且其血清水平与疾病严重程度成正相关。检测血清HMGB-1、SF、ET-1水平不但可准确掌握患者HCH病情,还有利于评价患者预后。

