注射型富血小板纤维蛋白对成骨细胞影响的研究
费 潜,王灿莉,孙 勇
(1.西南医科大学,四川 泸州 646000;2.西南医科大学附属口腔医院,四川 泸州 646000)
富血小板纤维蛋白(platelet-rich fibrin,PRF)在2001年由法国科学家 Choukroun 等[1]发现,是继富血小板血浆(platelet-rich plasma,PRP)后第二代血小板浓缩制品。PRF主要是由血小板、白细胞和纤维蛋白基质等共同构成,其分子结构类似于天然血凝块,富含多种细胞因子。PRF可以借助生长因子的调节作用进行组织修复,具有诱导组织再生和促进组织愈合的特性[2]。另外,PRF是一种不含体外抗凝物质的完全自体血浓缩物,不但内含大量生长因子,且具有获取途径容易,制作过程简单的优点[3]。PRF目前已广泛应用于临床,使用时主要制备成膜状或凝胶状。2014年,Choukroun团队通过改变离心速率制得注射型富血小板纤维蛋白(injectable platelet-rich fibrin,i-PRF),通过利用非玻璃离心管在低速离心状态下,降低纤维蛋白早期凝集,从而获得i-PRF[4]。临床使用时其制备方法更加简化,为一步离心,操作更加便捷,不需要膜状或凝胶状的剪切和挤压塑性。i-PRF同传统的PRF类似,但i-PRF富含更多的白细胞,以及能够释放更多的生长因子[4]。本实验使用的是i-PRF,观察其对成骨细胞增殖、分化及细胞骨架的影响。
1 材料与方法
1.1 主要试剂和仪器α-MEM培养基(Hyclone 美国)、胎牛血清(FBS,浙江天杭生物科技股份有限公司)、CCK-8试剂盒(日本株式会社同仁化学研究所)、碱性磷酸酶(ALP)试剂盒(上海生工有限公司)、罗丹明-鬼笔环肽(Cytoskeleton 美国)、图像分析软件(Image-Pro Plus 6.0,Media Cybernetics美国)、低速离心机(湖南恒心科技股份有限公司,型号:0TD3WS)。
1.2 方法
1.2.1兔成骨细胞的制备 2017年12月至2018年6月,选择 出生一周的同胎新西兰乳兔4只(20~25 g,西南医科大学实验动物房提供)。颈椎脱臼法处死后置于75%酒精中浸泡30 min,无菌操作台内取出颅顶骨,通过改良胶原酶和胰酶分段消化结合组织块培养法获取兔原代成骨细胞。通过碱性磷酸酶染色和茜红素染色法进行成骨细胞鉴定后取P3代细胞进行实验。
1.2.2i-PRF的制备 新西兰大白兔(2~2.5 kg 西南医科大学实验动物房提供),适应性饲养1周。无菌条件下,于每次兔子进食后1 h后进行动脉血采集,一次性静脉采血针配合i-PRF专用一次性真空采血管,每只兔子每次收集7 ml血液,立即置入TD3WS低速离心机(湖南恒心科技股份有限公司)中,设置i-PRF程序700 rpm/min,3 min,离心后可见血液分为2层:上层为i-PRF层,下层为红细胞层。在超净工作台上,将每1 ml i-PRF加入5 ml α-MEM培养基,静置3天后,1000 rmp条件下离心5 min,取上清液用0.22 μm细菌滤器过滤后即为i-PRF条件培养基。实验分为实验组(i-PRF组),对照组(α-MEM完全培养基 含10%FBS、2%双抗)进行培养成骨细胞。
1.2.3CCK-8检测细胞增殖 重悬细胞,将细胞计数调整为1×105个/ml,取96孔板,表明时间节点,每组设置5个复孔,每孔加入50 μl上述细胞悬液,移入孵育箱2 h后取出,实验组每孔按4∶1的比例加入i-PRF条件培养基和α-MEM完全培养基共100 μl,空白组加入α-MEM完全培养基100 μl,每2~3天换液。分别培养1、3、5、7天后,吸出原培养液,无菌PBS漂洗三次,向上述各孔加入CCK-8反应液10 μl。按照CCK-8检测试剂盒说明书进行操作,酶标仪450 nm处进行OD值检测并记录结果。
1.2.4碱性磷酸酶(ALP)染色 将细胞计数约1×105个/ml的细胞悬液接种至24孔板,设置3个复孔,移入孵育箱2 h后取出,实验组每孔按4∶1的比例加入i-PRF条件培养基和α-MEM完全培养基共100 μl,空白组加入α-MEM完全培养基100 μl,每2~3天换液。于细胞培养第5、7、9天,吸去培养液,无菌PBS漂洗三次,取细胞爬片进行碱性磷酸酶检测并通过Image-Pro Plus 6.0软件进行半定量分析。
1.2.5细胞骨架形态观察 将细胞以1×105个/ml的浓度置于6孔板中制作细胞爬片。每组每个时间节点设3个复孔,分别于12、24、48 h后吸去培养液,无菌PBS漂洗三次,4%多聚甲醛温室固定10 min,PBS清洗30 s,0.5%Triton X-100溶液完全覆盖细胞,温室处理5 min,PBS清洗30 s,滴加200 μl 10 nm的罗丹明-鬼笔环肽,室温避光处理30 min,PBS清洗30 s,在荧光显微镜下进行细胞骨架形态及细胞核观察。
1.3 统计学方法采用SPSS 16.0进行t检验,计量资料用均数±标准差表示。P< 0.05为差异有统计学意义。
2 结果
2.1 CCK-8检测细胞增殖结果随细胞培养时间延长,两组细胞数量逐渐增加,各组细胞培养的OD值总体比较及不同时点组间两两比较,差异均有统计学意义(P< 0.05);在每个时间节点实验组的吸光度值均显著高于对照组(P< 0.05)。见表1。
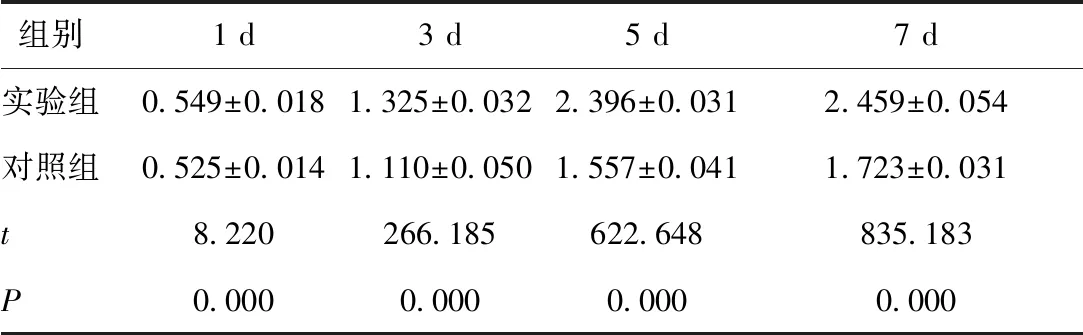
表1 两组细胞不同培养时间细胞增殖结果OD值比较
2.2 两组ALP染色结果比较随培养天数的增加,镜下成骨细胞数目及表达蓝染颗粒的细胞数目均增加,5、7、9天细胞内碱性磷酸酶蓝染颗粒表达情况均表现为实验组优于对照组(P<0.05)。见图1。2.3 i-PRF对细胞骨架形态的影响观察对照组和实验组成骨细胞数目均随着培养时间的增加而增加,两组细胞均表现出较好的增殖活性。成骨细胞培养的第12 h,空白组细胞呈现为较小的椭圆形,边缘光滑整齐,无明显的细胞突起,可见F-actin微丝蛋白环状排列;实验组细胞开始呈现出成骨细胞三角形、长梭形、多边形等特点,F-actin微丝蛋白沿细胞长轴平行排列。成骨细胞培养的第24 h,对照组细胞开始呈现长梭形样伸展并可见胞浆突起,F-actin微丝蛋白开始沿细胞长轴平行排列;实验组细胞主要呈现为三角形、多边形伸展,细胞伸展面积较对照组大,F-actin微丝蛋白沿细胞长轴有规律的平行排列或交织成网状。成骨细胞培养的第48 h,对照组细胞呈现为多边形伸展伴多个胞浆突起,伸展面积较前一时间节点明显扩大,F-actin微丝蛋白沿细胞长轴平行排列或交织成网状,排列相对紊乱;i-PRF组细胞呈现为三角形、多边形及长梭形伸展,伴丰富胞浆突起并相互连接,细胞伸展面积明显较空白组大,F-actin微丝蛋白汇集成较粗的束状,均匀、平行排列,规律性的沿细胞长轴伸展。见图2。
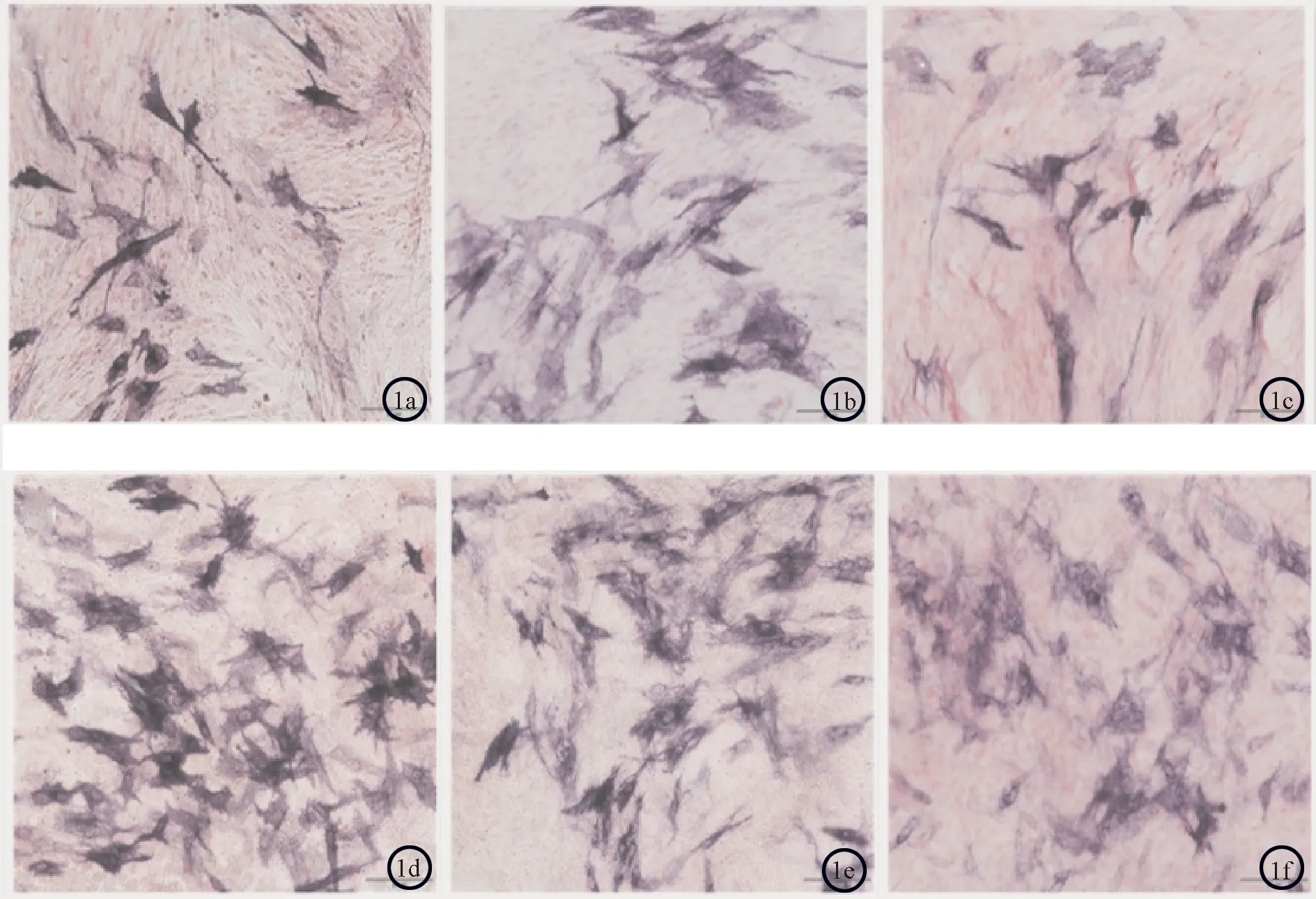
图1 两组细胞不同培养时间ALP细胞染色结果比较 (×200) a:对照组5天;b:对照组7天;c:对照组9天;d:实验组5天;e:实验组7天;f:实验组9天
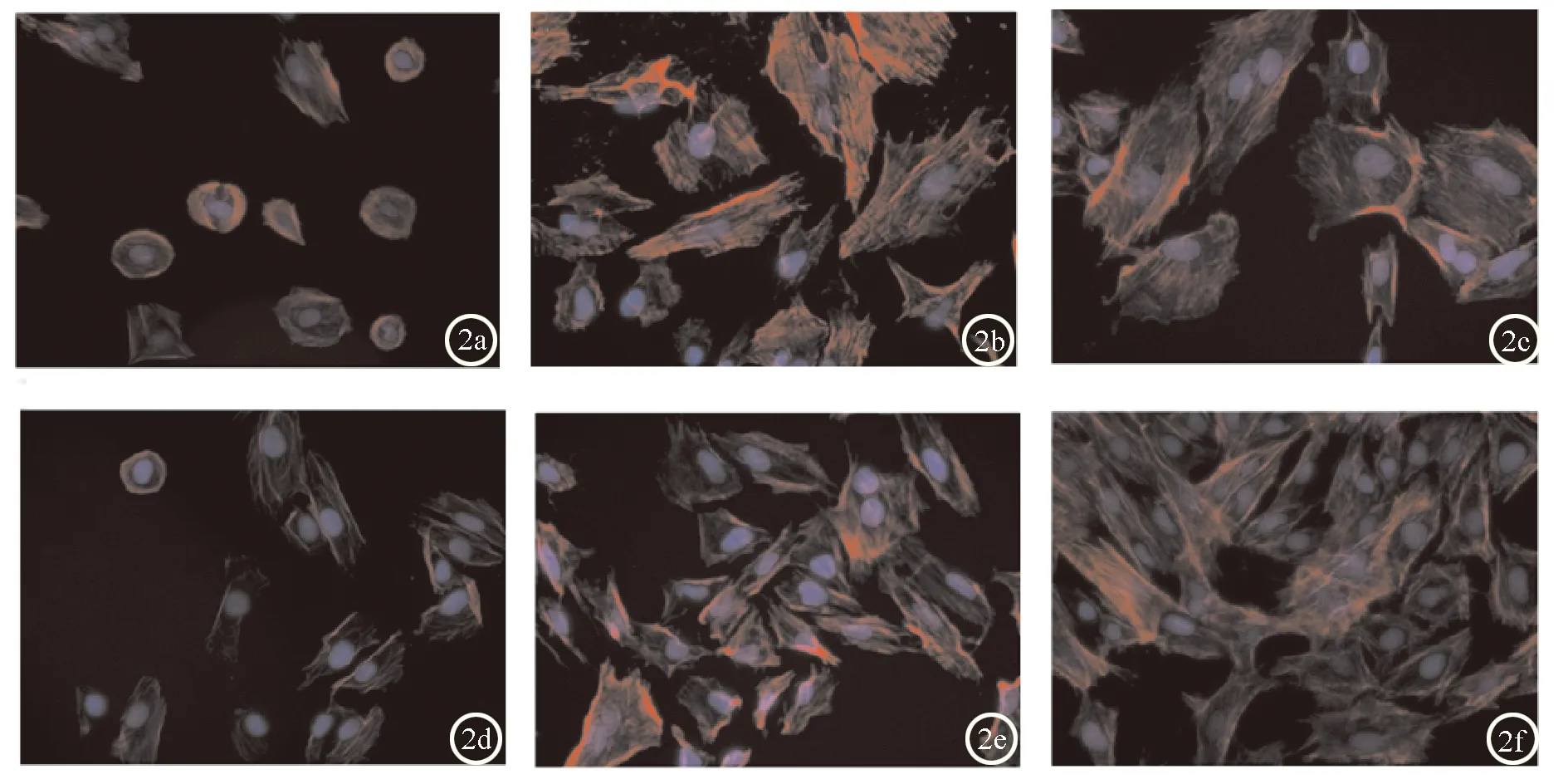
图2 两组细胞培养不同时间节点细胞骨架形态比较(荧光显微镜,×400) a:对照组12 h;b:对照组24 h;c:对照组48 h;d:实验组12 h;e:实验组24 h;f:实验组48 h
3 讨论
大量研究[5,6]证明,PRF可以有助于伤口愈合,保护术区,促进软组织修复的作用,当与骨移植材料混合时,可以促进干细胞向移植中心迁徙,促进新的血管形成。相关的动物实验中已经证实PRF不仅具有促进新骨形成的作用,且可作为骨组织工程支架材料的选择之一[7]。另外,有实验表明PRF可以单独作为骨充填材料修复种植体周围骨缺损,且修复的新骨与正常骨无明显差异[8]。PRF中主要含有三种浓缩的细胞因子生长因子-β(TGF-β)、血小板生长因子(PDGF)和血管内皮生长因子(VEGF)。PDGF在骨细胞的分裂和增殖的早期阶段起着重要作用;TGF-β可以调节骨形成和吸收;VEGF是骨代谢的一种重要的局部调节因子,在一定剂量时则以发挥成骨的调节效应,可以直接作用于成骨细胞。它们之间存在协同作用,加强各自的促进作用[9]。i-PRF作为一种新型的不加入任何抗凝剂的可注射型富血小板纤维蛋白,通过低速离心(700 rmp,3 min) 即可制得[4]。有实验表明i-PRF较PRF能更好的诱导成骨细胞迁徙,并释放不同浓度的生长因子的能力,更高的表达PDGF,TGF-β等[10]。Choukroun等[3]一项研究证明了降低离心力与生长因子释放之间的关系,离心过程产生的总细胞数量和生长因子释放水平在相同的血容量下只与特定的相关离心力暴露量有关。目前新的数据表明,白细胞和血小板的质量、大小和密度范围需要较低的相关离心力,这足以让它们从血液中分离出来,且显著增加白细胞、血小板数量,以及生长因子浓度[11]。且有进一步的研究显示,i-PRF与骨移植材料混合时,可形成一移植骨块,最大限度的减少骨移植颗粒的扩散和迁移[12]。但有研究指出,过高浓度的生长因子会抑制细胞的增殖分化[13],本实验于无菌条件下,制取得到i-PRF条件培养液后稀释至20%用于本实验,与Miron等[10]在实验中采用的i-PRF浓度一致。
本实验中,CCK-8结果显示,随细胞培养时间延长,两组细胞数量逐渐增加,各组细胞培养1、3、5、7 d的OD值两组间比较差异有统计学意义(P< 0.05);在每个时间节点实验组的吸光度值均显著高于对照组(P< 0.05)。此结果与董凯等[14]对富血小板纤维蛋白提取液(platelet-rich fibrin extrace,PRFe)对成骨细胞的实验研究中,细胞增殖情况结果基本一致。本实验 ALP染色结果显示随培养天数的增加,镜下成骨细胞数目及表达蓝染颗粒的细胞数目均增加,5、7、9 d细胞内碱性磷酸酶蓝染颗粒表达情况均表现为实验组优于对照组。其原因笔者认为通过低速离心获得的i-PRF富含多种生长因子、白细胞及血小板,对成骨细胞表达碱性磷酸酶活性起着促进作用,但本实验未对成骨细胞表达碱性磷酸酶活性进行定量检测,这一假设仍需进一步研究来证实。本实验 i-PRF对细胞骨架形态的影响观察结果显示,对照组和实验组成骨细胞数目均随着培养时间的增加而增加,两组细胞均表现出较好的增殖活性,但实验组细胞的细胞骨架较对照组有更好的排列及伸展。初步分析其原因与i-PRF中释放的多种生长因子有密切关系,但实验中未讨论i-PRF的三维结构对成骨细胞的影响,仍须今后进一步实验研究。i-PRF运用时间较短,其生物性能有待进一步研究,需要进一步的相关临床和实验研究以优化临床效益。
综上所述,i-PRF能够释放一定浓度的生长因子促进成骨细胞增殖分化,促进细胞骨架的排列与伸展。这为临床种植手术中的应用提供了进一步的理论基础。

