鞘内注射小剂量纳洛酮 吗啡混合芬太尼对大鼠后足切割痛觉和尾椎间盘炎症因子表达的影响
王亚红 王新强 汤建儿
手术切口疼痛是术后患者的常见并发症,若不及时干预,可影响患者术后的康复,约30%~60%的患者即使给予积极镇痛治疗,后期仍可转化为慢性疼痛,病程可达数月甚至数年,严重影响患者的工作和生活。吗啡和芬太尼是临床常用的阿片类镇痛药。研究认为,鞘内注射吗啡联合芬太尼,二者可取长补短,芬太尼起效较快,可达快速镇痛的目的,而吗啡作用时间较长,可延长镇痛时间[1]。但二者联用副作用较大。研究[2]显示,鞘内注射纳洛酮1.0ng/kg 联合吗啡、芬太尼可抑制切口痛大鼠海马MTL 表达上调,进而参与维持胃肠动力的稳定,有利于药物副作用的改善,且未减弱吗啡联合芬太尼的镇痛效应。手术切口除引起疼痛外,还可引起切口处的炎症反应,加重疼痛程度[3]。本文探讨小剂量纳洛酮联合吗啡、芬太尼对大鼠后足切割痛觉及尾椎间盘炎症因子的表达的影响。报道如下。
1 材料与方法
1.1 实验动物 40 只健康雄性SD 大鼠,SPF 级,6~8周龄,体重180~220g,购自上海医学动物实验中心,每笼5 只,自然照明,自由摄食和饮水。采用随机数字表法随机分为4 组:正常对照组(A 组)、手术切口组(B 组)、B 组基础上1.0ng/kg 纳洛酮+吗啡+芬太尼组(C 组)、B 组基础上吗啡+芬太尼10mg/kg 组(D组),每组10 只。实验时间2018 年1 月至9 月。
1.2 建模方法 B、C、D 组大鼠均给予戊巴比妥麻醉,麻醉完全后,常规备皮消毒,依据Brennan 法建立大鼠切口痛模型,具体方法:在距足跟近端0.5cm 至足趾长约1cm 的位置,切开皮肤和筋膜后,用镊子夹住足底肌肉并做一纵向切口,注意保持肌肉的完整性。按压止血后,用细线缝合皮肤,制成双针切口疼痛模型。所有操作时间均控制在5min 内完成。手术后,对切口进行消毒,并给予红霉素眼膏抗感染。随后,用特制的大鼠固定笼固定大鼠,采用SH-XYT 微型动物压痛仪(深圳市凯强力有限公司)测量双侧后肢及其侧面的疼痛阈值。该实验严格按照国际疼痛学会(IAP)指南进行操作。A 组大鼠正常喂养,不给予造模。
1.3 处理方法 切口疼痛模型建立20min 时,D 组鞘内注射吗啡5μg/kg+芬太尼0.25μg/kg 的混合液,C 组鞘内注射纳洛酮1.0ng/kg+吗啡5μg/kg+芬太尼0.25μg/kg 的混合液。A 组和B 组同时鞘内注射相同剂量的生理盐水。
1.4 行为学观察 鞘内注射药物5min 后,评估大鼠的疼痛行为。大鼠清醒后,观察后爪着陆和负荷,且后爪被压缩并变白以指示负重。后爪被抬起并计数,2分;后爪接地但未加载,1 分;后爪接地并装载,0 分。1 次/5min 观察大鼠疼痛行为变化,1min/次,以1min内最常采取的姿势作为观察标准,连续观察1h(总分24 分)。累积疼痛评分=侧足评分-对侧足部评分。
1.5 Real-time PCR 检测方法 取大鼠尾椎间盘样品,在液氮中速冻后快速进行研磨,按照RNA 提取试剂盒说明书的操作提取细胞总RNA,经Qubit Fluorometer检测RNA 的浓度及纯度,按逆转录试剂盒说明书,将总RNA 反转录cDNA,Real-time PCR 检测相关基因。在NCBI 数据库中查询目的基因的mRNA 序列,设计Real-time PCR 引 物,TLR4、MyD88、NF-κB 及 TNF-α 的引物委托北京六合华大基因合成,检测每个目的基因扩增的Ct 值,Ct 值与DNA 起始拷贝数呈负相关性,以双△Ct 值法计算靶基因的相对表达水平:三次平行重复实验的平均值作为每个样本的CT 值,△CT=CT(Target Gene)-CT(内参),反转录体系为(20μl):5×SYBR Green 实 时PCR 预 混 液4μl;iScript reverse transciptase 1μl;RNA template(1μg RNA)1μg。PCR 反 应 中 引 物 浓 度 为300~450nM,cDNA 模板100ng,反应参数为:预变性95℃~10min,变性 95℃~10s,退火Tm-6℃~20s,延伸72℃~33s,循环次数为40。
1.6 ELISA 检测方法 大鼠尾椎间盘样本TLR4、MyD88、NF-κB 及TNF-α、IL-6、IL-1β 的 定 量检测使用ELISA 检测试剂盒。设置标准孔、待测样品孔、空白孔。标准孔加入不同浓度的标准品,并加入待测样品,37℃孵育2h;每孔加入检测溶液(生物素化的一抗)100μl,酶标板加上覆膜,37℃孵育1h;弃去孔内液体,每孔用350μl 洗涤液洗涤,浸泡1~2min,重复洗板3 次;每孔加入HRP 标记的二抗100μl,酶标板加上覆膜,37℃孵育,30min;每孔加入90μl TMB 底物,酶标板加上覆膜,37℃避光显色15~25min;当标准孔的前3~4 孔出现明显梯度蓝色,终止反应,加入50μl 2M H2SO4;立即用酶标仪在450nm 处测量各孔的OD 值。
1.7 Western blot 取大鼠尾椎间盘样本,在液氮中快速研磨后,加入ReadyPrep 蛋白质萃取试剂提取组织的总蛋白,冰上进行适当频率的短促冲击,裂解混合物于4℃,13000r/min 离心20min。吸取上清液置于新的离心管中,用BCA 蛋白质定量试剂盒测定蛋白浓度。蛋白样品经SDS-PAGE 电泳,电泳后凝胶浸于转移缓冲液中平衡10min,装配转移“三明治”,电压100V,转膜45~60min。转膜完成后,用TBS 漂洗PVDF 膜10~15min;加入合适稀释度的一抗TLR4、MyD88、NF-κB 及TNF-α[用含1%(w/v)脱脂牛奶的TBST稀释],室温孵育2h,TBST 漂洗膜3 次,5~10min/次;用含0.05%(w/v)脱脂牛奶的TBST 稀释的二抗(1:10000,HRP 标记)孵育膜;TBST 漂洗膜3 次,5~10min/次。曝光,照相保存实验结果。Quantity one v4.62 软件分子条带灰度值(条带轨迹定量法),以目的蛋白/内参蛋白的半定量数值作为定量依据,并作统计分析。
1.8 统计学方法 采用SPSS19.0 统计软件进行分析。计量资料以(±s)表示,组间比较采用单因素方差分析,计数资料采用百分比表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 ELISA 法分析各组尾椎间盘中炎症TLR4/NF-κB 通路信号分子变化 与A 组比较,B 组大鼠尾椎间盘TLR4/ NF-κB 信 号 通 路TLR-4、MyD88、NF-κB、TNF-α 表达增强,差异有统计学意义(P<0.05)。与B 组比较,C 组和D 组大鼠尾椎间盘TLR-4、MyD88、NF-κB、TNF-α 表达降低,差异均有统计学意义(P<0.05),且C 组大鼠尾椎间盘TLR-4、MyD88、NFκB、TNF-α 表达显著低于D 组(P<0.05)。见表1。
表1 各组尾椎间盘中TLR4/NF-κB通路信号分子变化(±s)
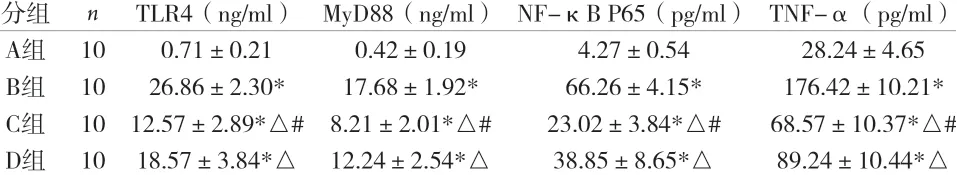
表1 各组尾椎间盘中TLR4/NF-κB通路信号分子变化(±s)
注:与A组比较,*P<0.05;与B组比较,△P<0.05;与D组比较,#P<0.05
分组 n TLR4(ng/ml) MyD88(ng/ml) NF-κB P65(pg/ml) TNF-α(pg/ml)A组 10 0.71±0.21 0.42±0.19 4.27±0.54 28.24±4.65 B组 10 26.86±2.30* 17.68±1.92* 66.26±4.15* 176.42±10.21*C组 10 12.57±2.89*△# 8.21±2.01*△# 23.02±3.84*△# 68.57±10.37*△#D组 10 18.57±3.84*△ 12.24±2.54*△ 38.85±8.65*△ 89.24±10.44*△
2.2 ELISA 检测方法分析各组尾椎间盘炎症因子IL-6、IL-1β 表达影响 与A 组比较,B 组大鼠尾椎间盘IL-6、IL-1β 表达增强,差异有统计学意义(P<0.05)。与B 组比较,C 组和D 组大鼠尾椎间盘IL-6、IL-1β 表达降低,差异有统计学意义(P<0.05),且C 组大鼠尾椎间盘IL-6、IL-1β 显著低于D 组(P<0.05)。见表2。
表2 各组尾椎间盘炎症因子IL-6、IL-1β表达(±s)

表2 各组尾椎间盘炎症因子IL-6、IL-1β表达(±s)
注:与A组比较,*P<0.05;与B组比较,△P<0.05;与D组比较,#P<0.05
分组 n IL-6(ng/ml) IL-1β(pg/ml)A组 10 0.71±0.21 28.24±4.65 B组 10 26.86±2.30* 178.42±10.21*C组 10 5.58±2.57*△# 35.54±10.74*△#D组 10 10.24±2.34*△ 78.24±10.3*△
2.3 各组累积疼痛评分 与A 组比较,B 组大鼠术后累积疼痛评分增加,差异均有统计学意义(P<0.05)。与B 组比较,C 组和D 组大鼠的累积疼痛评分减少,差异均有统计学意义(P<0.05);且C 组大鼠累积疼痛评分显著低于D 组(P<0.05)。见表3。
表3 各组累积疼痛评分[分,(±s)]
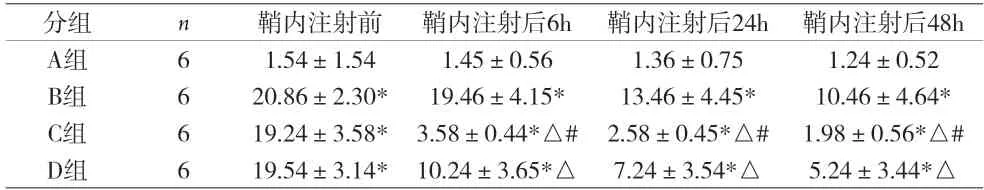
表3 各组累积疼痛评分[分,(±s)]
注:与A组比较,*P<0.05;与B组比较,△P<0.05;与D组比较,#P<0.05
分组 n 鞘内注射前 鞘内注射后6h 鞘内注射后24h 鞘内注射后48h A组 6 1.54±1.54 1.45±0.56 1.36±0.75 1.24±0.52 B组 6 20.86±2.30* 19.46±4.15* 13.46±4.45* 10.46±4.64*C组 6 19.24±3.58* 3.58±0.44*△# 2.58±0.45*△# 1.98±0.56*△#D组 6 19.54±3.14* 10.24±3.65*△ 7.24±3.54*△ 5.24±3.44*△
2.4 各组尾椎间盘中炎症TLR4/NF-κB 通路信号分子变化 与A 组相比,B 组大鼠尾椎间盘TLR4/ NF-κB信号通路TLR-4、MyD88、NF-κB、TNF-α 蛋白表达增强,差异均有统计学意义(P<0.05)。与B 组相比,C 组和D 组大鼠尾椎间盘TLR-4、MyD88、NF-κB、TNF-α 蛋白表达降低,差异均有统计学意义(P<0.05);且C 组大鼠TLR-4、MyD88、NF-κB、TNF-α 蛋白表达显著低于D 组(P<0.05)。见图1。
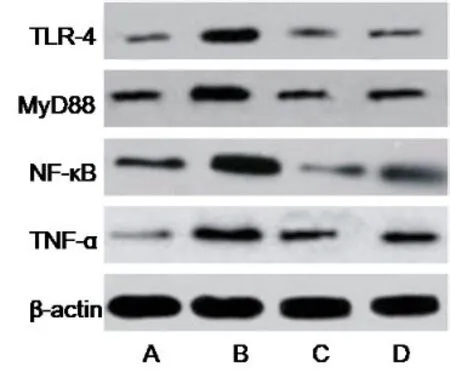
图1 Western blot法分析各组尾椎间盘中炎症TLR4/NF-κB 通路信号分子变化
3 讨论
术后疼痛是手术创伤后常见的症状[4]。疼痛的控制对术后康复及手术效果具有直接的影响作用[5]。术后切割痛是常见的急性疼痛,主要包括机械诱发的疼痛与静息状态下的疼痛,以往切口痛模型研究主要采用化学刺激产生的疼痛模型,但上述疼痛模型无论是疼痛过程还是疼痛机制均与创伤性疼痛的病理过程存在一定差异[6-7]。随着临床疼痛动物模型的不断发展,加速人们对临床疼痛症状的认识,因此,采用切割刺激模拟患者术后疼痛是最佳模型,较以往疼痛模型更能反映患者术后的应激状态与疼痛模式。本实验通过建立大鼠切割痛模型,以模拟术后切口的疼痛模式[8],结果显示,与正常对照组比较,其余各组大鼠术后累积疼痛评分显著增加,提示大鼠切割痛模型造模成功。
吗啡和芬太尼是临床常用阿片类镇痛药,鞘内注射吗啡镇痛作用起效较慢,血药浓度达到峰值时间约6h,但作用持久[9];而鞘内注射芬太尼起效较快,血药浓度达到峰值时间约1h,但半衰期较短,二者联合应用可产生协同作用,联合镇痛作用加强[10]。通过成功模拟慢性神经病理性疼痛模型给予上述药物治疗,结果显示,吗啡和芬太尼联合应用大鼠术后累积疼痛评分显著低于模型组,提示二者联合应用可显著减轻大鼠后足切割痛觉程度。纳洛酮是阿片受体拮抗剂,可拮抗因过量服用阿片类药物产生的各种毒副作用[11]。近年研究显示[12],小剂量的纳洛酮除能够拮抗或减轻吗啡的各种毒副作用,同时还能够增强吗啡的镇痛作用。但能够增强吗啡镇痛效能的纳洛酮剂量范围尚未确定。高明龙等[13]研究显示,1~100ng/kg的纳洛酮能显著增强吗啡对大鼠镇痛效能,但具体作用机制尚不明确。本实验结果显示,鞘内注射小剂量纳洛酮、吗啡混合芬太尼对大鼠后足切割痛觉的术后累积疼痛评分显著降低,优于吗啡联合芬太尼治疗,提示小剂量纳洛酮可显著增强吗啡联合芬太尼对切割痛大鼠的镇痛效能。
研究发现,免疫应答[14]和炎性反应[15]在术后疼痛的发生和发展中发挥重要作用。TLR 受体介导的信号通路在病原微生物引起的天然免疫和获得性免疫反应中发挥重要作用。TLR4、MyD88、NF-κB P65、TNF-α 是TLR4/ NF-κB 信号通路中具有代表性的受体[16-17]。TLR4 受体在病原微生物的刺激下,通过识别病原体相关分子模式(PAMP)向细胞内胞内传递信号,通过MyD88 的转接等介导多种跨膜信号激活下游NF-κB 等信号转录因子[18],引起IL-1、IL-6、IL-8、IL-10 和TNF-α 等多种炎性因子的释放,进一步导致炎性反应扩大。其中,TLR4 起主导角色。研究发现,TLR4/NF-κB 信号通路参与切口损伤后炎症反应的发生和发展[19]。在切口损伤的刺激下,可进一步激活中枢免疫细胞,促进IL-1、IL-6、IL-8 等炎性因子的分泌,导致炎症级联反应的进一步扩大,促进脊髓水平的信号的传导过程,导致痛觉过敏,同时,神经系统受到损伤后,还可进一步激活损伤神经处NF-κB 信号转导通路及其下游的炎症介质,进一步加重炎症反应[20]。本研究发现TLR4/NF-κB 信号通路相关蛋白在切口痛模型大鼠中的表达上调,同时尾椎间盘IL-6、IL-1β表达增强,提示TLR4/NF-κB 信号通路参与了切口损伤的炎症反应过程。而给予小剂量纳洛酮联合吗啡、芬太尼后大鼠尾椎间盘的TLR4/NF-κB 信号通路相关蛋白及IL-6、IL-1β 表达显著下调,表明小剂量纳洛酮联合吗啡、芬太尼可能通过抑制其尾椎间盘炎症TLR4/ NF-κB 信号通路及IL-6、IL-1β 的表达发挥增强镇痛效能的作用。
综上所述,鞘内注射小剂量纳洛酮联合吗啡、芬太尼对切口痛大鼠具有较好的镇痛效果,并能够抑制其尾椎间盘炎症TLR4/ NF-κB 信号通路及IL-6、IL-1β 的表达,提示其镇痛机制可能是通过抑制炎症TLR4/ NF-κB 信号通路及炎症因子的表达而实现。

