基于RNA干扰技术分析MCM7在涎腺腺样囊性癌中的作用
帅旌 宋艺蔚 朱欣 顾天忆 温庆良
涎腺腺样囊性癌(salivary gland adenoid cystic carcinoma,SACC)是常见的涎腺恶性肿瘤之一[1]。其易侵犯神经,可随血液播散,早期浸润性强。临床上表现为容易复发,易向远处转移,常见是血行转移,晚期转移至肺、骨骼和肝脏,其中肺转移率达40%[2]。然而目前SACC 转移及复发机制的相关研究依旧匮乏,但有研究发现SACC 的增殖、侵袭及转移与多种通路及分子有关[3-5]。微小染色体维持蛋白(minichromosome maintenanc,MCM)参与DNA 复制过程。MCM7 在G1期和S 期对细胞周期的调控作用,使其与细胞异常增殖及肿瘤形成等关系密切[6]。较多实验表明,MCM 蛋白的高表达是肿瘤发生的早期事件。2019 年6 月至10月作者通过实验研究,探讨MCM7 在涎腺腺样囊性癌中的作用。
1 材料与方法
1.1 细胞及试剂 原位涎腺腺样囊性癌细胞株SACC-83 及涎腺腺样囊性癌肺转移细胞株SACC-LM 由北京大学口腔医学院口腔颌面外科研究室提供。胎牛血清购于四季青公司,SDS-PAGE 凝胶制备试剂盒购于Solarbio 公司,CCK8 细胞增殖和毒性试剂盒购于Beyotime 公司,Transwell 购于Corning 公司,Matrigel购 于BD 公 司,MCM7 Antibody、GAPDH Antibody 购自Proteintech 公司,HRP 标记的羊抗小鼠二抗购自碧云天公司。siRNA 定制于百奥迈科生物技术有限公司,三种序列的siRNA-MCM7 分别为,序列1(正义链:5'-GGAUUGUGAAGAUGAACAAdTdT-3';反义链:5'-UUGUUCAUCUUCACAAUCCdTdT-3'),序列2(正义链:5'-GGAGAUGAAGAUGCAAGAAdTdT-3';反义链:5'-UUCUUGCAUC-UUCAUCUCCdTdT-3'), 序 列3(正义链:5'-GCAUUGAUGAGUUCGACAAdTdT-3';反义链:5'-UUGUCGAACUCAUCAAUGCdTdT-3')。
1.2 细胞培养 将SACC-83、SACC-LM 细胞置于含10%胎牛血清的RPMI-1640 培养基中,放置在37℃、5%CO2的细胞培养箱中培养,换液1 次/d,当贴壁细胞生长融合度达到90%时,胰蛋白酶消化传代,取处于对数生长期细胞进行实验。
1.3 Western blot 检 测SACC-83、SACC-LM 中MCM7蛋白表达 在PBL 溶液浸润中刮取培养瓶中处于对数生长期的SACC-83、SACC-LM 细胞,离心,去上清液,添加细胞裂解液,轻敲EP 管混合后迅速置于冰中,混合1 次/10min,共5 次。4℃,离心,保留上清液,采用BCA 试剂盒进行蛋白浓度矫正,加入loading buffer,煮沸。采用SDS-PAGE 凝胶制备试剂盒配胶,上样,观察溴酚蓝至凝胶最下缘终止电泳。转膜2h,封闭1h,TBST 洗涤3 次,一抗4℃孵育过夜。TBST洗涤3 次,稀释二抗室温结合2h,再于TBST 中洗涤3 次。采用ECL 发光液对SACC-83、SACC-LM 中MCM7 和内参GAPDH 条带进行曝光。实验重复3 次。
1.4 实验分组 将SACC-LM 细胞按照50%密度接种至6 孔板内,待细胞融合度至80%后,将细胞分为干扰组3 组、阴性对照组,每组3 孔。在干扰组中分别转染三个序列的siRNA-MCM7,在对照组中转染siRNA-Negative Control。置于37℃、5%CO2的细胞培养箱中培养,6h 后换液,培养48h 后进行后续实验。
1.5 Western blot 检测转染后各组中MCM7 蛋白表达 选择转染效率较高的2 组干扰组(si-MCM7-1、si-MCM7-2)与对照组(NC)进行实验。步骤同1.3。
1.6 细胞克隆实验测定细胞增殖情况 取对数生长期SACC-LM 细胞,以每孔1000 个细胞接种于6 孔板中,接种时多次吹打,接种后轻微晃动以均匀分散细胞。置于37℃、5%CO2的细胞培养箱中培养,96h 后对3组细胞集落计数。实验重复3 次。
1.7 CCK-8 法测定细胞增殖情况 取生长良好的对数期SACC-LM 细胞,以每孔3000 个细胞配置100μl 悬液,接种于96 孔板中,置于37℃、5%CO2的细胞培养箱中培养。将干扰1、2 组、NC 组各设置5 个复孔,于0、24、48、72h 分别将10μl CCK8 溶液在避光环境下加入各孔,用锡纸包裹继续培养3h。以NC 组为对照组,酶标仪测量490nm 处OD 值。实验重复3 次。
1.8 Transwell 小室检测细胞侵袭能力 用无血清的培养基将基质胶稀释,每孔20μl 基质胶固定,置于37℃恒温箱中放置40min。取对数生长期SACC-LM 细胞,用不含血清的RPMI-1640 培养液悬浮,细胞计数至8×104个/ml,上室加入细胞悬液200μl,下室加入500μl 含有10%胎牛血清的RPMI-1640 培养液。置于37℃、5% CO2的细胞培养箱中培养,24h 后多聚甲醛固定30min,结晶紫染色,PBS 润洗多次,晾干后于倒置显微镜下观察,选取合适平均视野拍照计数。实验重复3 次。
1.9 细胞划痕实验检测细胞迁移能力 取对数生长期SACC-LM 细胞,细胞计数至1×106/ml,接种于6 孔板中,待细胞融合度至80%后,用20μl 枪头尖划平行的直线,PBS 洗3 次,用无血清培养基置于37℃、5%CO2的细胞培养箱中培养,取相同位置分别于0、24、48、72h 拍摄。实验重复3 次。
1.10 统计学方法 采用SPSS25.0 统计软件。呈正态分布计量资料以(±s)表示,用t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 SACC-83、SACC-LM 细胞中MCM7 表达 恶性程度较低的SACC-83 中MCM7 表达水平低于恶性程度较高的SACC-LM。见图1。
2.2 验证siRNA 转染效率 3 组干扰组SACC-LM 细胞中MCM7 蛋白表达水平低于NC 组,选取si-MCM7序列1、3 组进行细胞功能实验,分别命名为si-MCM7-1 组和si-MCM7-2 组。见图2。
2.3 细胞增殖能力 细胞克隆实验结果显示,第96小时,干扰1、2 组SACC-LM 细胞集落形成密度小于NC 组(P<0.05)。CCK-8 结果显示,干扰1、2 组SACC-LM 细胞在第24、48、72h 的细胞存活率低于NC 组(P<0.05)。见图3。
2.4 细胞侵袭能力 Transwell 小室实验结果显示,干扰1、2 组SACC-LM 细胞侵袭数目低于NC 组(P<0.05)。见图4。
2.5 细胞迁移能力 细胞划痕实验结果显示,干扰1、2 组SACC-LM 细胞迁移能力低于NC 组(P<0.05)。见图5。
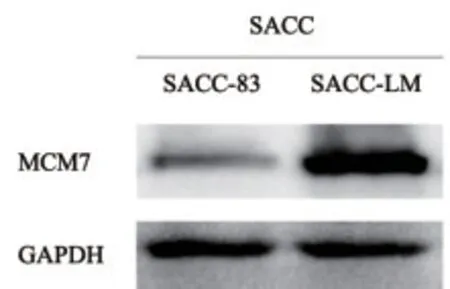
图1 MCM7蛋白在SACC-83和SACC-LM中的表达
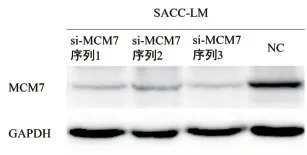
图2 细胞转染后MCM7蛋白在SACC-LM中的表达
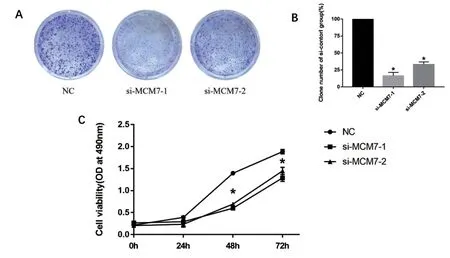
图3 MCM7干扰对细胞克隆(A、B)和细胞增殖(C)的影响

图4 MCM7干扰对细胞侵袭(D、E)的影响

图5 MCM7干扰对细胞迁移的影响
3 讨论
RNA 干扰技术(RNA interference,RNAi)是研究生物基因功能的重要工具,siRNA 是RNAi 的起始诱导物,参与形成沉默复合体,结合mRNA 切割使其断裂、降解,抑制靶基因表达[7]。本实验定制与MCM7具有同源性序列的双链RNA,转染,引起MCM7 基因沉默,研究其相关生物学功能,验证其作为癌基因促进SACC 进展的可能性。
MCM 蛋白在细胞中常以MCM2~7 六聚体发挥生物学功能,其为DNA 的复制许可复合物,在G1 期和S 期对细胞周期具有调控作用,与细胞增殖及肿瘤形成等关系密切[6]。MCM7 是MCM 核心三聚体之一,在MCM 蛋白作用过程中起重要作用[8]。
近年来,增殖标志物在肿瘤评估中发挥重要作用[9-12]。MCM7 是多种恶性肿瘤的重要增殖标志物[9-11]。Choy 等[11]报道食管鳞状细胞癌的病变程度增加,MCM7 蛋白表达程度增加,表明MCM7 表达与疾病进展呈正相关,因此在评估食管病变中MCM7 可能作为一个敏感的增殖标志物发挥关键作用。已有研究发现MCM7 的表达可辅助诊断部分头颈部恶性肿瘤,并且可以预测疾病预后。MCM7 在甲状腺乳头状癌组织中的阳性表达率远高于其在甲状腺腺瘤与结节性甲状腺肿中的阳性表达率[13]。鼻腔鼻窦鳞状细胞癌中MCM7的表达水平随着肿瘤分化程度的下降而升高[14]。Wen等[15]研究发现,T 分期晚期、邻近组织侵袭、神经侵袭和预后不良的SACC 患者病变组织中有更高MCM7表达可能。生存分析显示,MCM7 水平较高的患者术后无病生存期(Disease Free Survival,DFS)较短,预后较差。表明MCM7 可能通过调节异常细胞增殖来驱动恶性演进,从而预后不良。且在SACC 中,MCM7是比MCM3 更可靠的增殖标志。Wen 等[15]研究在组织学证明MCM7 可能作为癌基因促进涎腺腺样囊性癌的进展,但在细胞学层面尚未验证。
SACC-LM 是涎腺腺样囊性癌肺转移细胞株,MCM7 在SACC-LM 中的表达高于SACC-83,提示MCM7 的表达可能与肿瘤恶性程度相关。本研究结果显示,干扰组(si-MCM7-1 组、si-MCM7-2 组)与对照组比较,细胞增殖能力、侵袭能力及迁移能力均降低(P<0.05),于细胞学层面证明MCM7 可能通过调节异常细胞增殖来驱动恶性演进,与组织层面实验结果一致[15]。这可能是由于在DNA 复制中,MCM7 对于MCM2-7 解旋酶中的ATP 酶活性起到关键性的作用,抑制其表达可抑制细胞增殖,细胞增殖失控是恶性肿瘤侵袭、迁移的特征。已有研究显示MCM7 可能通过MCM7-MAPK-细胞周期蛋白D1 依赖性信号传导途径来促进癌症进展[16]有关通路。MCM7 有望成为SACC的治疗靶点,通过下调MCM7 蛋白,或能改善SACC的预后。

