DISS对卒中后抑郁大鼠神经递质的作用
叶梦瑶 邹文静 茅瑛琦 陈煜阳 潘晓芸 裘涛
脑卒中是重大公共卫生问题[1]。卒中后抑郁(Poststroke depression,PSD)作为最常见的卒中相关情绪障碍[2],其发病率在第1 年约为20%~50%,在卒中后的前6 个月达到高峰[3],卒中后<5 年可能影响1/3 的患者[4]。PSD 危险因素包括年龄、性别、抑郁病史、认知障碍、个性、卒中及残疾的严重程度、卒中的位置、社会支持等[5],其可能机制包括神经递质假说、免疫失衡假说,涉及神经解剖学、神经遗传学和社会心理学[6]。3,6’-二芥子酰基蔗糖(DISS)是远志的主要活性成分之一,具有抗抑郁[7]、脑保护[8]和神经细胞保护作用[9]。2016 年6 月至2017 年10 月作者通过实验研究,探讨DISS 对脑卒中后抑郁大鼠神经递质的影响。
1 材料与方法
1.1 实验动物 成年健康雄性SD 大鼠50 只(220~270g),清洁级,由上海斯莱克实验动物有限公司提供,批号:SCXK(沪)2012-0002。实验于浙江中医药大学动物实验研究中心进行,以5 只/笼群养标准安放大鼠,更换垫料1 次/2d,保持笼内环境清洁,保持昼夜更替,给予正常饮食,饲养2 周,予抓取1次/2d,使其适应动物房环境以及实验操作人员。
1.2 建立大鼠脑缺血模型 在改良Zea-Longa 线栓法[16]基础上通过大脑中动脉栓塞(MACO)法建立大鼠脑卒中模型。4h 后,利用Bederson 法评价大鼠神经功能受损情况。手术后神经功能评分为1、2、3 分的大鼠纳入后续实验,评分为0 分、4 分不纳入。MCAO造模后大鼠适应性饲养3d,将病情稳定的大鼠纳入后期制备实验卒中后抑郁大鼠,纳入总数为30 只。
1.3 制备PSD 大鼠模型与分组 经过卒中模型制备术后入组的大鼠进行每天单笼孤养及2h 束缚。束缚以大鼠不能转侧为标准,束缚时间从13 ∶00 至15 ∶00,连续21d。随机分为PSD+生理盐水(NS)组,PSD+氟西汀(Flx)组,PSD+DISS 组,以及正常组(CC 组),每组各10 只。
1.4 试剂准备及给药 DISS 纯度99.06%(HPLC)(成都曼斯特生物科技有限公司研制,批号:MUST-16070608)。盐酸氟西汀分散片(20mg×28 片/盒,批号:160622,厂家:PATHEON FRANCE)。10%水合氯醛(杭州昊天生物科技有限公司),9%生理盐水(杭州民生药业有限公司),给药周期为21d,从束缚第1天开始,束缚前30min,PSD+DISS 组予DISS 稀释液,给药量为4.7g/(kg·d)(按人体用药量换算成大鼠等效剂量),PSD+FLX 组予氟西汀药液灌服1 次,用量为1.8mg/(kg·d),正常组和PSD+NS 组则灌服等量生理盐水6.7ml/(kg·d)。
1.5 行为学实验 (1)体质量监测:称量各组大鼠在制备PSD 模型前、孤养束缚第7、14、21 天的体质量,并记录。(2)糖水偏好实验:于孤养束缚后第7、14、21 天进行糖水偏好试验,在第6 天对大鼠进行糖水适应饮用训练,即将2 瓶均为1%糖水在第1 个24h 内置于每个鼠笼,随后在第2 个24h 内将1 个水瓶换为纯净水,另1 个瓶仍为1%糖水;大鼠禁食禁水21h后开始实验,1 瓶1%糖水和1 瓶纯净水分别放置在每个测试鼠笼前,1h 后互换2 个水瓶位置,再过1h 后取瓶,测量并计算动物的糖水偏好程度。糖水偏好程度=糖水消耗量/总液体消耗量。
1.6 神经递质水平测定 具体操作方法按试剂盒使用说明书操作。该试剂盒采用生物素双抗体夹心酶联免疫吸附法(ELISA)测定样品中5-羟色胺(5-HT)、多巴胺(DA)、去甲肾上腺素(NE)水平。
1.7 统计学方法 采用SPSS 19.0 统计软件。计量资料以(±s)表示,组间比较用单因素方差分析,组间多重比较行LSD 检验。大鼠建模前体质量采用单因素方差分析,建模后体质量变化及糖水偏好程度用重复测量方差分析;对单胺递质分析采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠体质量比较 PSD 模型建立前各组实验大鼠体质量组间差异无统计学意义(P>0.05);各组大鼠4 个时间点体质量重复测量方差分析显示,组间 效 应F=31.066,P<0.001;时 间 效 应F=75.465,P<0.001;时间组别交互效应F=13.881,P<0.001。各组大鼠体质量随时间变化上升,组间差异有统计学意义,时间和组间存在交互效应。各组大鼠4 个时间点体质量两两分析显示:CC 组体质量大于其余各组;PSD+NS 组体质量小于其余各组;PSD+DISS组体质量小于PSD+FLX 组,差异均有统计学意义。见表1。
表1 各组大鼠体质量改变比较(±s)
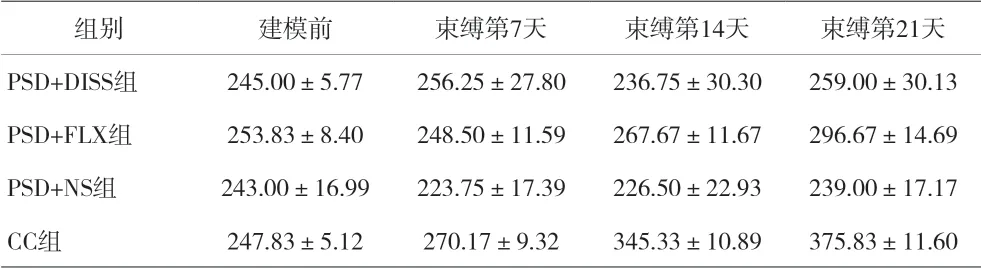
表1 各组大鼠体质量改变比较(±s)
注:F组间=31.066,P<0.001;F时间=75.465,P<0.001;F交互=13.881,P<0.001
组别 建模前 束缚第7天 束缚第14天 束缚第21天PSD+DISS组 245.00±5.77 256.25±27.80 236.75±30.30 259.00±30.13 PSD+FLX组 253.83±8.40 248.50±11.59 267.67±11.67 296.67±14.69 PSD+NS组 243.00±16.99 223.75±17.39 226.50±22.93 239.00±17.17 CC组 247.83±5.12 270.17±9.32 345.33±10.89 375.83±11.60
2.2 各组大鼠糖水偏好程度比较 各组大鼠3 个时间点糖水偏好程度重复测量方差分析显示,组间效应F=65.232,P<0.001;时间效应F=1.580,P=0.220;时间组别交互效应F=3.409,P=0.004。各组大鼠3 个时间点糖水偏好两两分析显示:CC 组糖水偏好高于PSD+FLX 组及PDS+NS 组,差异有统计学意义;PSD+NS组糖水偏好第14、21 天低于其余各组,差异有统计意义;PSD+DISS 组糖水偏好均高于其他组,差异有统计学意义。见表2。
表2 各组大鼠糖水偏好程度结果比较(±s)

表2 各组大鼠糖水偏好程度结果比较(±s)
注:F组间=65.232,P<0.001;F时间=1.580,P=0.220;F交互=3.409,P=0.004
组别 束缚第7天 束缚第14天 束缚第21天PSD+FLX组 0.71±0.03 0.71±0.05 0.72±0.02 PSD+DISS组 0.97±0.03 0.96±0.03 0.97±0.01 PSD+NS组 0.72±0.02 0.69±0.07 0.58±0.07 CC组 0.85±0.07 0.78±0.09 0.83±0.03
2.3 各 组5-HT、DA、NE 水 平 比 较 在5-HT 和DA 水平测定中,与CC 组比较,除PSD+FLX 组外,其余PSD 组均较低(P<0.05);与PSD+NS 组比较,PSD+DISS、PSD+FLX 组5-HT 和DA 水平较高(P<0.05)。在NE 水平上,PSD+FLX 组高于CC 组(P<0.05),其余PSD 组均低于CC 组(P<0.05),且NS 组最低;与NS 组比较,其余两个PSD 组均较高(P<0.05)。见表3。
表3 各组5-HT、DA、NE水平比较(±s)

表3 各组5-HT、DA、NE水平比较(±s)
注:与CC组比较,▲P<0.05;与PSD+NS组比较,*P<0.05;与PSD+FLX组比较,#P<0.05
分组 5-HT DA NE PSD+NS组 32.33±5.40▲ 444.15±71.25▲ 41.75±6.75▲PSD+FLX组 56.56±3.45* 867.80±59.36* 68.20±4.17▲*PSD+DISS组 39.02±2.02▲*# 629.59±57.22▲*# 51.77±4.09▲*#CC组 52.89±4.01 868.55±57.78 64.81±2.83
3 讨论
PSD 是脑卒中最常见的并发症之一,在我国脑卒中患者的发病率>40%[10],其临床可表现为情绪低落、兴趣丧失、思维迟缓等。PSD 患者病死率较单纯脑卒中患者高3~4 倍,因此临床将PSD 视为预防二次脑卒中的关键环节。PSD 的发病机制复杂,涉及神经生物学、神经解剖学、社会心理学、神经内分泌学等诸多因素。目前多项发病机制均涉及5-HT、NE、DA 等单胺递质的变化,如生物学机制认为脑卒中患者脑部血流量的异常损伤额叶与边缘系统,破坏额叶-纹状体-苍白球-丘脑皮质环路,造成5-HT 和NE 等神经递质代谢异常,从而导致PSD 的发生。从单胺能递质角度进一步研究发现,缺血性病变可能阻断来自中脑和脑干的投射,致使5-HT、NE 和DA 下降,导致PSD的发生[11]。
本实验中,以MACO 及孤养束缚进行造模。刘福友等通过此造模及行为学评价、单胺递质的测定证实本实验复合制备的脑卒中后抑郁大鼠模型思路可行,造模是成功的[12]。通过查阅文献也发现,MACO 联合孤养束缚是应用广泛的造模方法,且造模确切、成功。
远志被用于镇静、缓解精神不安和提高学习与记忆能力[13],DISS 作为远志的主要活性成分,在以往研究中发现,其在抗抑郁作用中起重要作用。施振国等[14]认为,DISS 的抗抑郁机制可能是通过神经元保护和神经元再生实现的。赵润清[15]认为DISS 参与启动CREB 共转录因子CRTC1,激活海马内CREB 的磷酸化,进而增加其下游BDNF 表达,发挥抗抑郁作用。陈旭[16]认为DISS 可以激活CREB 磷酸化的上游通路和钙调蛋白激酶上的关键靶点CaMK 和 ERK,促进CREB 磷酸化过程,并进一步通过激活磷酸化CREB,与基因转录启动区的特殊组件结合刺激mRNA 的转录,调节下游靶基因bax、bcl-2 并调节氧化应激等细胞因子的水平,通过这些细胞因子进一步影响神经可塑性神经分化、神经营养及神经联系及信号整合发挥抗抑郁作用。
本资料结果显示,模型组PSD+NS 组大鼠较CC组大鼠体质量减轻、糖水偏好程度下降,单胺递质浓度降低,提示模拟出PSD 患者体质量下降、兴趣感减退和脑内单胺类递质降低等表现,表明造模成功。治疗组单胺递质水平结果均优于PSD+NS 组,表明FLX及DISS 的治疗在一定程度上是有效的。PSD+DISS 组明显优于PSD+FLX 组,且在实验全过程均保持较高水平;但在体质量及单胺递质水平方面,虽然PSD+DISS组优于PSD+NS 组,但仍低于PSD+FLX 组,差异有统计学意义。
综上所述,DISS 对PSD 的改善可能通过提高5-HT、DA、NA 浓度水平发挥作用,然而,本研究仅基于行为学实验及单胺类递质浓度水平的测定对DISS的作用进行初探,其上游机制仍未明确,后期可进一步对上游通路CaMK Ⅱ-Cx43 信号通路的可能性作进一步深入研究以揭示药物作用靶点,为其临床应用提供实验依据。

