新型抗菌肽DP7对大鼠骨髓间充质干细胞影响探讨
任 静,青 薇,郑佳俊,黄 杰,彭湃然,牟雁东,2
(1.西南医科大学口腔医学院,四川 泸州 646000;2.四川省医学科学院·四川省人民医院,四川 成都 610072)
炎症引起的口腔疾病,如牙周炎,常常引起牙槽骨的吸收和结缔组织的破坏。牙周炎是发生于牙支持组织的炎症性感染性疾患,是口腔领域中两大多发病之一,常引起牙槽骨吸收、牙松动甚至脱落,是破坏人类咀嚼器官的最主要疾病[1]。牙菌斑作为牙周炎发病的始动因子,在牙周炎的发生、发展中起着至关重要的作用。牙菌斑的致病性,主要是通过菌体内毒素、细酶及其释放的的外毒素与细胞因子和代谢产物等直接破坏牙周组织,牙周致病菌的内毒素(lipopolysaccharide,LPS),是革兰阴性菌的细胞壁成分,由菌体崩解后释放而出,还能够通过细菌抗原成分活化宿主的多种防御细胞,促进肿瘤坏死因子α(TNF-α)、白介素-1β(IL-1β)、核因子受体激活剂(RANKL)等因子的释放,引发局部的免疫反应,导致牙周组织的继发性损伤[2]。
抗菌肽(antibacterial peptide,AMP)广泛存在于真菌、细菌、昆虫、植物及动物体内,作为免疫系统的天然防线,对宿主抵抗外来生物入侵具有非常重要的意义[3]。此外,某些抗菌肽还具有免疫调节性能[4],能够趋化单核细胞、中性粒细胞、淋巴细胞等向炎症部位聚集,同时抑制LPS引起的炎症反应[5],抑制TNF-α、IL-1β、IL-6等炎性因子的产生,以及促进血管形成,促进受损区域组织愈合[6]。因此,在生物医学领域,抗菌肽受到越来越多的关注,有望进一步开发与利用。本实验拟使用的阳离子AMP DP7(VQWRIRVAVIRK)为四川大学国家重点生物实验室自主研发的新型12-氨基酸亚梨子亲水小分子抗菌肽,已证明其具有广谱抗菌性、较好的生物相容性[7],在体内外均能够对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌等产生良好的抑制效果,并能够抑制LPS引起的TNF-α、IL-1β的释放[8]。
骨髓间充质干细胞为骨组织损伤后修复的重要细胞,能够分化为成骨细胞,进而形成新骨[9]。若新型阳离子抗菌肽DP7在具有良好抗菌性能的同时,能够促进骨髓间充质干细胞成骨分化,将为牙周炎的临床治疗开辟新思路和新方法。
1 材料与方法
1.1 材料2019年1~5月,选择4周龄清洁级SD雄性大鼠(由四川省人民医院动物实验中心提供),体重(60.4±10.2)g;DP7(VQWRIRVAVIRK)由四川大学国家重点生物实验室自主合成并纯化;实验试剂:胎牛血清(FBS)、DMEM 培养基、0.25%胰酶(Gibco,美国)、青霉素/链霉素-双抗(Sigma,美国)、成骨诱导液(含5%胎牛血清,DMEM,10 nmol/ L地塞米松,10 mmol/ ml β-磷酸甘油钠、50 μg/ ml L-抗坏血酸),CCK-8试剂盒(FIUORESCENCE),ALP试剂盒(南京建成,中国),茜素红S(Sigma,美国)等。本研究经四川省人民医院伦理委员会批准[伦审(研)2018年第296号]。
1.2 方法
1.2.1细胞的分离和培养 4周龄清洁级SD雄性大鼠由7%水合氯醛麻醉,消毒,切开腿部皮肤和肌肉,钝性分离后离断大鼠股骨和胫骨,剪开股骨两端的骨骺端,配比含有青霉素/链霉素的DMEM培养基,反复冲洗骨髓腔,获得细胞悬液。800 r/min离心5 min,弃上清,以1×106/ml的细胞浓度接种于培养皿中,置于37 ℃,5%CO2恒温培养箱中,此时为P0代。原代培养5 d后进行全液换液,约达到80%融合时,0.25%胰酶消化,将其接种于新的培养皿,此时记为P1代,每3 d更换培养基,按照上述方法继续传代培养至P3代备用。
1.2.2CCK8检测细胞增殖情况 取P3代骨髓间充质干细胞,已完成流式检测,符合间充质干细胞的特性,可以纳入后续实验。收集细胞悬液,取1×104个细胞接种到96孔板中,每孔100 μl,共设置3个复孔,培养12小时。分别加入DP70、0.05、0.1、0.2、0.5、1、2、4 mg/ml,分别处理4天后,每孔加入20 μl CCK8溶液,继续培养4 h。向每孔中加入20 μl 终止液,立即混匀,用酶标仪测定在450 nm处的吸光度,吸光度值与细胞的增殖能力成正比。
1.2.3细胞划痕检测迁移能力 将对数生长期的细胞用胰酶消化后按一定细胞密度接入六孔板中。贴壁生长24 h时后,融合达到80%;在盘底用记号笔画线作为标记,吸去培养液,用10 μl枪头垂直于记号笔标记划去盘中细胞;用PBS冲洗去除划下的细胞,按照以上分组进行细胞处理。在0、24、48、72 h分别拍照,观察细胞迁移情况。
1.2.4成骨诱导分化 待BMSCs生长增殖至80%融合时,收集细胞悬液,取2.5×104个细胞接种到24孔板中,37 ℃,体积分数5%CO2培养箱静置培养过夜;第2 d移除孔板内原有培养液,换成骨诱导液(含5%胎牛血清,DMEM,10 nmol/L地塞米松,10 mmol/mlβ-磷酸甘油钠、50 μg/ml L-抗坏血酸)。各孔按照实验分组分别加入0、32、48、64 mg/L DP7。后每3 d换液,至实验设置的时间为止。
1.2.5ALP染色 诱导结束后,将各组细胞用4%多聚甲醛固定。移除孔板内培养基,PBS洗涤2次,每次3 min,每孔加入400 μl 4%多聚甲醛,室温15 min;PBS洗涤2次,每次3 min;配制反应工作液。取24 μl 25×NBT 加入到 0.6 ml 1×AP 反应缓冲液中,混匀后,再加入 24 μl 25×BCIP 混匀,即反应工作液;各实验孔分别加入300 μl反应液,置37 ℃,1 h;移除反应液,加入去离子水终止反应;显微镜下拍照。
1.2.6茜素红染色 诱导结束后,将各组细胞用70%乙醇固定。移除孔板内培养基,PBS洗涤2次,每次3 min,每孔加入400 μl 70%乙醇,室温1 h;去离子水洗涤2次,每次3 min;各实验孔分别加入300 μl 1%茜素红染液,置37 ℃,20 min;移除反应液,加入去离子水终止反应;显微镜下拍照。
1.3 统计学方法采用SPSS 17.0统计软件进行数据分析,所有数据以均数±标准差表示,组间比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 骨髓间充质干细胞形态学观察镜下观察可见细胞开始呈长梭形呈旋涡状生长,几乎全部融合,大小形态均匀一致。见图1。
图1 BMSCs体外培养光镜下形态学观察(×40)
2.2 CCK-8检测细胞活力0.05 mg/L抗菌肽组细胞细胞增殖能力与0 mg/L组相比,差异无统计学意义(P>0.05);其余各细胞细胞增殖能力低于0 mg/L组,差异有统计学意义(P< 0.05),见图2。

图2 大鼠BMSCs细胞活力测试
与0 mg/ml组比较,***P< 0.001;**P< 0.01;*P< 0.05
0、0.05、0.1、0.2、0.5、1、2、4 mg/mL代表相应抗菌肽浓度处理组
2.3 细胞划痕检测迁移能力与0 mg/L抗菌肽组相比,16、32、48、64 mg/L抗菌肽组细胞迁移能力降低,且浓度增高,细胞迁移能力减弱;随着时间的增加,细胞迁移能力增强。见图3,图4。
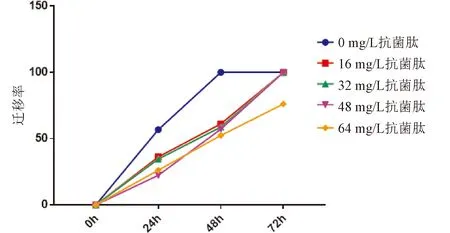
图3 各组细胞不同时间点细胞划痕相对距离百分比

图4 不同浓度抗菌肽处理后细胞迁移能力(×100) a:0 mg/L抗菌肽组;b:16 mg/L抗菌肽组;c:32 mg/L抗菌肽组;d:48 mg/L抗菌肽组;e:64 mg/L抗菌肽组
2.4 不同浓度抗菌肽处理后细胞ALP染色不诱导组ALP含量很少;成骨诱导组中,0、16、32 mg/L抗菌肽组ALP含量较多,染色较深,64 mg/L抗菌肽组钙结节含量较少,染色较浅。见图5。
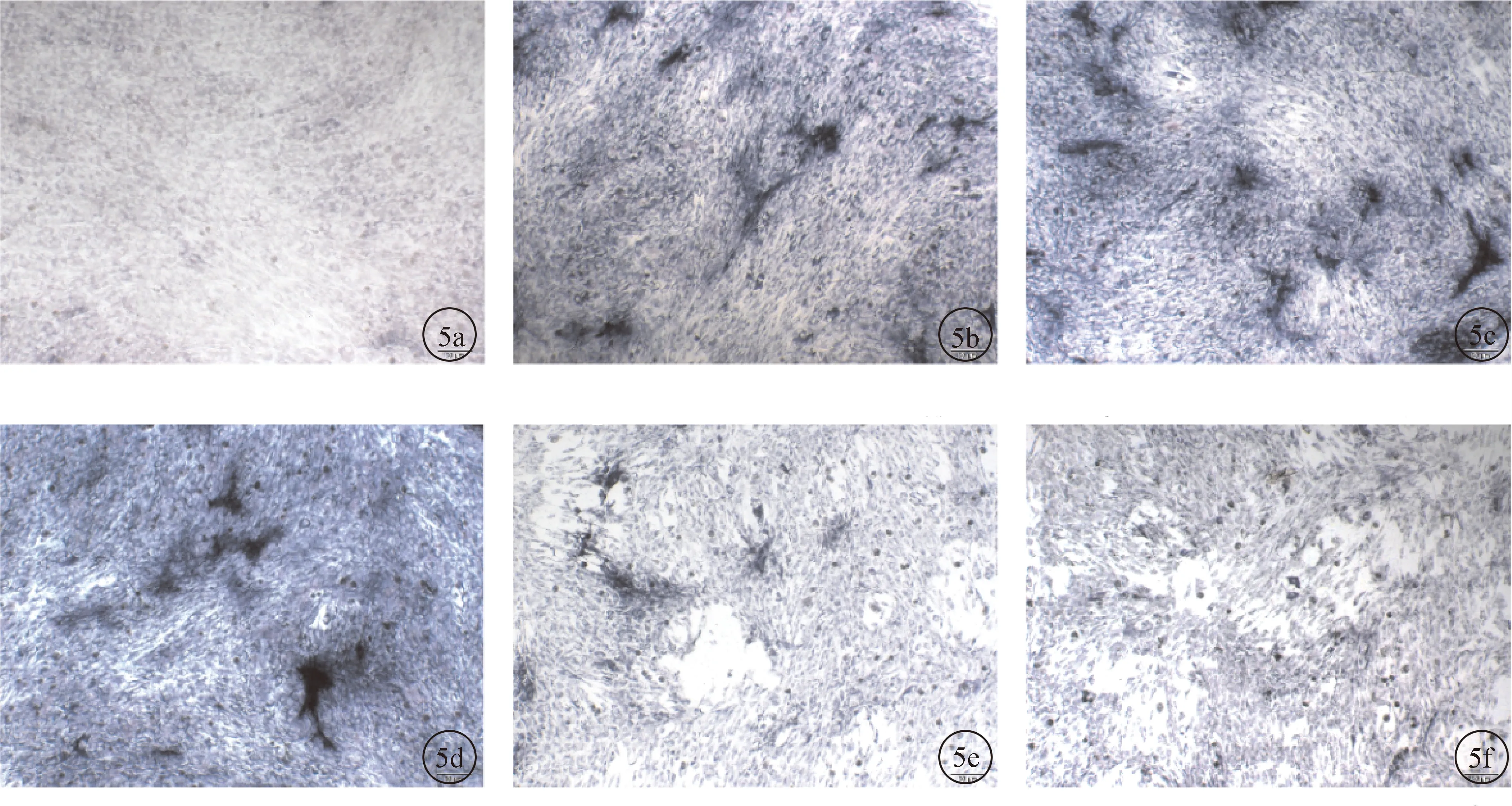
图5 不同浓度抗菌肽处理后细胞ALP染色 a:不诱导组;b:成骨诱导+0 mg/L抗菌肽组;c:成骨诱导+16 mg/L抗菌肽组;d:成骨诱导+32 mg/L抗菌肽组;e:成骨诱导+48 mg/L抗菌肽组;f:成骨诱导+64 mg/L抗菌肽组(×100)
2.5 不同浓度抗菌肽处理后细胞茜素红染色不诱导组无钙结节形成;成骨诱导组中,0、16、32 mg/L抗菌肽组钙结节含量较多,64 mg/L抗菌肽组钙结节含量较少。见图6。

图6 不同浓度抗菌肽处理后细胞茜素红染色 a:不诱导组;b:成骨诱导+0 mg/L抗菌肽组;c:成骨诱导+16 mg/L抗菌肽组;d:成骨诱导+32 mg/L抗菌肽组;e:成骨诱导+48 mg/L抗菌肽组;f:成骨诱导+64 mg/L抗菌肽组(×100)
3 讨论
牙周病是口腔两大主要疾病之一,晚期常常引起牙松动甚至脱落,是牙列缺损最主要的原因。临床上常用龈上洁治、龈下刮治、根面平整等方法去除龈上下结石,但难以从根本上完全消除牙菌斑。四环素类药物常常作为牙周炎的辅助药物治疗。然而,在治疗的同时也会带来其他的毒副作用,治疗过程中为了保持足够的需要浓度也会引起细菌的耐药性。此外,普通抗生素也不具备促进成骨的效能。
抗菌肽作为天然免疫系统的第一道防线[3],广泛存在于各种动物、植物中,对宿主抵抗微生物入侵具有重要意义,在具有良好抗菌性的同时也不会产生耐药性,成为最具潜力的抗菌药物[10]。抗菌肽具有广谱抗菌性,能够对多种革兰阳性菌、革兰阴性菌具有杀灭作用,且不引起细菌耐药性[11],是最具有潜力的抗菌药物之一,有望取代抗生素。Liu等[12]通过用MSCs和脂多糖(Lipopolysaccharide,LPS)诱导的小鼠颅骨溶骨性骨缺损模型进行体外和体内研究,发现抗菌肽LL37显著促进MSC细胞分化,迁移和增殖,还能体外抑制LPS诱导的破骨细胞形成和细菌活性。KRSR多肽涂层能很好的促进大鼠骨髓间充质干细胞粘附和成骨分化[13]。已有研究表明,抗菌肽LL-37具有免疫调节作用,能够趋化抗炎因子如IL-1ra、IL-10等聚集到炎症部位[12];自组装抗菌肽KLD-12既具备良好的抗菌能力,又能促进组织的快速愈合[14];杆菌肽通过刺激骨形态发生蛋白-2/Smad轴促进骨髓间充质干细胞的成骨分化[15];阳离子抗菌肽P15-CSP具有独特的双重能力抑制生物膜的形成,并作为亲水性表面的涂层增强成骨活性[16]。本课题为了研究DP7是否也会对骨髓间充质干细胞成骨分化产生影响。
本实验结果表明,高浓度的抗菌肽DP7对大鼠骨髓间充质干细胞增殖具有一定的抑制作用,且随着浓度的增加愈发明显。但在100 mg/L浓度范围以内,存活率均达80%以上,尚未造成大鼠BMSCs细胞活力的明显影响。因此,后续实验细化实验浓度,采用0、16、32、48、64 mg/L浓度进行下一步实验。细胞迁移实验是反应细胞迁移能力的方法[17],骨组织的损伤后修复依赖于成骨相关细胞的迁移,通过检测划痕变化反应骨髓间充质干细胞迁移能力的快慢。划痕区域相对距离减短,说明细胞的迁移能力增加。划痕实验结果表明,随着抗菌肽浓度的增加,细胞迁移能力逐渐减弱。经过查阅文献及对DP7生产加工过程进行追溯,分析原因可能是由于抗菌肽生产过程中加入了某些具有细胞毒性的试剂,造成DP7对细胞具有一定毒性作用。
ALP为成骨细胞早期分化的标志物,其活性高低可以客观反映成骨分化程度[18]。而钙结节则是成骨细胞分化晚期的标志物,钙结节的量客观反映细胞成骨性能高低[19]。本实验结果也说明抗菌肽DP7对大鼠骨髓间充质干细胞体外成骨性能具有一定的促进作用,且在32 mg/L浓度下作用最明显,此浓度下,DP7既能够使ALP活性增加,又能够促进钙化。这与理想效果下以剂量依赖的方式促进大鼠BMSCs成骨分化有所出入。原因可能是随着共培养时间的增加,高浓度的DP7对大鼠骨髓间充质干细胞的毒性作用超过了成骨促进作用,造成大鼠BMSCs的凋亡。
考虑到本实验中所用抗菌肽DP7控制感染的作用及促进成骨的潜力,制备出同时具有良好抗菌性能和促进成骨性能的新型实用抗菌肽意义重大。因此,下一步将对抗菌肽DP7进行进一步的改性,在保留其良好广谱抗菌性的同时,降低其对细胞的毒性作用。

