自身免疫性甲状腺炎患者血浆中Th1/Th2细胞及甲状腺自身抗体水平变化及临床意义
汪 湲,康志强,张小芳,许玲玉
(郑州大学附属郑州中心医院 a.内分泌科,b.药学部,河南 郑州 450007)
自身免疫性甲状腺炎(AIT)又被称为淋巴细胞性甲状腺炎或桥本甲状腺炎,多与遗传、环境、过量碘摄入、病毒感染、维生素D缺乏及吸烟等因素有关[1],尤其好发于中年女性。由于起病隐匿性强,AIT早期临床症状轻微或不能发现任何症状,即便通过影像学及甲功五项检测,也较容易与其他病因引起的非炎症性甲亢相混淆,诊断准确性较低[2]。甲状腺自身抗体检测已成为AIT确诊的必要依据[3],但不同的免疫性疾病也可引起相关指标变化,因此仍有待结合其他指标加以佐证。免疫球蛋白G4(IgG4)相关性疾病是近年来备受关注的自身免疫性疾病新定义,由于该物质能促进淋巴浆细胞浸润[4],可进攻多种脏器,导致病变进程加快,已报道有肾病、硬化性胆管炎等脏器受累而预后恶化的研究[5,6],但对IgG4相关性甲状腺疾病的研究仍停留在临床特点分析阶段[7],较少深入分析与检测指标变化之间的联系。本研究探讨相关指标在AIT诊断及病情评估方面的检测价值,现报道如下。
1 资料与方法
1.1 一般资料2014年5月至2019年4月我院收治的96例AIT患者。纳入标准:①临床表现、实验室检查及细针穿刺细胞学活检结果均符合AIT相关诊断标准[8];②年龄≥18岁;③检查结果完善且临床资料完整。排除标准:①诊断出合并其他甲状腺疾患;②已执行药物、放疗、手术等干预措施;③存在其他内分泌、自身免疫性及全身疾病;④近期应用免疫调节剂;⑤妊娠期或哺乳期妇女。男11例,女85例;年龄20~59岁[(42.16±9.43)岁];超声下腺体体积(25.12±8.68)cm3;甲功五项促甲状腺激素(FSH)(17.93±3.54)mU/L,游离三碘甲状腺原氨酸(FT3)(2.19±0.47)pmol/L,游离甲状腺素(FT4)(7.06±1.78)pmol/L,总三碘甲状腺原氨酸(TT3)(0.52±0.10)nmol/L,总甲状腺素(TT4)(40.93±6.57)nmol/L。根据其血浆免疫球蛋白G4(IgG4)检测情况分为阳性组(IgG4>1.35 g/L,n=34)与阴性组(IgG4≤1.35 g/L,n=62)[9~11],并将同期确诊的47例非炎症性甲亢患者纳入对照。
1.2 方法常规采集患者静脉血4 ml、3 ml分别装入抗凝管a、b,4 ℃冰箱内保存,并在0.5 h内开展标本处理。
1.2.1外周血辅助性T淋巴细胞(Th)1、Th2细胞检测方法 a管血样转入干燥离心管,加入CD4-PC5单抗,混匀后避光37 ℃温育30 min染色,磷酸缓冲液(PBS)洗涤后以1500 r/min转速离心10 min,弃去上清后以吸水纸吸干;依次加入含10%胎牛血清、1%双抗的洛斯维·帕克纪念研究所-1640(RPMI-1640)培养基、丙二醇甲醚乙酸酯(PMA)工作液、莫能霉素工作液,制备成1 ml细胞刺激培养体系;经由温育、洗涤、离心、破膜、固定、再温育、再离心、荧光素标记、再温育、再离心、重悬等处理过程后,置入流式细胞管内送Beckman Coulter流式细胞仪检测并计算出Th1/Th2水平。
1.2.2血浆学指标检测方法 b管血样转入干燥离心管,以4500 r/min转速离心15 min,提取上清液作为检测标本适当稀释,预先将冷冻储存的抗甲状腺球蛋白抗体(TGAb)、抗甲状腺过氧化物酶抗体(TPOAb)、促甲状腺激素受体抗体(TRAb)、IgG4试剂盒放置于室温下恢复适宜温度;逐级稀释标准液,加生物素化抗混匀,封膜温育后弃去孔内液体,洗涤并加入等体积辣根过氧化物酶标记的链霉亲和素并混匀,封膜温育;弃去孔内液体并洗涤、拍干,加底物溶液,封膜避光温育约15 min;立即送入全自动酶标仪,拟合出该物质的标准曲线,以样品孔吸光度换算相应物质在血浆中的浓度水平。
1.3 统计学方法采用SPSS 19.0统计学软件分析数据。计量资料比较采用t检验;建立二元Logistic回归模型,将病种(赋值1=“AIT”、0=“非炎症性甲亢”)、组别(赋值1=“阳性组”、0=“阴性组”)纳入因变量,将相关计量指标作为协变量,方法为Enter,设定返回概率,并将其作为联合诊断的独立指标用于诊断效能评估;将诊断信息录入Medcalc 18.2版本软件中,选取受试者工作特征(ROC)曲线对比,分别设置变量与分类标准,选择不同诊断条件曲线下面积(AUC)比较方法为DeLong检验,记录AUC、95%CI、灵敏度、特异度、cut-off值等参数信息。检验水准α=0.05
2 结果
2.1 相关指标诊断效能评估Th1/Th2、TGAb、TPOAb、TRAb诊断AIT的cut-off值分别为12.83、228.13 U/ml、503.63 U/ml、33.45 U/L,ROC曲线AUC均明显小于联合诊断(P< 0.05),联合诊断灵敏度为90.62%,特异度为97.87%,见图1、表1。
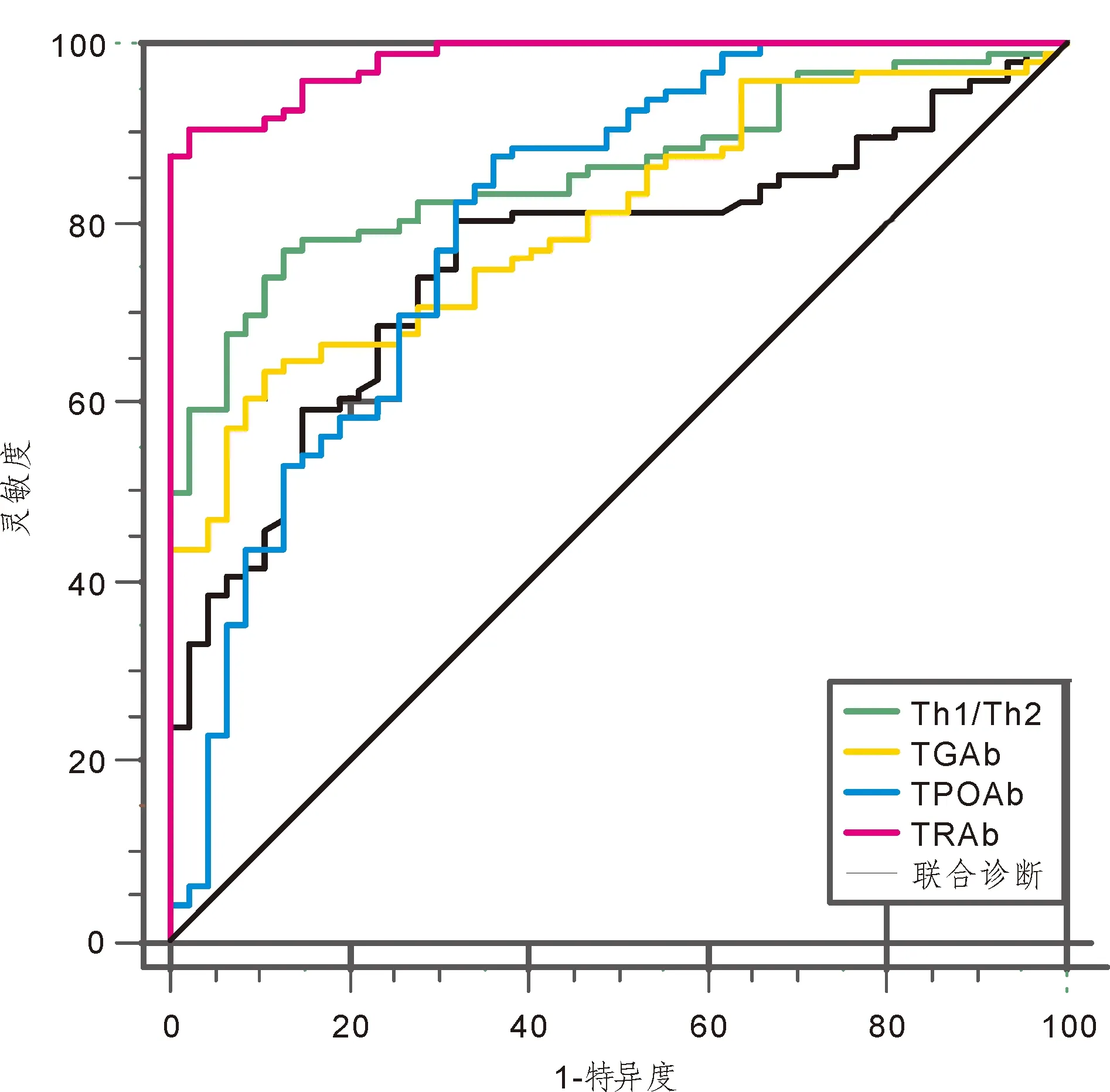
图1 Th1/Th2、TGAb、TPOAb、TRAb分别及联合诊断AIT的ROC曲线
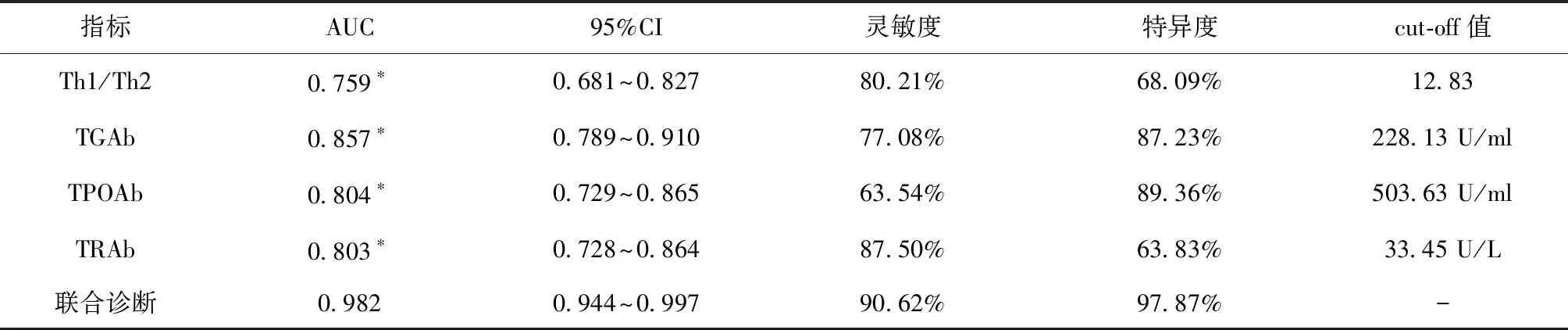
表1 ROC曲线相关参数
*与联合诊断比较,P< 0.05
2.2 AIT患者与非炎症性甲亢患者相关指标比较
AIT患者Th1/Th2及血浆TGAb、TPOAb水平低于非炎症性甲亢患者,血浆TRAb水平低于非炎症性甲亢患者(P< 0.05),见表2。
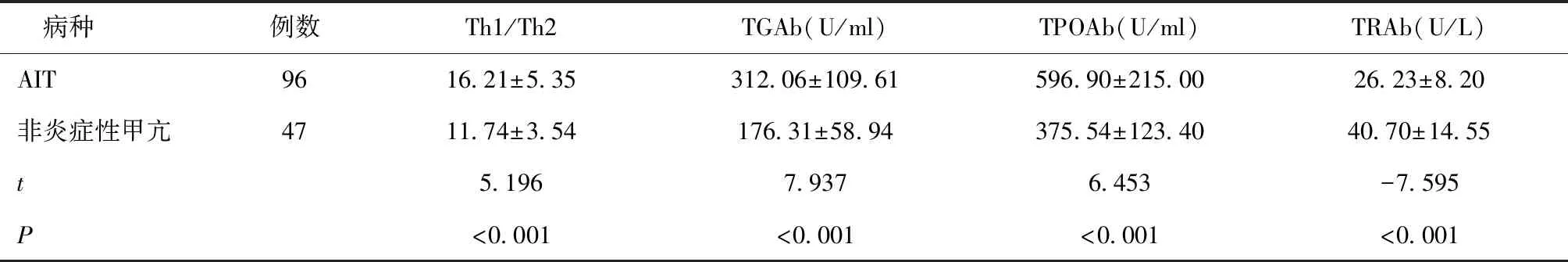
表2 AIT患者与非炎症性甲亢患者Th1/Th2及血浆TGAb、TPOAb、TRAb水平比较
2.3 不同IgG4表达情况AIT患者相关指标比较
两组Th1/Th2、TRAb水平比较差异均无统计学意义(P> 0.05),而阳性组TGAb、TPOAb水平高于阴性组(P< 0.05),见表3。
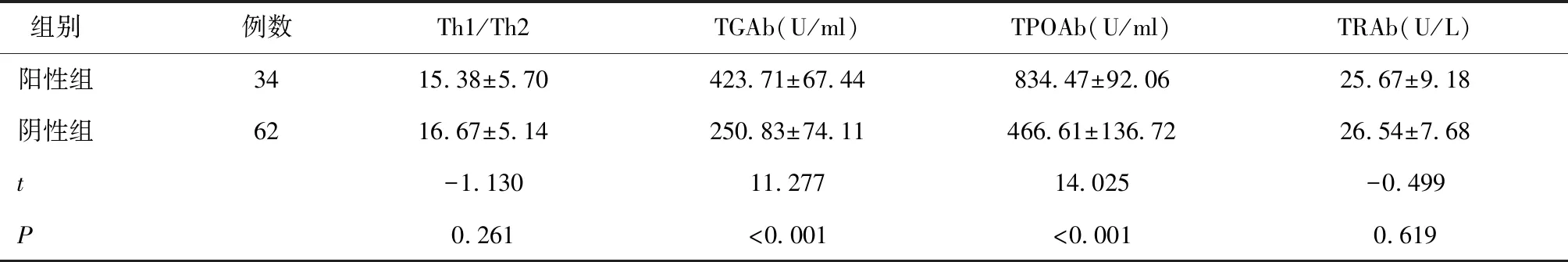
表3 两组Th1/Th2及血浆TGAb、TPOAb、TRAb水平比较
2.4 相关性分析AIT患者Th1/Th2、TRAb水平与IgG4水平未见相关性(P> 0.05),TGAb、TPOAb水平与IgG4水平呈正相关(P< 0.05),见表4。

表4 Th1/Th2、TRAb、TGAb、TPOAb与IgG4水平的相关性分析
3 讨论
Th是在特异性免疫应答中起到主要调节作用的淋巴细胞,可分化出Th1、Th2两种亚型,前者,可介导细胞免疫作用,清除病原体并诱使免疫细胞浸润,而后者主要介导体液免疫,清除抗原并发挥抗过敏作用,正常情况下二者相互调节可达到动态平衡状态,维持免疫系统正常运转[12]。本研究中,AIT患者Th1/Th2水平显著较非炎症性甲亢患者更高,其水平≥12.83可高风险提示为AIT,这表明Th1/Th2平衡向Th1漂移可诱发AIT,通过表达相关细胞因子强化其浸润后的增殖及损伤效率。相关学者表示,Th1/Th2失衡程度与AIT病情严重程度密切相关,可通过Th1细胞表面特异性标志抗原CD4+CCR5+[13],预测TPOAb增高幅度及疾病转归情况。
有关研究指出,TSAb具有类似TSH作用,与TSHR结合后,可促进甲状腺激素合成,引发包括格雷夫斯病在内的非炎症性甲亢;而TSBAb与TSHR结合后则不能激活细胞膜表面的腺苷酸环化酶,还将阻碍受体与TSH结合,抑制甲状腺激素合成而引发甲减,二者同时存在则容易引起甲亢-甲减病情反复。本研究结果显示,AIT患者血浆TRAb水平显著较非炎症性甲亢患者更低,其水平≤33.45 U/L可高风险提示为AIT,提示临床可通过TRAb检测代替无法直接简便测得的TSAb、TSBAb用以区分AIT早期甲亢与非炎症性甲亢,为临床提供全面诊断信息。部分专家表示,TPOAb相较于TGAb应用于AIT诊断时更具灵敏性与特异性,尤其在AIT患者甲亢阶段及经过系统性治疗后,其水平均可表现出显著变化趋势。本研究发现,AIT患者血浆TGAb、TPAOAb均较非炎症性甲亢患者显著更高,当其水平分别高于228.13 U/ml、503.63 U/ml时可高风险提示为AIT,这与既往研究所得出的200 U/ml、500 U/ml临界值较为接近,且联合检测Th1/Th2与TRAb能进一步明显提高诊断效能,使灵敏度、特异度达到97.87%、90.62%,提示多个指标联合诊断能有效避免其他机制对免疫系统产生的相似影响,从而有助于减少误诊与漏诊。
有关免疫生理学研究指出,AIT相关抗体蛋白均由IgG构成,其中TGAb主要包含IgG4,而TPOAb同时含有较多IgG1与IgG4,TRAb分作TSAb、TSBAb两种亚型,均不含有IgG4。本研究还发现,阳性组血浆TGAb、TPOAb水平显著较阴性组更高,且与IgG4水平表现出明显正相关性,这不仅证实上述论点,还提示临床能通过早期监测AIT患者TSAb、TSBAb变化情况,尽早预警并慎重对待疾病迁延可能性,为改善患者预后创造有利条件。Luiz等[14]认为,IgG4相关性桥本甲状腺炎纤维化变不同于普通桥本甲状腺炎,是滤泡间纤维化,而并非小叶间纤维化,且由于IgG4淋巴浆细胞浸润,其病灶滤泡细胞退化更为严重,累及范围扩大更快,甚至导致多个器官受累,在超声影像中可辨别出的弥漫性蜂窝状或网格状低回声,需引起高度重视。
综上所述,AIT患者相较于非炎症性甲亢患者在Th1/Th2及血浆TGAb、TPOAb、TRAb水平方面存在明显的异常表现,临床可借此实施较为准确的鉴别诊断,且TGAb、TPOAb与IgG4表达情况关系尤其密切,有助于早期指导临床预测、评估其病情进展,以便提供适宜的干预措施改善患者预后。

