利用CRISPR/Cas9 技术构建斑马鱼tspo 基因纯合突变体
王一川,岳芸芸,尚靖
(中国药科大学,江苏 南京)
0 引言
TSPO是位于线粒体外膜上的五次跨膜蛋白,在多种组织中具有广泛表达,如外周的肺部、肾脏、骨髓、皮肤和中枢脑胶质细胞等。许多研究指出TSPO的表达与多种疾病如抑郁症[1]、脑损伤[2]、阿尔兹海默症[3,4]、脑部肿瘤[5]等具有极高的相关性。目前,对于TSPO蛋白功能的研究主要分为两类:一类是基于TSPO蛋白在肾上腺等神经类固醇合成相关的组织中表达量丰富这一特征,推测TSPO可能参与类固醇激素合成的调节。胆固醇由线粒体外侧向内侧转运的过程一直被认为是类固醇激素合成的关键限速步骤。2005年有研究指出TSPO蛋白位于线粒体膜外段具有胆固醇识别序列CRAC[6],胆固醇可能通过结合CRAC后被TSPO转运至线粒体内部。同时有许多研究指出TSPO高选择性配体如PK11195、Ro54864能够诱导肾上腺皮质细胞及睾丸间质细胞中类固醇激素的合成[7,8]。另一类则是基于TSPO蛋白在正常生理状态下中枢表达量较低,而在脑部炎症状态下小胶质细胞和星形胶质细胞中的表达量迅速上升这一特征,将 TSPO配体应用在正电子发射断层扫描(positron emission tomography,PET)中,用以诊断脑内炎症发生[5,9]。除此之外,还有研究表明TSPO也参与了氧化应激[10],线粒体稳态和能量代谢调节[11],其作用包括调节Ca2+转运,调节线粒体呼吸链中相关基因的转录进而调节ATP的产生[12,13]等。
随着基因敲除技术的出现,为基因功能的研究提供了直接证据。如,野生型小鼠在主动脉弓缩窄(transverse aortic constriction,TAC)术诱导心衰后,心脏中TSPO表达量伴随着心脏衰竭程度加重而上升,而在心脏组织特异性敲除Tspo可有效减轻术后小鼠心衰程度,提示TSPO在心脏病理进程中发挥重要作用[14]。最早的Tspo敲除小鼠模型显示,缺乏Tspo会导致小鼠胚胎期致死[15],这也曾被视作TSPO参与类固醇激素合成调节的重要证据之一。而2014年有研究者通过Cre/LoxP系统在C57/BL6小鼠上进行Tspo敲除[16],却发现敲除小鼠具有正常的生长发育和寿命,并且在类固醇激素合成等关键指标中与野生型小鼠相比并无显著性差异。而斑马鱼作为研究早期胚胎发育的优势模型之一,2009年有研究通过原位杂交实验指出在斑马鱼幼鱼发育过程早期,tspo主要表达在内细胞团(intermediate cell mass,ICM)中表达,可能参与原始红细胞的分化[17],但其在斑马鱼生物体发育过程中的具体功能未作描述。
人类疾病的动物模型一直是药物发现和机制探索的重要基石,在疾病动物模型中我们才可以更准确地将基因功能与发病机制联系在一起。斑马鱼模型在研究基因功能和病理机制过程中具有极为突出的优势,与大小鼠单次交配产仔数8~13只相比,性成熟斑马鱼平均7~10天可交配产卵一次,单次可收获受精卵70~200枚,可以通过多种基因工程技术和药物处理构建可视化疾病模型进行大规模药物开发研究,例如针对神经系统疾病、心血管疾病、代谢疾病或肿瘤等基于表型的药物筛选等[18]。目前,利用CRISPR/Cas9 (Clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9,CRISPR/Cas9)系统能够在斑马鱼体内实现基因的高效定点敲除以及敲入修饰,这为建立人类疾病的斑马鱼模型、探究基因功能或在斑马鱼中进行药物筛选提供技术支持。因此,本研究利用CRISPR/Cas9技术建立可稳定遗传的tspo敲除的斑马鱼品系,并观察tspo敲除后斑马鱼早期发育情况,为研究tspo基因在斑马鱼早期发育中的功能以及相关疾病的靶点确证提供基础。
1 材料与方法
1.1 主要仪器与试剂
pGEM T easy(A1360)购自美国Promega公司;体外转录试剂盒MAXI script T7 transcription kit(AM1314)购自Ambion公司;PCR clean up kit(AP-PCR-250)购自 Axygen公司;pYSY-scaffold质粒模板购自南京尧顺禹生物科技公司;GenCrispr NLSCas9-NLS Nuclease(Z03389-50)购自南京金斯瑞生物科技有限公司;Phanta Max Super-Fidelity DNA Polymerase(P505-d1)、Fast pure plasmid mini kit(DC201-01)、DH5α competent cell(C502-03)、2x Taq master Mix(Dye Plus)(P112-02)和 One Step Mouse Genotyping Kit(PD101-01)购自南京诺唯赞生物科技有限公司;斑马鱼培养系统购自上海海圣公司;斑马鱼显微注射系统购自世界精密仪器商贸有限公司;野生型AB系成年斑马鱼,6-7月龄,雌雄各半,由武汉国家斑马鱼资源中心提供种鱼,南京睿鹰润泽生物医药科技有限公司斑马鱼实验室自行繁育。
1.2 sgRNA 靶点序列设计与合成
利用在线软件CCTop(https://crispr.cos.uni-heidelberg.de/)进行靶位点的预测,斑马鱼基因组tspo共有2个转录本,在两个转录本共有序列的第二、三个外显子上设计20bp的sgRNA位点(图1),选取得分高且脱靶少的位点,并在NCBI网站上(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对sgRNA位点在斑马鱼基因组中BLAST。将靶点序列设计在正向引物中,sgRNA靶序列以N表示,正向引物通式为5‘-TAATACGACTCACTATAGNNNNNNNNNNNNNNNNNNNNGTTTTAGAGCTAGAAATAGC-3’,反向引物序列为:5’-AAAAAAAGCACCGACTCGGTGCCAC-3’,具体靶位点序列已列出(表1),从南京金斯瑞生物科技有限公司订购以上引物。

图1 tspo 基因敲除斑马鱼sgRNA 位点设计及敲除流程
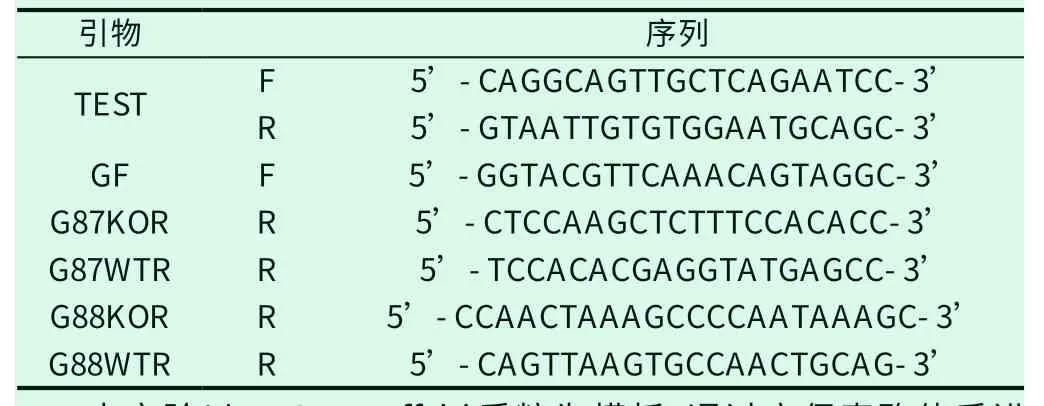
表1 测序及基因型鉴定引物序列
本实验以pYSY-scaffold质粒为模板,通过高保真酶体系进行PCR扩增,扩增体系为:12.5uL Phanta Max Buffer,9.5uL DEPC水,1.0uL(1ng/uL)pYSY-scaffold质粒,1.0 uL上游引物,1.0 uL下游引物。PCR仪程序:95℃ 预变性 30s;95℃ 变性 15s,58℃ 退火 15s,72℃ 延伸 5s,共 35个循环;72℃ 完全延伸 3min,16℃ 终止。将产物用PCR clean up kit(Axygen)纯化回收,去除PCR未反应完的其他原料以及RNase酶污染,利用正向引物上所添加的T7启动子,按照T7体外转录试剂盒说明书进行体外转录,并将转录产物利用乙醇沉淀法回收。sgRNA 经电泳检测及浓度测定后,分装并贮存至-80 ℃冰箱。
1.3 显微注射及敲除活性验证
斑马鱼饲养按照The Zebrafish Book中的方法进行。循环水温28.5°C,光照/黑暗按照14/10h间隔,每天上下午各喂食丰年虾一次。收集胚胎前一晚将雌雄斑马鱼按照1:1比例放置入繁殖缸,并以隔板隔开过夜。第二天光照开启后抽去隔板,15分钟后收集一细胞时期胚胎,用egg water(斑马鱼胚胎培养溶液)清洗后准备注射。将体外转录的sgRNA与GenCrispr NLS-Cas9-NLS Nuclease(Z03389-50)共同注射到胚胎,注射体系:体外转录sgRNA 20ng/uL/个,Cas9核酸酶40ng/uL,DEPC水补足至5uL,注射后得到G0斑马鱼,将胚胎置于光照培养箱培养。
注射后24h,收集5个胚胎并加入10uL One Step Mouse Genotyping Kit裂解液提取基因组,裂解反应:55°C 30min,95°C 5min,将裂解产物低温离心后,上清用作后续PCR反应。在sgRNA靶序列上下游200bp左右位置设计测序引物,测序引物TSET序列见表2,以提取后的上清为模板进行PCR扩增,扩增体系为:1uL 模板,0.5uL上游引物,0.5uL下游引物,8uL DEPC水,10uL 2x Taq master Mix(Dye Plus),所用 PCR仪程序:95°C 预变性3min;95°C 变性 30s,58°C 退火 30s,72°C延伸 20s,共 35个循环;72°C 彻底延伸3min;16°C终止。将扩增后PCR产物利用PCR clean up kit纯化,取纯化产物按照说明书操作与pGEM T easy载体连接后转化到DH5α 感受态细胞中,过夜后随机选取25个单克隆加入到10uL LB培养基中,取1uL作模板,以测序引物TEST进行PCR扩增,扩增体系和反应程序同上,DNA电泳验证产物大小,将条带大小相近的PCR产物等比混样测序,条带大小不同的PCR产物单独测序,将测序结果的序列与野生型序列进行对比,若在sgRNA序列附近出现套峰则说明敲除成功,并判断突变位置和位点活性,将确认位点活性有效的同批次G0注射胚胎正常饲育。
1.4 F1 斑马鱼tspo 敲除品系的筛选
待G0斑马鱼性成熟,雌雄互相交配得到F1斑马鱼,将F1斑马鱼培养至3月龄时对87尾F1斑马鱼剪尾提取基因组,通过测序引物TEST进行扩增后将扩增产物直接送测序公司测序,将测序结果与野生型序列进行对比,判断突变类型并保留至少两种成功敲除品系。
1.5 F2 纯合突变斑马鱼的基因型鉴定
将保留的两种突变类型-16bp和-4+16bp的F1杂合斑马鱼(tspo-16/+和tspo-4+16/+,分别命名为tspocpu87和tspocpu88)分别内交,分别得到F2斑马鱼30尾和68尾,待3月龄时对F2斑马鱼剪尾鳍提取基因组,利用PCR鉴定基因型的方法设计三条引物,其中一条为共用引物,另外两条为差异引物,这两条差异引物的3’端设计在发生突变的区域,野生型引物只能扩增出野生型条带,突变型引物只能扩增出突变型条带,据此区分野生型、杂合子和纯合子基因型,具体序列见表2。以剪尾提取基因组为模板进行PCR鉴定。PCR 仪程序设置 : 95℃ 预变性 3 min;95℃ 变性 30s,60℃退火 30 s,72℃ 延伸 15s,35 个循环;72℃ 彻底延伸 3 min,16℃终止,将扩增产物进行DNA电泳,只有单一条带的为野生型或纯合子,具有双条带的为杂合子,基因型鉴定出的纯合子通过测序引物TEST扩增后送测序以验证PCR鉴定结果无误,筛选得纯合突变F2斑马鱼后扩群。
1.6 斑马鱼胚胎心率的观察
待基因型鉴定筛选所得纯合突变斑马鱼饲养至性成熟,选取同龄野生型斑马鱼在同一天雌雄交配,在抽去隔板15分钟内收集同一批胚胎,按照正常方式将胚胎置于光照培养箱培养,斑马鱼胚胎心脏搏动在24hpf左右开始出现,至72hpf时心率趋于稳定[19],在48hpf和72hpf时在显微镜下记录15s内斑马鱼的心率,实验重复3次。
2 结果
2.1 斑马鱼tspo 敲除G0 显微注射敲除检测
对于斑马鱼tspo基因具有的两个转录本,此次位点设计在其共有的第二、三个外显子上,共设计4组sgRNA位点,敲除流程及sgRNA位点示意如图1,通过体外转录获得sgRNA片段后与Cas9核酸酶混匀后进行显微注射得到G0斑马鱼。选取注射后24h的胚胎提取基因组,根据上述方法,通过TA克隆并混样测序的方式进行鉴定。通过对比测序结果可知,sgRNA位点均检测到突变(图2),在随机选取的25个克隆中检测到单一位点活性的克隆6个,双位点同时突变引起大片段删除的2个(表2),四个sgRNA共注射突变效率估计为32%,后续将此四个sgRNA进行大量注射,获得G0代斑马鱼。
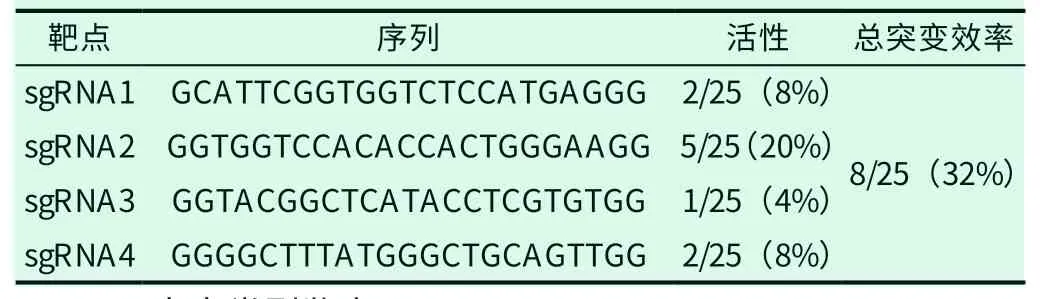
表2 sgRNA 序列及在G0 中的敲除效率
2.2 F1 突变类型鉴定
将成年G0斑马鱼雌雄互相交配,得到F1斑马鱼后饲养至3月龄剪尾提取基因组送测序。共鉴定87条F1斑马鱼,得到四种类型突变斑马鱼共18条,得到-16bp、-4+16bp、-5+3bp、-1bp四种突变体18条,突变比例20.69%,具体突变数量及位点见表3。
保留两种突变类型-16 bp和-4+16 bp,两种突变类型均会引起斑马鱼Tspo蛋白表达提前终止,斑马鱼野生型Tspo蛋白序列长度为162个氨基酸,-16 bp和-4+16 bp两种突变类型的Tspo氨基酸序列分别为100个氨基酸和88个氨基酸,黄色标注所示序列为突变位点处对应的野生型序列,红色标注所示序列为插入或缺失碱基以及突变后Tspo蛋白表达提前终止后的产物因此以其突变体进行建系,自交获得F2斑马鱼。
2.3 F2 纯合突变体筛选
对于获得的两种突变体自交得到的F2斑马鱼,待其生长至3月零时剪尾鳍提取基因组,在插入或缺失碱基的位置设计基因型鉴定引物用于F2代基因型鉴定筛选纯合突变斑马鱼(序列见表2),利用引物PCR扩增后,将同一基因组模板的产物同时进行电泳分析,若两对鉴定引物都能扩增出产物,则此基因组对应的F2斑马鱼为杂合突变,若只有野生型引物具有扩增产物而突变型引物无产物,则对应的为野生型斑马鱼,若只有突变型引物扩增产物,则认为对应的是纯合突变斑马鱼(如图4)。所鉴定F2突变比例如下(如表4),通过基因型鉴定,由-16bp突变F1斑马鱼自交所得F2斑马鱼共鉴定30尾,得到纯合突变6尾,杂合突变19尾,野生型5尾;由-4+16bp突变F1斑马鱼自交所得F2斑马鱼共鉴定68尾,纯合突变13尾,杂合突变32尾,野生型23尾,通过PCR鉴定得到的纯合突变斑马鱼另外送测序验证基因型,以避免假阳性出现。
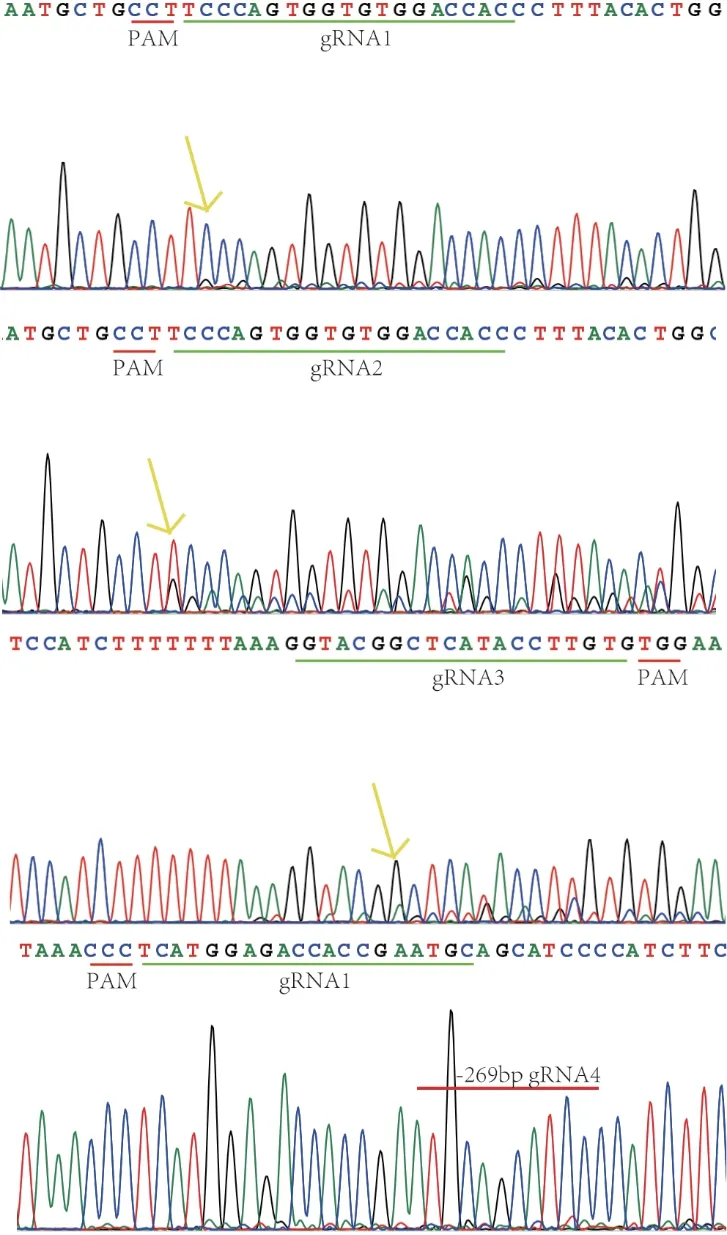
图2 sgRNA 敲除活性测序结果
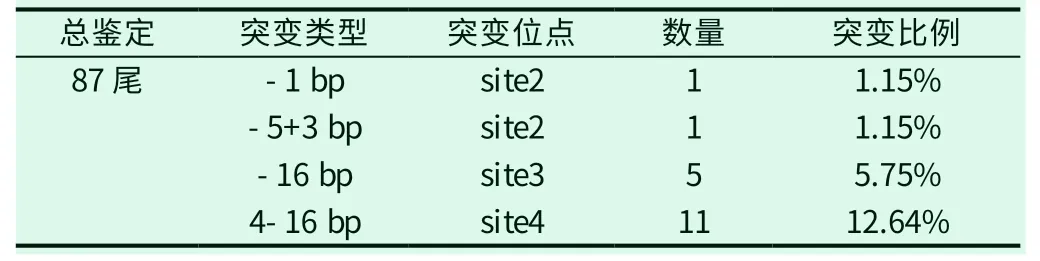
表3 F1 鉴定突变结果

图3 tspocpu87 和tspocpu88 斑马鱼DNA 序列及蛋白表达示意图
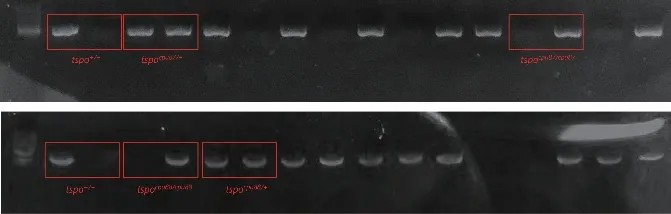
图4 F2 斑马鱼基因型鉴定结果
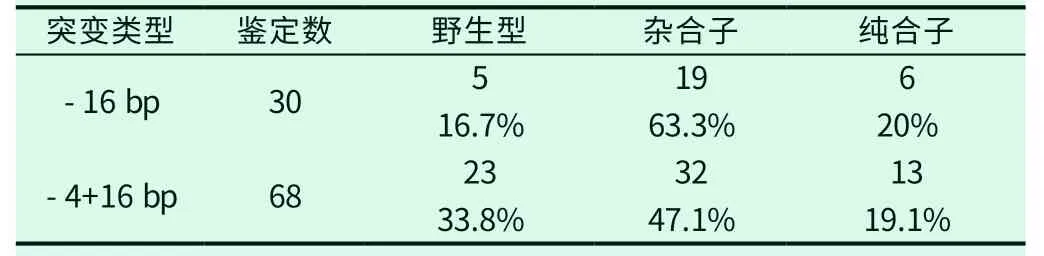
表4 F2 基因型鉴定情况
2.4 斑马鱼整体tspo 基因敲除对幼年斑马鱼心率的影响
将筛选得到的tspocpu87和tspocpu88纯合突变斑马鱼饲养至性成熟,现观察tspocpu87斑马鱼所产胚胎在早期发育过程心率的变化。收集野生型和tspocpu87斑马鱼生产的胚胎后,每隔24h在显微镜下观察心率。结果如图5显示,在48hpf时野生型斑马鱼和tspo-16/-16斑马鱼心率分别为110.67±6.93次/分和112.00±6.74次/分,在72hpf时野生型斑马鱼和tspo-16/-16斑马鱼心率分别为164.89±8.43次/分和162.22±9.80次/分,未发现tspo 基因敲除后对斑马鱼早期发育过程中心率产生显著影响。

图5 tspo 基因敲除后斑马鱼于48、72hpf 时心率变化
2.5 讨论
TSPO在生物体各器官和组织中广泛表达,作为线粒体五次跨膜蛋白,其在类固醇激素合成,PET成像诊断和线粒体相关功能的研究得到了极大地拓展[20]。TSPO基因在斑马鱼体内的生理功能研究较少,目前研究指出TSPO可能参与斑马鱼早期发育时原始红细胞的发生[17],TSPO配体FGIN-1-27能够减少在明暗偏好性实验中斑马鱼表现出的抑郁样行为[21],TSPO配体PK11195能够增加斑马鱼幼鱼对于葡萄糖的耐受,减少肝脏脂肪变性,调节能量代谢[22]。
但TSPO在早期发育过程中的功能上存在分歧。利用CRISPR/Cas9技术在斑马鱼tspo 基因的第二、三个外显子位置设计四个sgRNA进行敲除,所设计的四个sgRNA在注射24h后通过TA克隆后混样测序的方式推算总的敲除活性为32%,通过测序的方式避免了T7E1酶切检测中由于T7酶错误的识别了DNA片段中十字交叉,holiday结构而导致的假阳性结果。在F1斑马鱼基因型筛选过程中,通过直接测序以及与野生型序列对比,我们获得了四种不同的突变类型,并且突变位置在不同的sgRNA位点,突变类型分别为-16bp、-4+16bp、-5+3bp、-1bp,突变比例为20.69%,确定保留突变类型为-16bp,-4+16bp两种。在雌雄交配得到的F2斑马鱼中进行基因型鉴定时,我们使基因特异性引物的3端设计在碱基缺失或插入的位置,因此纯合子或野生型斑马鱼都只能扩增出单一条带,分别鉴定出-16bp和-4+16bp两种纯合突变6尾和13尾。通过观察突变体胚胎早期发育,我们发现tspo缺失不会导致胚胎死亡,并且对斑马鱼胚胎发育过程仲心率没有显著影响。本研究成功构建两种斑马鱼tspo 敲除突变体tspocpu87和tspocpu88,为进一步研究TSPO的生理功能以及靶点确证提供基础。

