探讨不同内膜准备方案冻融胚胎复苏移植的临床结局
马淑芳,弓爱东
(武汉康健妇婴医院生殖中心,湖北 武汉)
0 引言
冻融胚胎复苏移植 (frozen-thawed embryo transfer, FET)是人类辅助生殖技术中的重要部分,用于体外受精(in vitro fertilization,IVF)/卵胞浆内单精子显微注射(Intracytoplasmic Sperm Injection,ICSI)新鲜周期移植未成功妊娠有剩余胚胎或各种因素不能新鲜胚胎移植而行全胚冷冻的患者。子宫内膜容受性影响FET 周期的妊娠成功率重要因素。子宫内膜准备方法对提高患者冻融胚胎解冻移植妊娠率至关重要,因此内膜准备方案一直是生殖临床医生关注的热点。
1 本资料和方法
1.1 研究对象
回本文回顾性分析本中心2018年1月至2019年6月冻融胚胎复苏移植的1252个FET周期的临床资料。
1.2 研究方法
1.2.1 入选标准
年龄≤35岁,移植日内膜≥8mm,移植胚胎来源为卵泡期长方案根据子宫内膜不同准备方案将患者分为4组,NC子宫内膜准备151个移植周期为1组,HRT激素替代人工周期子宫内膜准备1014个移植周期为2组,促排卵方案准备子宫内膜9个移植周期为3组,长效促性腺激素释放激素激动剂GnRHa-HRT准备子宫内膜方案78个移植周期为4组。
1.2.2 准备子宫内膜的四种不同方案及分组
(1)NC组:根据患者平素月经周期选择月经周期第8-10d阴道超声了解子宫内膜厚度并监测卵泡发育,确定排卵日或卵泡16-18mm给予注射人绒毛膜促性腺激素HCG6000IU确定排卵日,黄体支持3-5d后行卵裂胚胎/囊胚复苏移植。(2)HRT组:月经第3-5d阴道超声检查及孕酮检测,尿妊娠试验阴性,内膜<6mm,孕酮<1ng/mL后开始口服戊酸雌二醇(补佳乐,拜耳,德国),2mg,4mg,6mg3天递增,9天后监测子宫内膜厚度及血清雌二醇水平,适时调整药物剂量,当子宫内膜厚度≥8mm,并E2水平≥150pg/mL,给予黄体支持,黄体酮40mg,qd,im,联合黄体酮胶囊(益玛欣,仙琚制药)100mg,bid,po,转化3-5d后行卵裂胚胎/囊胚复苏移植。(3)OI组:月经周期第3-5d给予来曲唑(芙瑞,江苏恒瑞医药)2.5mg,qd,po,定期监测至卵泡发育成熟,肌肉注射HCG6000IU, 排卵后方案同NC周期。(4)GnRH-a-HRT组:月经第2天排除妊娠后给予长效达必佳(3.75 mg/支)3.75mg肌肉注射,肌注后 28 d 复查B超及性激素, 内膜厚度<6mm,孕酮<1ng/mL后方案同HRT。
1.2.3 观察指标
根据不同组别不同移植胚胎数目及类型,来分析组间临床妊娠率、着床率、早期流产率、异位妊娠率、多胎妊娠率。
1.2.4 各个指标标准
胚胎移植后移植后 28d 经阴道B 超示:宫内可见孕囊回声,胚芽及心管搏动者为临床妊娠,子宫腔以外可见非均质性包块者为异位妊娠。 着床率=孕囊数/总移植胚胎数×100%(单胚胎移植孕囊数仅计为1)。早期流产率=孕12周内自然流产周期数/临床妊娠周期数×100%。异位妊娠率=异位妊娠周期数/临床妊娠周期数×100%。多胎妊娠率=多胎妊娠周期数/临床妊娠周期数×100%。
1.2.5 统计学方法
1、2、3、4组作为实验组采用 χ2检验,P<0.05 为差异有统计学意义。 当理论数T<1,改用Fisher 确切法。
2 结果
2.1 4组间年龄、BMI、内膜厚度变量均不服从正态分布,四组间选K个独立样本的非参数检验,P>0.05,差异无统计学意义。
2.2 不同组别中移植1枚卵裂胚胎的临床结局,临床妊娠率、着床率(移植1枚胚胎妊娠率和着床率相同)、早期流产率、异位妊娠率四组间差异无统计学差异。(见表1)。

表1 移植1 枚卵裂胚妊娠结局不同内膜准备方案
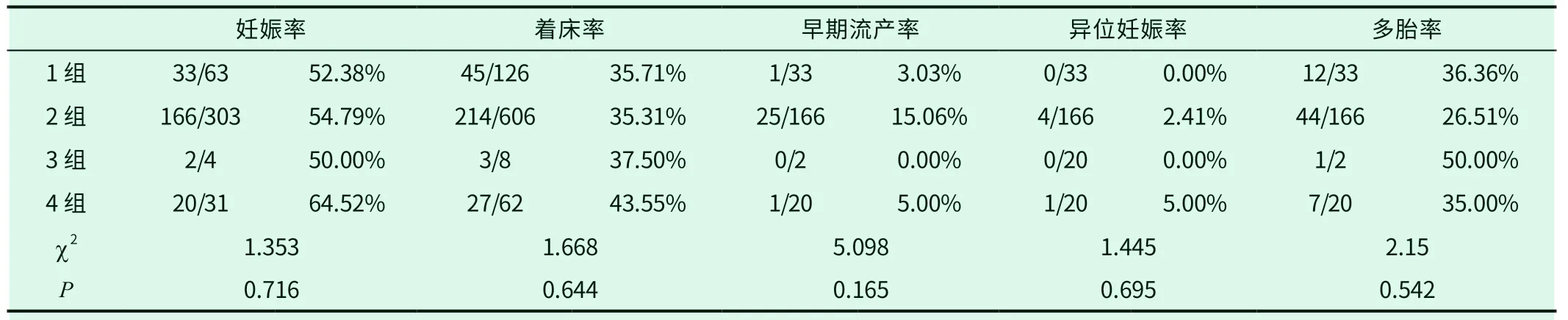
表2 移植2 枚卵裂胚妊娠结局不同内膜准备方案
2.3 不同组别中移植2枚卵裂胚胎的临床结局,临床妊娠率、着床率、早期流产率、异位妊娠率(见表1)四组间,4组妊娠率和着床率高于其余3组。早期流产率、异位妊娠率1组最低。多胎率2组最低。但差异均无统计学意义。(见表2)。
2.4 不同组别中移植1枚囊胚的临床结局,临床妊娠率、着床率(移植1枚胚胎妊娠率和着床率相同)、早期流产率、异位妊娠率(见表1)四组间,4组妊娠率和着床率高于其余3组,且差异存在明显统计学意义。早期流产率、异位妊娠率1组优势。但差异均无统计学意义。(见表3)。

表3 移植1 枚囊胚妊娠结局不同内膜准备方案
2.5 不同组别中移植2枚囊胚的临床结局,临床妊娠率、着床率、早期流产率、异位妊娠率(见表1)四组间,4组妊娠率和着床率高于其余3组,且差异存在明显统计学意义。早期流产率、异位妊娠率1组优势。多胎率四组间排除3组仅1人外,4组多胎率最高。但差异均无统计学意义。(见表4)。
3 讨论
冻胚解冻复制移植成功的关键是优质的胚胎和同步化的子宫内膜相互配合, 但着床率始终徘徊在 20%-30%[1]。其中,如何提高子宫内膜容受性是最近生殖医生一直以来关注的热点。着床失败中 2/3 是由于宫内膜容受性不良导致的[2]。所以如何在冻胚中准备内膜的方案显得尤其关键。本次回顾性分析武汉康健妇婴医院四种冻胚内膜准备方案不同的临床结局。为我们的临床工作提供数据支持。
子宫内膜容受性是指子宫内膜处于允许胚胎定位、粘附、侵入并使内膜间质发生改变从而导致胚胎着床的状态,即“种植窗”,非常短暂,由卵巢甾体激素启动, 多种细胞因子参与,如:胞饮突、整合素、白血病抑制因子、雌孕激素及其受体等。Groenewoud[3]研究结果:冻融胚胎移植的GnRHa 降调节激素替代方案内膜准备方式比自然周期的临床妊娠率和活产率更高,差异有显著性。这与国内学者的回顾性分析[4-9]一致:降调节HRT子宫内膜准备方案能改善反复着床失败的患者的子宫内膜容受性,提高冻胚激动复苏周期临床妊娠率、着床率和持续妊娠率一致。Azimi等研究[10]认为GnRH-a预处理后血清雌激素水平的降低可能会改变后期子宫内膜上种植窗的形成,亦有利于胚胎早期种植。本研究发现:降调节周期冻胚妊娠率和着床率高于其余三组,且单囊胚移植的明显差异有统计学意义。这可能与长效 GnRH-a 能更好的降低内源性LH,提高种植窗期子宫内膜表面的白血病抑制因子,降低腹腔中白细胞介素-1, 肿瘤坏死因子等胚胎毒性因子的浓度,显著改善改善胚胎种植环境,提高临床妊娠率、着床率。本研究中降调节周期冻胚流产率并无优势。但差异均无统计学意义。本研究结果表明,虽然降调节周期冻胚的妊娠率、着床率高于其余三组,但单囊胚的差异有统计学意义外,其余移植卵裂胚和移植2枚囊胚间并无统计学意义。所以认为降调节周期冻胚一定是最优方案并未成立。临床工作中需要结合患者既往内膜准备方案、患者的临床特点、患者依从性和 便利性、性价比等因素来综合考虑。是否真的能够完全提高临床率和着床率需要大量的前瞻性研究。更多的样本量来进一步验证。

表4 移植2 枚囊胚妊娠结局不同内膜准备方案

