阿帕替尼联合放疗治疗非小细胞肺癌的临床效果
李花妮 陈玉茹 王晴 和劲光


【摘要】 目的 評估非小细胞肺癌(NSCLC)行阿帕替尼联合放疗治疗的临床疗效。方法 60例非小细胞肺癌患者, 随机分为对照组及观察组, 各30例。对照组给予常规放疗, 观察组给予阿帕替尼联合放疗。比较两组患者治疗前后的肿瘤标志物水平, 临床疗效, 不良反应发生情况, 治疗后6 个月、1 年生存情况。结果 治疗后, 两组患者的癌胚抗原(CEA)、细胞角蛋白19血清片段211(CYFRA211)水平均较本组治疗前降低, 且观察组降低程度优于对照组, 差异均具有统计学意义 (P<0.05)。观察组患者的总有效率为83.3%, 高于对照组的56.7%, 差异有统计学意义(P<0.05)。两组患者的蛋白尿、转氨酶升高、骨髓抑制、凝血异常发生率对比, 差异均无统计学意义(P>0.05);观察组患者的手足综合征、高血压发生率分别为26.7%、26.7%, 均高于对照组的6.7%、3.3%, 差异均具有统计学意义 (P<0.05)。观察组患者治疗后6个月、1年的生存率分别为80.0%、60.0%, 均高于对照组的53.3%、33.3%, 差异均具有统计学意义 (P<0.05)。结论 阿帕替尼联合放疗治疗非小细胞肺癌, 对患者肿瘤标志物水平改善作用显著, 疗效可靠, 且不增加不良反应, 患者可耐受, 值得临床借鉴。
【关键词】 阿帕替尼;放疗;非小细胞肺癌;肿瘤标志物;不良反应
DOI:10.14163/j.cnki.11-5547/r.2020.08.005
【Abstract】 Objective To evaluate the clinical efficacy of apatinib combined with radiotherapy in the treatment of non-small cell lung cancer (NSCLC). Methods A total of 60 patients with non-small cell lung cancer were randomly divided into control group and observation group, with 30 cases in each group. The control group received radiotherapy, and the observation group received apatinib combined with radiotherapy. The level of tumor markers before and after treatment, clinical efficacy, occurrence of adverse reactions, and survival at 6 months and 1 year after treatment were compared between the two groups. Results After treatment, the levels of carcinoembryonic antigen (CEA), cytokeratin 19 serum fragment 211 (CYFRA211) in the two groups were lower than those before treatment, and the decrease degree of the observation group was better than that of the control group. Their difference was statistically significant (P<0.05). The total effective rate of the observation group was 83.3%, which was higher than 56.7% of the control group, and the difference was statistically significant (P<0.05). There was no statistically significant difference in incidence of proteinuria, transaminase elevation, myelosuppression and coagulation abnormality between the two groups (P>0.05). The hand-foot syndrome and high blood pressure were 26.7% and 26.7% respectively in the observation group, which were all higher than 6.7% and 3.3% in the control group, and their difference was statistically significant (P<0.05). The survival rate at 6 months and 1 year after treatment were 80.0% and 60.0% respectively in the observation group, which was higher than 53.3% and 33.3% in the control group, and their difference was statistically significant (P<0.05). Conclusion Combination of apatinib and radiotherapy shows reliable efficacy for patients with non-small cell lung cancer, and it can significantly improve the level of tumor markers without increasing adverse reactions. Patients are tolerable, and it is worth clinical reference.
【Key words】 Apatinib; Radiotherapy; Non-small cell lung cancer; Tumor markers; Adverse reactions
肺癌是我国发病率最高的恶性肿瘤, 致死人数占所有肿瘤的1/4, 发病风险随着年龄增长显著增加[1]。作为肺癌的常见类型, 非小细胞肺癌在所有肺癌中占80%以上, 患者5年生存率仅为20%左右[2]。大部分非小细胞肺癌患者早期无明显症状表现, 确诊时已发展至中晚期。临床针对中晚期非小细胞肺癌多采用化疗、放射治疗的方式, 尽管可在一定程度上缓解病情, 但效果不佳。此次研究引入阿帕替尼联合放疗治疗方式, 为探究其有效性, 收集非小细胞肺癌病例60例, 均为2017年9月~2018年10月本院收治的患者, 现报告如下。
1 资料与方法
1. 1 一般资料 纳入2017年9月~2018年10月本院收治的60例非小细胞肺癌患者, 所有患者均有病理学 (纤维支气管镜、肺穿刺活检) 确诊。随机分为观察组与对照组, 各30例。观察组男女比例17∶13, 平均年龄(64.14±4.26)岁;病理类型:12例腺癌、10例鳞癌、8例腺鳞癌;对照组男女比例16∶14, 平均年龄(63.91±4.55)岁;病理类型:13例腺癌、10例鳞癌、7例腺鳞癌。两组患者的性别、年龄、病理类型等一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。
1. 2 纳入及排除标准
1. 2. 1 纳入标准 ①所有患者经诊断及病理学检查均确诊为非小细胞肺癌[3];②临床分期为Ⅲ期未手术;③患者临床资料及病史、检查记录等资料完善, 检查前均告知患者, 患者已了解且同意加入研究, 签订知情同意书, 符合医学伦理学要求。
1. 2. 2 排除标准 ①经诊断合并心肝肾疾病或严重器质性病变患者;②神志不清或精神障碍患者;③对研究药物过敏或过敏体质患者;④合并其他类型恶性肿瘤疾病患者;⑤近期接受过影响观察指标的相关治疗;⑥妊娠期及哺乳期妇女[4, 5]。
1. 3 方法
1. 3. 1 对照组 给予放疗治疗。指导患者保持仰卧位, 双臂抱头, 对真空体模妥善固定, 并在体表定位做好标记, 患者、床以及体模均应固定牢靠。采用瓦里安直线加速器实施体外放射治疗, 先行CT扫描, 将层厚设置为2 mm, 放射剂量以200 cGy/次为宜, 1次/d, 5次/周, 总剂量为60~66 Gy/30~33 f。给予为期2个月治疗。
1. 3. 2 观察组 在对照组基础上加用阿帕替尼[江苏恒瑞医药股份有限公司, 国药准字H20140103, 规格:0.25 g(以阿帕替尼计)]治疗, 500 mg/次, 1次/d。给予为期2个月治疗。
1. 4 观察指标及判定标准 比较两组患者治疗前后的肿瘤标志物(CEA、CYFRA211)水平, 临床疗效, 不良反应发生情况, 治疗后6 个月、1 年生存情况。疗效判定标准:完全缓解:经过治疗患者肿瘤病灶完全消失, 体征恢复正常;部分缓解:治疗后肿瘤病灶缩小>75%, 临床症状明显改善, 体征基本正常;疾病稳定:治疗后肿瘤病灶缩小>50%, 症状轻微缓解;疾病进展:治疗后肿瘤病灶未缩小甚至增加或出现新病灶, 症状加重。总有效率=完全缓解率+部分缓解率[6]。不良反应参照美国国家癌症研究所-常见毒性反应标准(NCI-CTC), 观察两组患者治療期间高血压、蛋白尿、手足综合征、骨髓抑制、转氨酶升高、凝血异常等不良反应的发生情况。
1. 5 统计学方法 采用SPSS20.0统计学软件进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 两组患者治疗前后肿瘤标志物水平对比 治疗前, 两组患者的CEA、CYFRA211水平对比, 差异均无统计学意义(P>0.05);治疗后, 两组患者的CEA、CYFRA211水平均较本组治疗前降低, 且观察组降低程度优于对照组, 差异均具有统计学意义 (P<0.05)。见表1。
2. 2 两组患者临床疗效对比 观察组患者的总有效率为83.3%, 高于对照组的56.7%, 差异有统计学意义(P<0.05)。见表2。
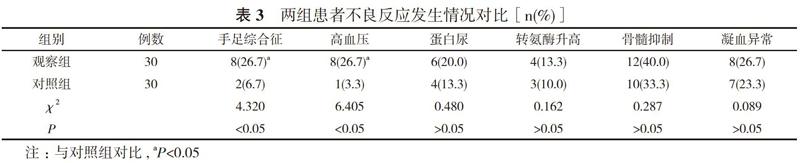
2. 3 两组患者不良反应发生情况对比 两组患者的蛋白尿、转氨酶升高、骨髓抑制、凝血异常发生率对比, 差异均无统计学意义(P>0.05);观察组患者的手足综合征、高血压发生率分别为26.7%、26.7%, 均高于对照组的6.7%、3.3%, 差异均具有统计学意义 (P<0.05)。见表3。
2. 4 两组患者生存情况对比 观察组患者治疗后6个月、1年的生存率分别为80.0%、60.0%, 均高于对照组的53.3%、33.3%, 差异均具有统计学意义 (P<0.05)。见表4。
3 讨论
国家癌症中心统计, 我国肺癌发病例数和死亡例数已连续10年位居恶性肿瘤之首, 每年新发肺癌约78.7万人, 因肺癌死亡约63.1万人[7]。随着人们生活习惯及饮食结构的变化、空气污染的加重, 肺癌发病率逐年攀升, 如何有效治疗肺癌、提升患者生存质量成为临床研究的重点话题。
临床针对早期非小细胞肺癌患者多采用手术治疗, 各临床分期中放疗是重要的局部治疗手段。由于放疗抵抗, 放疗剂量的增加虽然提高了肿瘤控制率, 但也增加了周围正常组织器官的急慢性不良反应。乏氧在实体瘤中常见, 肿瘤内部乏氧, 诱导放疗抵抗, 造成恶性循环, 成为放疗失败的原因[8]。因此如何进一步提升放疗疗效, 同时减少正常组织损伤, 是目前研究的热点。此次研究在放疗基础上引入了阿帕替尼治疗方案, 其是一种血管内皮生长因子受体- 2(VEGFR-2)抑制剂, 通过阻止血管内皮生长因子 VEGF/VEGFR 信号传导而抑制肿瘤血管生成, 较低浓度便能够对VEGFR-2酪氨酸激酶活性产生抑制, 阻断肿瘤生长, 与此同时对肿瘤标志物CEA、CYFRA211能够有效抑制。CEA、CYFRA211目前被认为是一种主要用于检测肺癌的肿瘤标志物, 在非小细胞肺癌鉴别、诊断中有着较高的敏感性与特异性[9]。有研究证实, 阿帕替尼在胃癌、肝癌等肿瘤细胞增殖中均体现出良好的抑制作用[10]。其与放疗联合应用能够起到协同作用, 强化治疗效果。此次研究观察组患者接受的是放疗联合阿帕替尼治疗, 结果发现该组患者经过治疗后CEA、CYFRA211指标均下降, 体现了该治疗方式对患者肿瘤标志物水平的改善作用。整体疗效对比, 观察组患者的总有效率为83.3%, 高于对照组的56.7%, 差异有统计学意义(P<0.05)。张靖宇等[11]在研究中对31例晚期肺癌患者给予阿帕替尼治疗, 结果显示疾病控制率为61.2%, 与本次研究结果相似。比较两组不良反应, 结果发现, 两组患者的蛋白尿、转氨酶升高、骨髓抑制、凝血异常发生率对比, 差异均无统计学意义(P>0.05);观察组患者的手足综合征、高血压发生率分别为26.7%、26.7%, 均高于对照组的6.7%、3.3%, 差异均具有统计学意义 (P<0.05)。阿帕替尼引起血压升高大多出现在服药后2周左右, 多数为轻至中度增高, 发生机制尚不明确, 一般认为与内皮细胞分泌一氧化氮和血小板分泌前列环素下降、内皮素功能紊乱等因素相关, 给予降压药物治疗可缓解。阿帕替尼治疗引起的手足综合征多在服药后3周左右发生, 可在医师指导下采取一些必要的对症支持治疗, 加强皮肤护理, 保持皮肤清洁, 避免继发感染, 避免压力摩擦[10]。对比两组患者预后, 结果显示, 观察组患者治疗后6个月、1年的生存率分别为80.0%、60.0%, 均高于对照组的53.3%、33.3%, 差异均具有统计学意义 (P<0.05)。说明该治疗方式能够在一定程度延长患者生存期, 提升生存率。
综上所述, 针对非小细胞肺癌患者行阿帕替尼联合放疗治疗, 是促进肿瘤病灶缓解、改善肿瘤标志物水平的有效治疗方案, 能够强化临床治疗效果、提升患者生存率, 不良反应可耐受, 可予以推广。
參考文献
[1] 张涛, 徐海亭, 王强, 等. 大分割调强放疗联合阿帕替尼治疗合并上腔静脉综合征非小细胞肺癌老年患者临床研究. 肿瘤研究与临床, 2019, 31(5):320-323.
[2] 殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学. 第4版. 北京:中国协和医科大学出版社, 2008:1200-1206.
[3] 李发祥. 阿帕替尼联合GP方案治疗晚期非小细胞肺癌的疗效及安全性. 实用癌症杂志, 2019, 16(6):952-955.
[4] 曹军丽, 王欣, 郑磊, 等. 阿帕替尼联合替吉奥胶囊一线治疗晚期非小细胞肺癌的效果观察. 中国综合临床, 2019, 35(3):221-226.
[5] 焦娇, 李敏. 阿帕替尼治疗晚期非小细胞肺癌的临床疗效评价. 临床医药文献电子杂志, 2017, 4(60):1821-1822.
[6] 赵瑞华, 周亚楠, 李鹤, 等. 阿帕替尼对晚期非小细胞肺癌患者的疗效及VEGFR2-906T>C多态性位点的影响. 中华医学杂志, 2019, 99(2):105-110.
[7] 安贞兰, 魏玮, 姚新明, 等. 阿帕替尼联合TP方案治疗非小细胞肺癌患者的疗效观察. 中国肿瘤临床与康复, 2018, 25(8):10-13.
[8] Livingston GC, Last AJ, Shakespeare TP, et al. Toxicityand dosimetric analysis of non-small cell lung cancer patients undergoing radiotherapy with 4DCT and image-guided intensity modulated radiotherapy: a regional centres experience. J Med Radiat Sci, 2016, 63(3):170-178.
[9] 曹恒, 王静, 纪媛媛, 等. 甲磺酸阿帕替尼治疗晚期非小细胞肺癌临床观察. 中华肿瘤防治杂志, 2017, 24(7):468-471.
[10] 王鹏善, 孙运祥, 刘玲. 阿帕替尼治疗晚期非小细胞肺癌的近期疗效及不良反应. 现代肿瘤医学, 2018, 243(9):53-55.
[11] 张靖宇, 蒋华, 朱明珍, 等. 阿帕替尼治疗晚期肺癌的疗效及疗效预测因子分析. 实用医学杂志, 2017, 33(22):3845.
[收稿日期:2020-01-13]

