以粉煤灰为原料制备高纯单分散球形纳米氧化铝
李智伟,田 昂,王宗凡,张永明,徐树英,徐 凯,李家飞
(1.海南大学海南省石油化工产品检测技术重点实验室,海口 570228;2.东北大学冶金学院,沈阳 110819)
0 引 言
我国是世界铝产能最大而铝土矿资源匮乏的国家,仅2018年氧化铝产量超过7 064万吨,铝土矿消耗1.7亿吨,对外依存度高达70%左右[1-2];同时我国又是火电粉煤灰排放量最大的国家,仅2014年就达到4.78亿吨[3],而绝大多数粉煤灰的Al2O3含量约30%~50%[4],因此,我国将粉煤灰综合利用提升到国家战略高度,“十三五”规划将粉煤灰为原料制取氧化铝以及其它铝化学品列为国家重点科技扶持对象,进行粉煤灰基氧化铝的研究开发具有长远的战略意义。
我国对LED用氧化铝(宝石氧化铝)的需求量居世界首位[5-7]。LED氧化铝不仅要求其纯度高而且要求其粒子有理想的形状,如单分散球形、分散六角形等[5]。目前,我国采用醇铝水解法制备的高纯氧化铝,其形貌不规则,呈蠕虫状,可用于低档LED基底衬料,而具有理想形状的高纯氧化铝仍然需要从美国、日本等国家进口[6-7]。因此,进行单分散球形超细氧化铝粉体制备研究具有重要现实意义。
2010年以后,以加拿大Orbite Aluminae铝业公司引领的酸法氧化铝工艺[8]得到长足进展,全球迅速掀起了粉煤灰酸法制备各级各类氧化铝的技术开发潮流[9-10]。本研究以CFB粉煤灰为原料,酸法提取铝盐AlCl3作为制备高纯Al2O3的铝源,通过盐析与铵明矾重结晶复合法除杂,得到纯度高于99.997%的高纯铵矾,然后采用有机分散剂GUMA辅助均匀沉淀法,成功制备出纯度高达99.99%,平均粒径集中在200 nm的单分散球形高纯纳米氧化铝。
1 实 验
1.1 原料及试剂
JH粉煤灰,属于循环流化床(CFB)粉煤灰,某热电厂提供;高纯硫酸铵,50%的AR硫酸铵溶液中加入计量H2O2经80 ℃反应30 min后静置冷却,用慢速定量滤纸过滤除去杂质,再浓缩重结晶制取;高纯氨水:瓶装液氨慢速挥发、经气体超滤膜后用高纯水吸收制取;高纯分散剂GUMA,经分离精制GUM生物胶制取,其灼烧减量<1 850 ppm,灼残中的10%盐酸不溶物<500 ppm(折算为GUM基);高纯HCl气体,在回收共沸液(20%盐酸)中缓慢滴入浓硫酸、HCl气体经石英填料玻璃精馏柱冷却后制取;高纯尿素,AR级尿素重结晶法制取;其它试剂均为AR级,购自麦克林生化科技有限公司。
1.2 分析测试
采用奥龙Y2000 XRD粉末衍射仪进行物相分析,Cu Kα射线/30 kV/25 mA、扫描速度0.05°/s,莫来石含量采用企标Q/SH 018.0134-90中规定的XRD晶面(121)外标法测定;采用Hitachi公司SU8020 FE-SEM电镜观察样品形貌;采用百特BT-9300H激光粒度仪测定样品的聚集体粒径;采用Thermo Fisher公司X Series-X7 ICP-MS分析样品的化学组成。
1.3 粉煤灰酸浸制备铝盐浸取液
在三口玻璃反应器中加入盐酸溶液,粉煤灰可分批加入反应器,以防止因放热反应剧烈而爆沸:室温下加入粉煤灰总量的20%~30%,缓慢升温到60 ℃时暂停加热,观察反应平稳后,将剩余粉煤灰缓慢加入反应器,在沸点(105 ℃)以下恒温浸取一定时间。反应结束后过滤分离即得浸取液A;滤饼用回收盐酸共沸液(20%盐酸)洗涤2次,洗涤母液B与A合并,即得浸取液C(AlCl3溶液)。
1.4 氯化氢盐析与铵明矾重结晶复合除杂
浸取液C溶液通入HCl气体盐析,当溶液中HCl浓度达到30%以上时,则析出AlCl3·6H2O晶体,其它金属杂质保留在溶液,即得盐析法纯化的铝盐AlCl3·6H2O。将纯化的铝盐溶解,加入计量高纯硫酸铵,用高纯氨水调pH值到2±0.5,100 ℃反应30 min,再浓缩到溶液表面有微量晶体膜生成时趁热过滤,滤液冷却结晶,即得重结晶法纯化的铵矾NH4Al(SO4)2·12H2O。
1.5 球形纳米氧化铝粉体的制备
纯化铵矾、尿素与分散剂按比例溶解混合,充分搅拌溶解后转入250 mL聚四氟乙烯反应釜中,90 ℃反应12 h,冷却过滤,滤饼分别用纯水和无水乙醇超声交叉洗涤数次,冷冻干燥、焙烧后,得到高纯氧化铝粉体。
2 结果与讨论
2.1 原料粉煤灰特性分析
本文拟用JH粉煤灰为初始原料制备高纯Al2O3粉体,为了解原料特性,对JH灰进行化学组成及物相分析,并与国内其它粉煤灰进行了比较,结果见表1和图1。
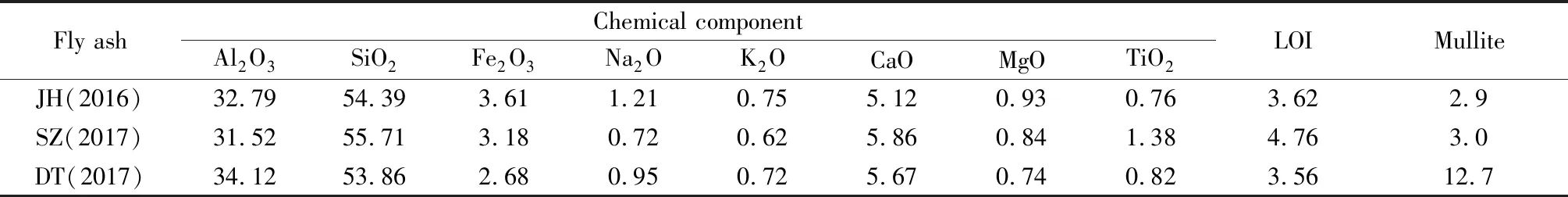
表1 原料粉煤灰组成分析Table 1 Analysis of raw material fly ash composition /wt%

图1 原料粉煤灰XRD谱Fig.1 XRD patterns of raw material fly ash
在表1中,JH与SZ粉煤灰取自电厂的循环流化床CFB灰,DT粉煤灰取自鼓泡床BFB灰。从中看出,与其它两个电厂的粉煤灰相比,JH灰中TiO2较低、Fe2O3较高,其它组成相近;从图1物相分析看出,三种粉煤灰均含有少量的莫来石,但DT粉煤灰的莫来石含量高达12.7wt%,而JH与SZ粉煤灰则在3wt%以下,这有利于增加其酸浸Al2O3的提取率。
2.2 JH粉煤灰Al2O3的提取工艺优化

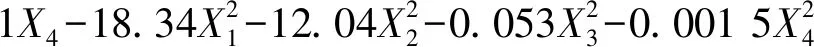
(1)
其置信度a=0.01时,F复=0.999 9,回归方程可靠度较高。采用WUST5.0软件进行了优化预测(见表2),并进行了实验验证,其验证浸取率为95%,比优化预测值97%仅低2个百分点,说明优化工艺可靠,可作为从JH粉煤灰酸浸Al2O3的浸取工艺条件。
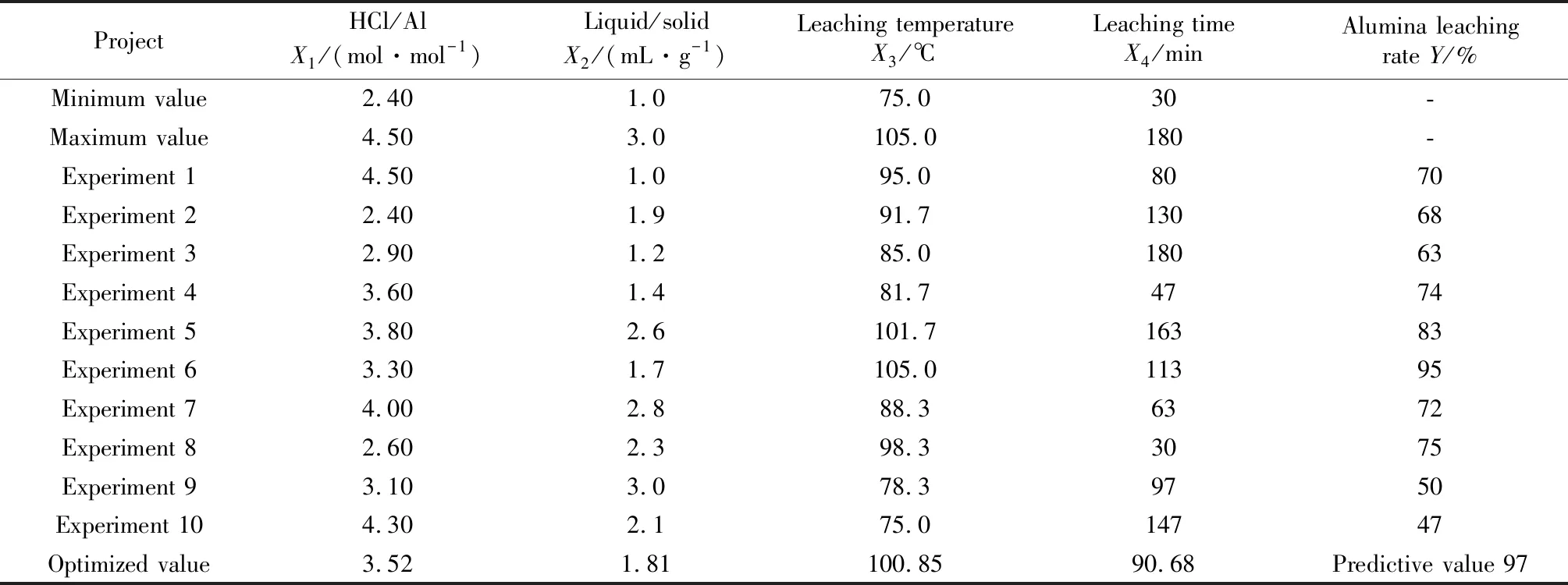
表2 浸取试验均匀设计表Table 2 Leaching test uniform design table
2.3 盐析及重结晶复合除杂
LED氧化铝是α-Al2O3,制备均须经过1 200 ℃以上长时间焙烧,S、Cl等阴离子杂质均已挥发,因此提纯难点集中在除去金属杂质[12]。参照前人[12-13]及本课题组[14]前期盐析工艺条件,对前述浸取液(AlCl3溶液)进行3次盐析提纯,得到纯化的AlCl3·6H2O晶体,对其进行了59种可能存在的杂质金属元素分析,表3列出了关键杂质元素(钠钾铁等)以及大于5 ppm的杂质元素分析结果。

表3 关键杂质元素及大于5 ppm的杂质元素(折算为Al2O3为基础)Table 3 Key impurity elements and impurity elements greater than 5 ppm (converted to Al2O3)
从表3看出,金属镓、钛、钒三种元素含量较高,均超过5 ppm,总量高达31.4 ppm。根据这三种元素的溶液离子特点,推测在以HCl气体盐析形成AlCl3·6H2O结晶时,在高浓度盐酸溶液中,杂质可能以(GaCl3)2·nH2O二聚态、TiOCl2·nH2O、VOCl3·nH2O形态夹带析出,导致AlCl3·6H2O中这三种杂质含量偏高。因此,对上述AlCl3·6H2O提纯物再进行2次铵明矾NH4Al(SO4)2·12H2O重结晶法提纯。这基于两方面考虑:一是在微酸性溶液中铵明矾结晶时更易与Ga3+、TiO2+、VO3+分离,便于除去杂质;二是制备球形纳米Al2O3需要铵明矾中间体。因此,先将盐析纯化的AlCl3·6H2O与计量高纯硫酸铵(NH4)2SO4混合溶解后,进行铵明矾重结晶。经此法除杂后,三种杂质分别降至Ga 3.7 ppm、Ti 2.9 ppm、V 3.0 ppm,均小于5 ppm,纯度达到99.997%(折算为Al2O3计),达到了预期效果。
2.4 单分散球形纳米Al2O3制备
LED氧化铝属于蓝宝石级α-Al2O3,不仅要求纯度高,更重要的是粒径小,且粒径分布窄,这是近年全球LED行业亟待解决的问题[15-17]。由于均匀沉淀法普遍存在粒径分布较宽的问题,因此以前述纯化的NH4Al(SO4)2·12H2O为铝源,采用有机分散剂法制备粒径分布窄的球形α-Al2O3。
2.4.1 分散剂选择
图2及表4是不同有机分散剂制备的氧化铝粒子特性。从中看出,在5种所选分散剂中,以GUMA制备球形氧化铝粒子,不但粒径小(800 nm),而且粒度分布很窄,且分散性能很好,说明GUMA是一种较理想的球形纳米Al2O3制备分散剂。
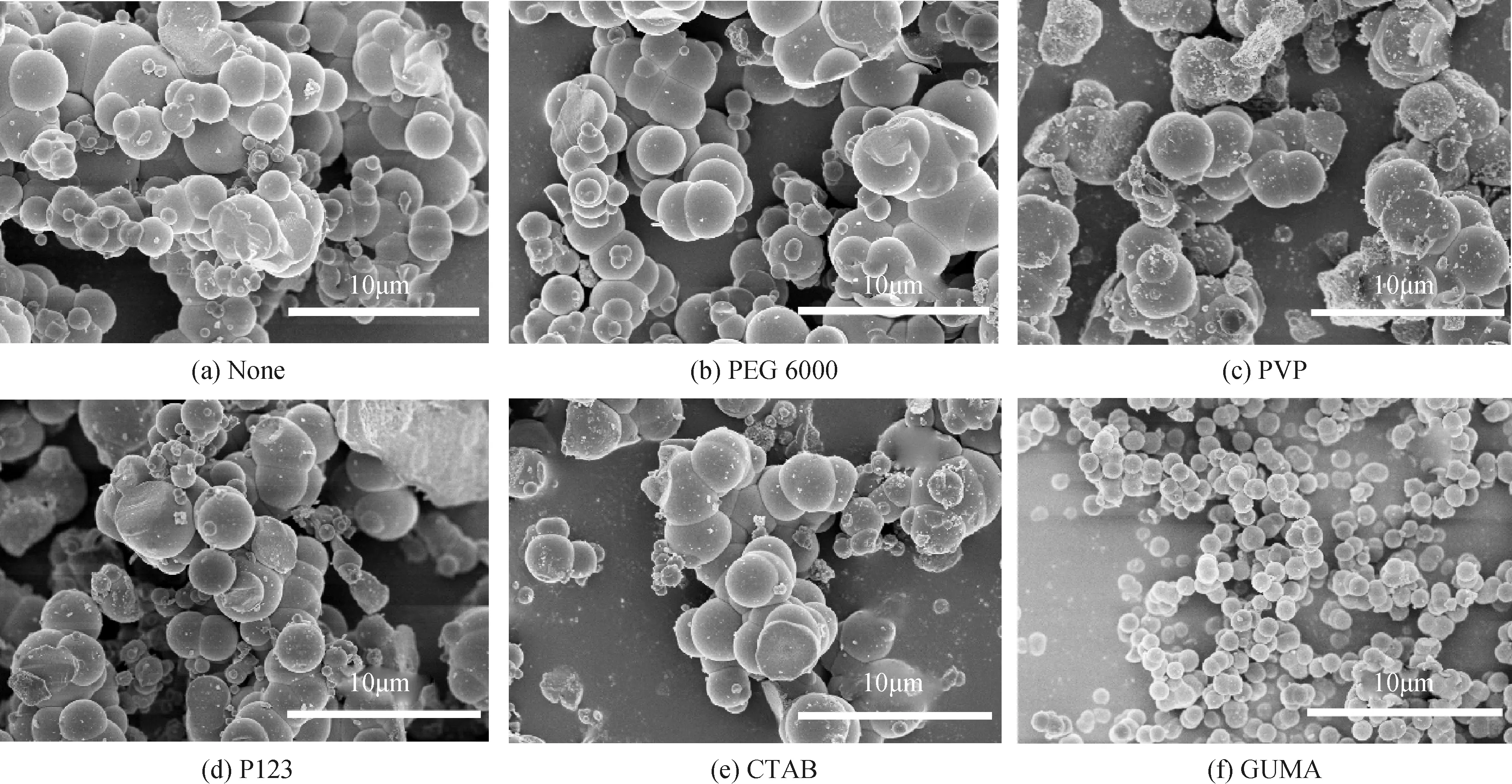
图2 不同分散剂对粒径及其分散度的影响
Fig.2 Effect of different dispersants on particle size and dispersion
表4 不同分散剂对粒径的影响
Table 4 Effect of different dispersants on particle size

DispersantScherrer particle size/nm(XRD grain particles)SEM particle size/μm(particles)Laser particle size D50/μm(agglomerate scattering particles)None21.8~0.1-4.6(wide distribution)14.98PEG 600021.7~0.1-4.5(wide distribution)11.88PVP21.5~0.6-4.5(wide distribution)8.877P12321.4~0.2-4.5(wide distribution)7.933CTAB21.6~2.0-4.5(wide distribution)8.026GUMA21.5~0.7-0.8(uniform distribution)1.966
2.4.2 分散剂量对Al2O3粒子特性的影响
图3及表5是在加入不同量分散剂GUMA制备氧化铝粒子的实验结果,从中看出,当GUMA加入量为0.5%时,其粒径较大,在900 nm左右;当GUMA加入量达到5.0%时,其粒径减小到200 nm左右、粒径分布很窄、粒子间分散性很好,但如继续提高GUMA用量,其对粒径减小作用不明显,但粒子分散性变差,离子间粘连严重,因此,GUMA加入量以5.0%为宜。

表5 不同量的分散剂GUMA对粒径的影响Table 5 Effect of different amount of dispersant GUMA on particle size

图3 不同量分散剂GUMA制备α-Al2O3的SEM照片
Fig.3 SEM images of α-Al2O3prepared with different amount of dispersant GUMA
2.4.3 高纯单分散球形纳米氧化铝性能
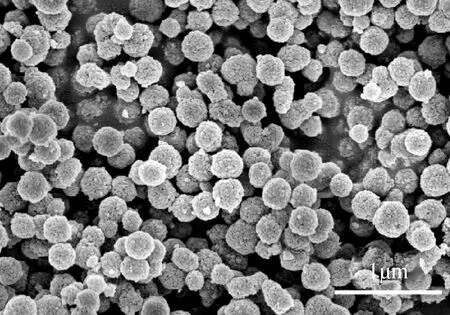
图4 高纯单分散球形纳米α-Al2O3的SEM照片Fig.4 SEM image of high purity monodisperse spherical nano-α-Al2O3
在上述研究及对反应时间、反应温度等工艺条件优化基础上,以前述高纯铵明矾NH4Al(SO4)2·12H2O为铝源,制备出球形Al(OH)3前驱体,然后在700 ℃焙烧1 h成形,成形产物用2 mol/L高纯稀盐酸洗涤以降低有机分散剂带入的微量杂质并取样分析其化学组成(表6),然后于1 200 ℃恒温焙烧2 h得到Al2O3成品,最后对其进行SEM粒子形貌分析(图4)、XRD物相分析(图5)及BET孔结构和比表面分析(图6)。
结果表明,所制备Al2O3产品,其纯度达到99.99%以上;其物相为纯α-Al2O3相,未见其它杂晶相;其粒径在200 nm,粒子形态为球形,且粒径分布窄、粒子圆度好、粘连性低;BET吸附曲线表明,即使在较宽的压力范围(0.5

表6 Al2O3纯度及杂质Table 6 Al2O3 purity and impurities /ppm
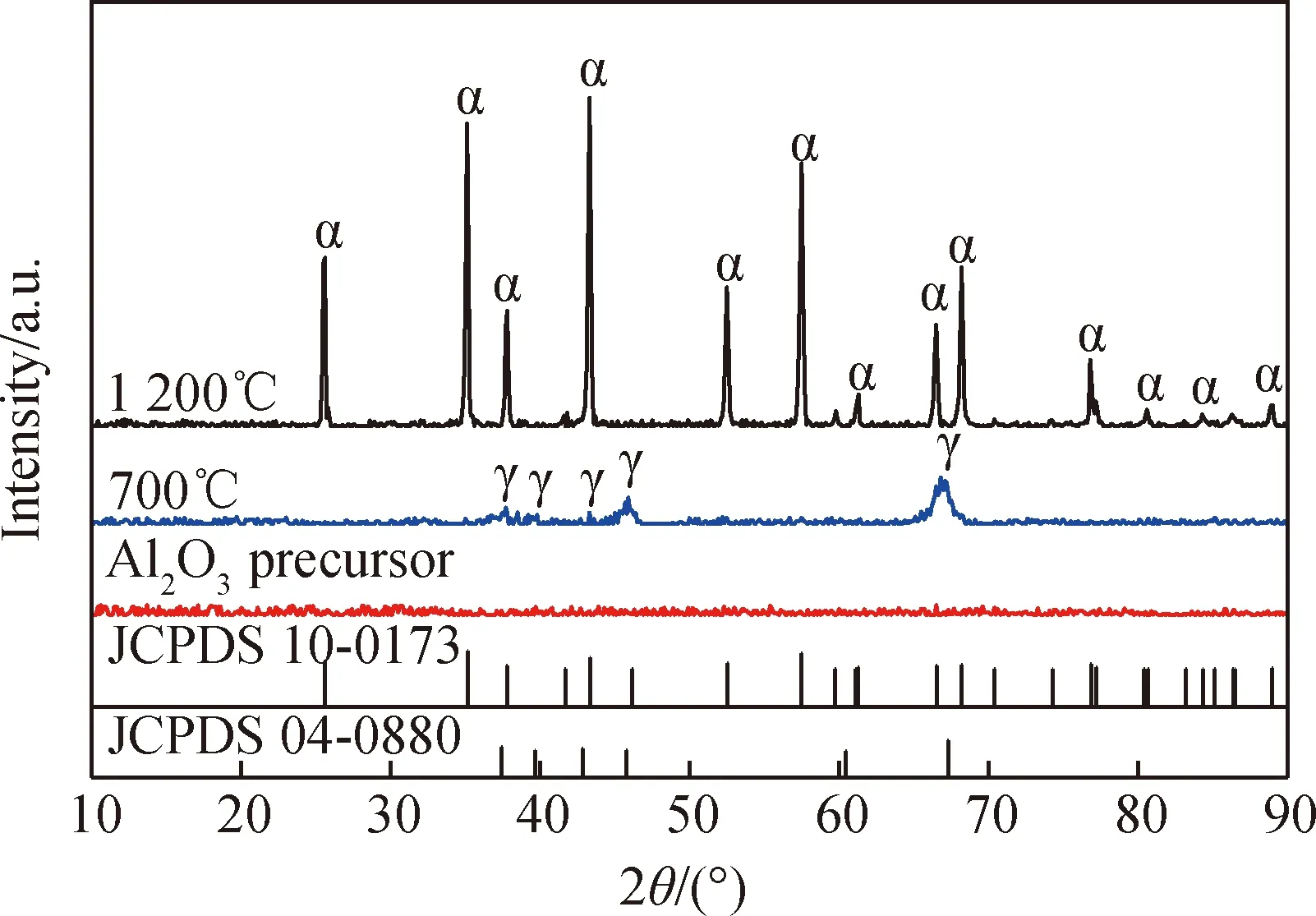
图5 高纯纳米Al2O3产品XRD谱
Fig.5 XRD patterns of high purity nano-Al2O3products
图6 高纯纳米Al2O3产品BET吸附曲线
Fig.6 BET adsorption curves of high purity nano-Al2O3products
2.4.4 GUMA的分散机理探讨
基于GUMA的分子结构特性,我们推测,单分散球形纳米氧化铝的形成机理(图7)是:由于精制GUMA是以“花式羟基结构”[18]的水溶性半乳糖HO-AGP为主(90%)的有机高分子物质,其存在羟基游离H+,但不存在游离OH-;而尿素法瞬时均匀沉淀的Al(OH)3粒子表面存在活性羟基-OH[19]。这两类物质通常会发生脱水缩合而形成烷基氢氧化铝[20]:

(2)
由于GUMA包覆在Al(OH)3沉淀粒子的表面,进而阻止了Al(OH)3沉淀粒子间的粘连。这种分散的沉淀粒子再经过陈化、干燥以及焙烧脱除GUMA等处理,最终形成均匀分散的纳米氧化铝粒子。
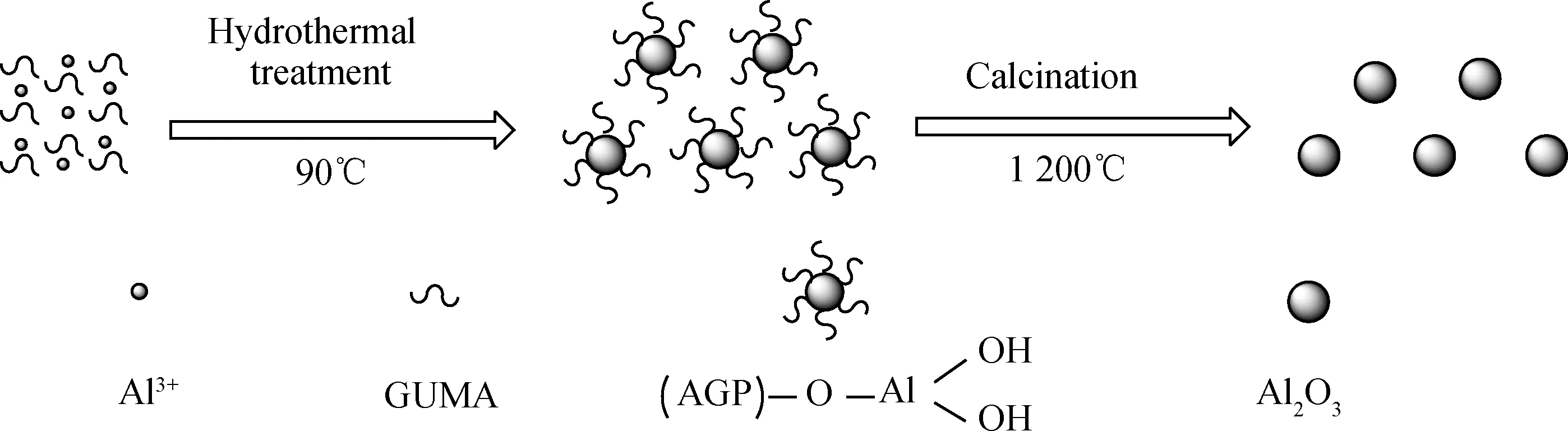
图7 GUMA的分散作用机理示意图
Fig.7 Schematic diagram of dispersion mechanism of GUMA
3 结 论
(1)循环流化床粉煤灰JH灰含有33%的Al2O3,含量较高,且酸浸反应活性高,酸浸提取率可达95%,可替代铝土矿制备铝盐AlCl3及氧化铝Al2O3产品;JH粉煤灰中含有较高的金属钛镓钒杂质,可用盐析及铵钒重结晶复合法降低铝盐杂质,可作为高纯氧化铝制备前驱体。
(2)采用有机分散剂GUMA辅助均匀沉淀法,可将高纯铝盐前驱体转化为200 nm的高纯球形α-Al2O3粉体,该粉体具有纯度高、粒径小、粒径分布窄、粒子间粘连性小、分散度高的特点,可用于高档LED基底衬料。

