星点设计-效应面法优化盐酸川芎嗪鼻用凝胶剂的处方及其体外释放行为研究*
郝 晶,王小宁,闫梦茹,马远涛,梁晓燕
(西安医学院 药学院,陕西 西安710021)
前 言
盐酸川芎嗪是中药伞形科植物川芎(Ligusticum chuanxiong Hort.)的有效成分之一,临床常以盐酸盐的形式应用,用于闭塞性血管疾病、脑血栓形成、脉管炎、冠心病、心绞痛等疾病的治疗,目前上市的川芎嗪主要剂型有注射剂和口服片剂[1,2]。然而,川芎嗪半衰期短、易氧化,导致口服生物利用度不高,而注射给药极不方便,极大地限制了其临床应用,因此关于川芎嗪的新制剂研究日益受到关注[3]。近年来,鼻腔给药是研究较多的脑靶向给药途径之一。鼻腔给药后,药物可通过嗅黏膜上皮通路和嗅神经通路绕过血脑屏障直接吸收入脑,也可以通过血液循环通路透过血脑屏障进入脑组织[4]。鼻用原位凝胶剂是鼻腔给药途径研究的热点,将其以溶液状态给药,滴入鼻腔后因鼻腔的pH 环境改变而发生胶凝,成为半固体凝胶状态,从而延长药物在鼻腔内滞留时间、增加药物吸收[5~7]。鉴于此,研究川芎嗪的鼻腔给药凝胶制剂,对于探究其经鼻给药的可行性具有重要意义。因此,本研究采用卡波姆934、羟丙基甲基纤维素(HPMC)为盐酸川芎嗪鼻用凝胶基质,旨在通过星点设计- 效应面法优化凝胶处方,并采用透析法考察其体外释放性能,为下一步盐酸川芎嗪鼻用新制剂的开发研究奠定基础。
1 实验部分
1.1 主要原料与试剂
盐酸川芎嗪对照品(上海源叶生物科技有限公司,批号:Y19O7Y17134,纯度≥98%),卡波姆940、HPMC(药用级别,天津科密欧化学试剂有限公司),氢氧化钠、碳酸氢钠、磷酸二氢钾等试剂(分析纯,天津科密欧化学试剂有限公司),甲醇(色谱纯,天津市河东区红岩试剂厂)。
1.2 仪器与设备
恒温加热磁力搅拌器(ZNCL-T1000 型,西安予辉仪器有限公司);数显黏度计(NDJ-8S 型,上海标卓科学仪器有限公司);冷冻干燥机(FreeZone,Labconco 公司);电子分析天平(BS210S,北京赛多利斯天平有限公司);高效液相色谱仪(1260 型,Agilent)。
1.3 盐酸川芎嗪鼻用凝胶的制备
(1)人工鼻液的配制
精密称取磷酸二氢钾13.6g,加入纯水1L 溶解,用0.1mol/L 的氢氧化钠调节pH=6.8 即得[8]。
(2)凝胶基质的制备
按处方量取卡波姆溶液和HPMC 溶液混匀,用三乙醇胺调节pH=4.0,再用人工鼻液调节至pH=5.0,得到凝胶基质[5]。
(3)星点设计- 效应面法优化凝胶处方
选取卡波姆浓度和HPMC 浓度作为2 个主要因素,进行2 因素5 水平优化,以凝胶黏度为指标优选处方。根据星点设计- 效应面法原理,采用Design-Expert 实验设计软件(8.05b 版本)辅助设计,各因素水平代码和具体物理量见表1[9]。
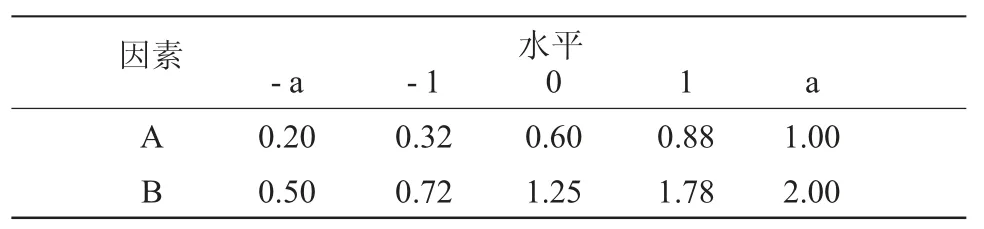
表1 自变量水平表Table 1 The factors and levels
1.4 盐酸川芎嗪含量测定方法的建立
(1)对照品储备液的配制
精密称取盐酸川芎嗪对照品25mg,置于50mL量瓶中,加甲醇溶解,稀释至刻度,摇匀,即得浓度为0.5mg/mL 的盐酸川芎嗪储备液。
(2)供试品溶液的制备
取一定量的鼻用凝胶1mL 置于50mL 容量瓶中,加入去离子水适量,超声20min,摇匀,添加去离子水至刻度,放冷待测。
(3)阴性对照溶液的制备
取处方量的辅料加入到去离子水中,制成空白辅料溶液,冰箱冷藏。
(4)色谱条件
色谱柱:Agilent HC-C18(2)(4.6×150mm,5μm);流动相:水- 甲醇- 三乙胺(40∶60∶0.2,v/v);流速:1.0mL/min;检测波长:294nm;柱温:室温;进样量:20μL[10]。
(5)标准曲线的制备
精密吸取对照品储备液1、2、4、6、8mL 置于10mL 容量瓶中,加甲醇定容至刻度,即得浓度分别为0.05、0.10、0.20、0.30、0.40mg/mL 的标准液。以标准液浓度和对应液相色谱峰面积作图,横坐标为标准液浓度C,纵坐标为对应的峰面积A,绘制标准曲线。同时进行精密度、稳定性、加样回收率试验。
1.5 药物释放试验
精密取按优化处方制备的原位凝胶2.50mL 3份,置于透析袋中(截留相对分子质量3500)中,于新配人工鼻液80.00mL 中用磁力搅拌器搅拌进行释放试验,转速200r/min,温度37℃,分别于30min和l、2、3、4、5、6、8、10、12h 取样1.50mL(同时补加同温等量人工鼻液),样品按照色谱条件进行测定,计算各取样时间点介质中药物的累积释放率。
2 结果与讨论
2.1 鼻用凝胶处方的优化
星点设计及实验结果见表2。
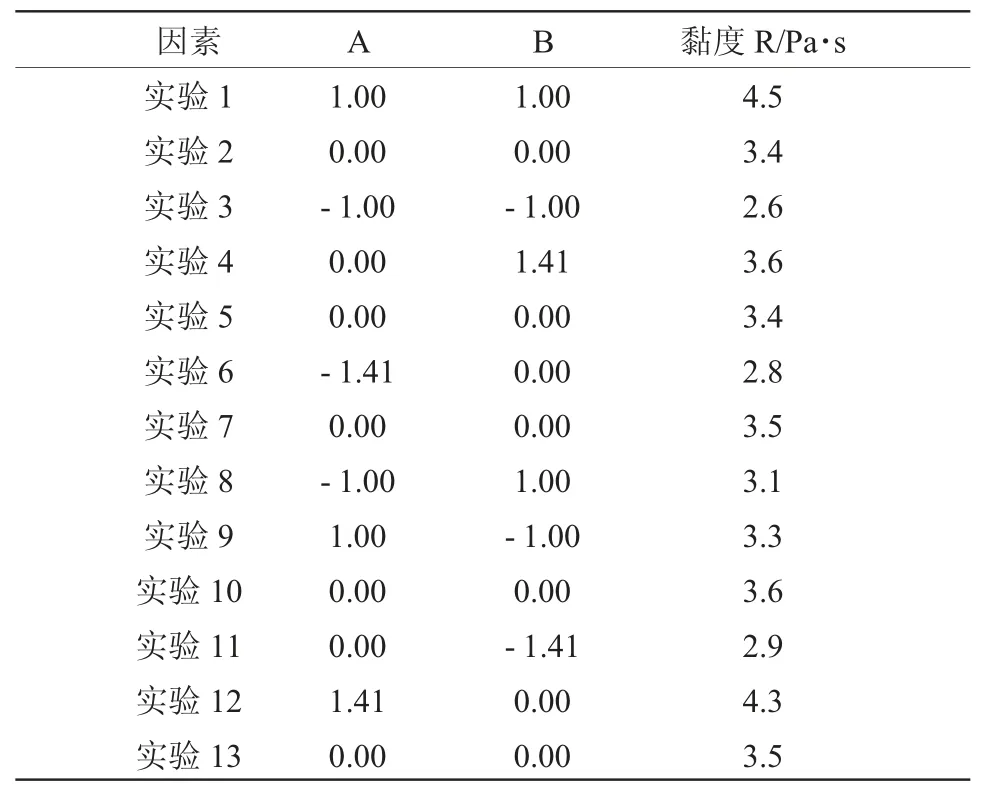
表2 星点设计及实验结果Table 2 The results of central composite design and experiment
根据表2 试验结果,利用Design-Expert 8.0.5软件进行多元回归方程拟合和方差分析。回归方程为 :R=1.904-0.034A+1.003B+1.179AB+0.363A2-0.431B2,方差分析结果见表3。
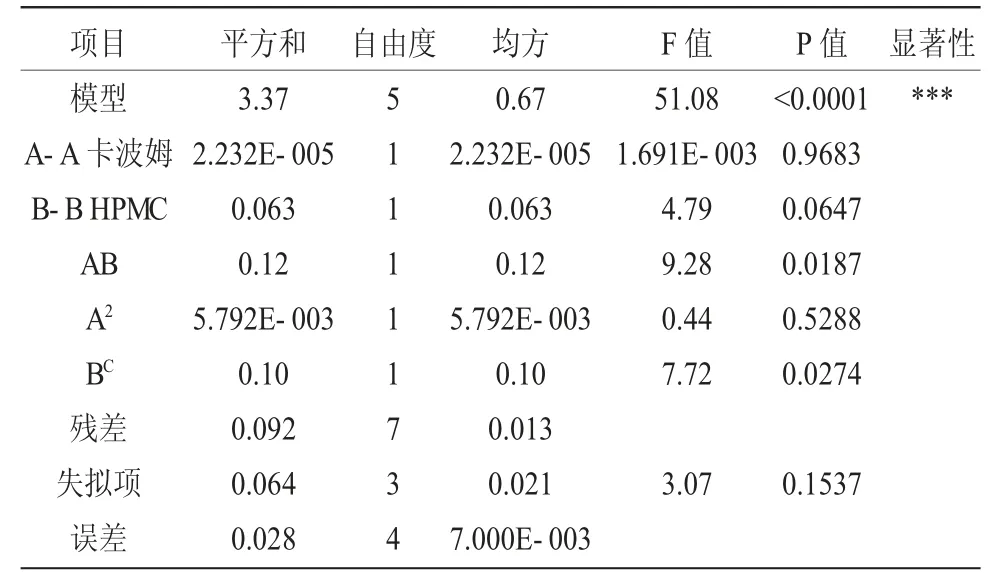
表3 方差分析Table 3 The analysis of variance
方差分析结果显示,该拟合模型P<0.0001,表明模型具有极显著性,模型修正系数R2=0.9543,表明模型拟合度好。同时,方程的失拟项F 值为3.07,P>0.05,表示失拟项不显著,回归方程在整个回归区域内的拟合情况良好,可用该回归模型代替真实试验点对结果进行分析[9]。由表3 可知,卡波姆浓度和HPMC 浓度对响应值不具有显著性影响(P>0.05)。各自变量间的三维效应曲面图如图1 所示,各因素与OD 值呈较明显的二次抛物关系,表明各交互因素在响应值存在最大值。
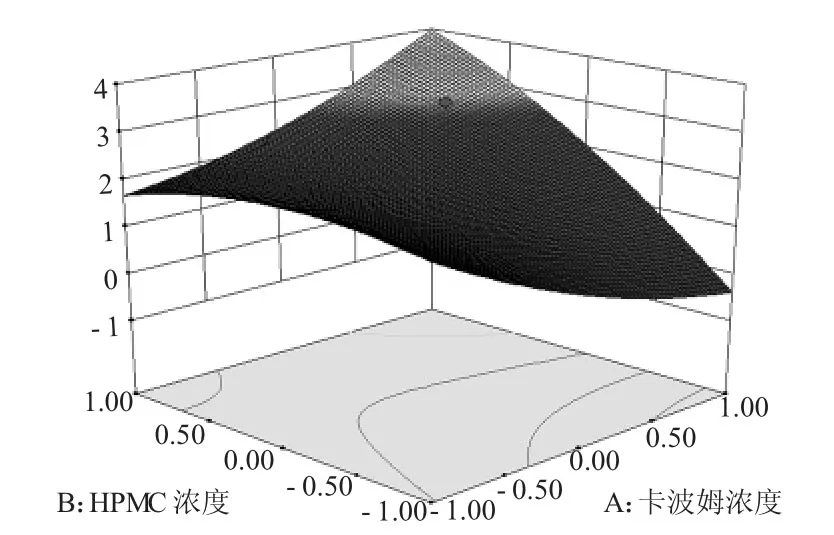
图1 因素A、B 对凝胶黏度影响的响应曲面图Fig. 1 The response surface plot of the effect of factor A and B on gel viscosity
2.2 验证实验
根据Design-Expert 8.0.5 软件对试验结果进行系统分析,得出最佳凝胶处方:卡波姆浓度为1.0%,HPMC 浓度为1.9%,预测在此工艺下所得凝胶的黏度为4.83Pa·s。按照以上优化的条件进行平行3 组包合验证试验,可得出凝胶黏度平均值为4.85Pa·s,RSD 为0.41%,结果表明凝胶处方稳定可行。
2.3 盐酸川芎嗪含量的测定
(1)专属性试验 分别精密吸取对照品溶液、供试品溶液和阴性对照溶液20μL,按照色谱条件进行测定,得色谱图如图2。在上述色谱条件下,盐酸川芎嗪保留时间为3.026min,杂质及溶剂峰无干扰。
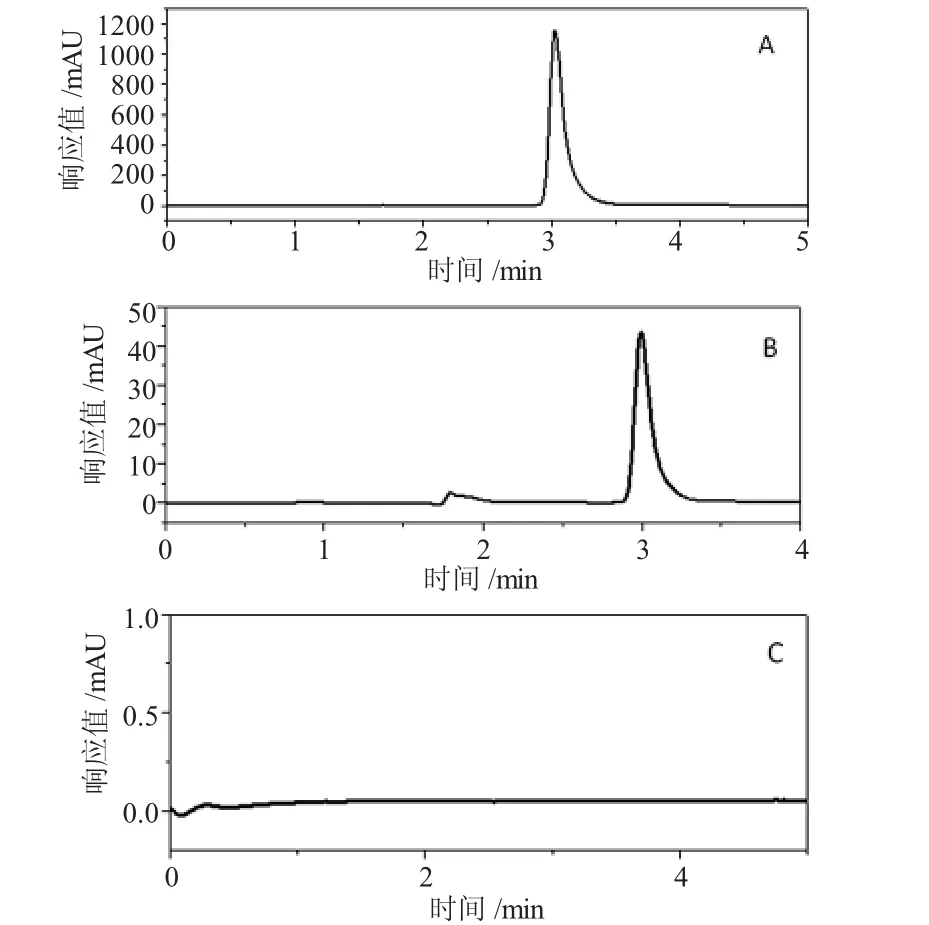
图2 HPLC 色谱图(A:标准品溶液 B:样品溶液 C:阴性对照溶液)Fig. 2 The HPLC chromatograms(A:standard solution B:sample solution C:negative control solution)
得到标准曲线的回归方程为A=99.905C-48.475,r=0.9997,盐酸川芎嗪在0.05mg/mL~0.40mg/mL 范围内与峰面积有良好的线性关系。
(2)精密度实验 取1.4 项下的同一浓度的对照溶液(0.20mg/mL),按照色谱条件测定,连续进样6次,计算RSD 值为0.97%,表明精密度良好。
(3)稳定性实验 取1.4 项下的同一浓度的对照溶液(0.20mg/mL),分别在0、1、2、3、6、12h 按照色谱条件进样测定,计算RSD 值为0.56%,表明在12h内稳定性良好。
(4)加样回收率试验 取3 份已知含量的盐酸川芎嗪鼻用原位凝胶溶液适量,分别精密加入对照品适量。按照色谱条件进行测定,计算得回收率分别为98.61±2.55%、99.76±1.94%、100.22±3.11%,加样回收率满足含量测定方法学要求。
2.4 体外释药
采用透析法测定盐酸川芎嗪鼻用凝胶的体外释药特性,按照色谱条件测定释放的药量,计算累积释放度,释放曲线见图3。
由释放曲线可以看出,盐酸川芎嗪鼻用凝胶表现出明显的缓释特性。2h、4h 释放度分别为(50.06±2.79)%、(59.82±4.56)%,具有突释现象,随后药物的释放达到平台期。12h 时,微球的释放度为(86.98±3.58)%,24h 时,微球的累积释放度为(93.20±2.91)%,已基本释放完全,因此,盐酸川芎嗪鼻用凝胶具有较好的缓释效果。这可能是因为释放介质渗入到凝胶中,使凝胶发生溶胀,凝胶孔隙增大,同时药物在释放介质中溶解形成浓溶液,依靠与介质间的浓度差进行扩散,药物逐步缓慢释放[11]。分别进行Higuchi 模型、Weibull 模型、零级释药过程和一级释药过程拟合,得出释药方程如表4 所示。由拟合结果可以看出,盐酸川芎嗪鼻用凝胶的药物体外释放符合Weibull 模型。
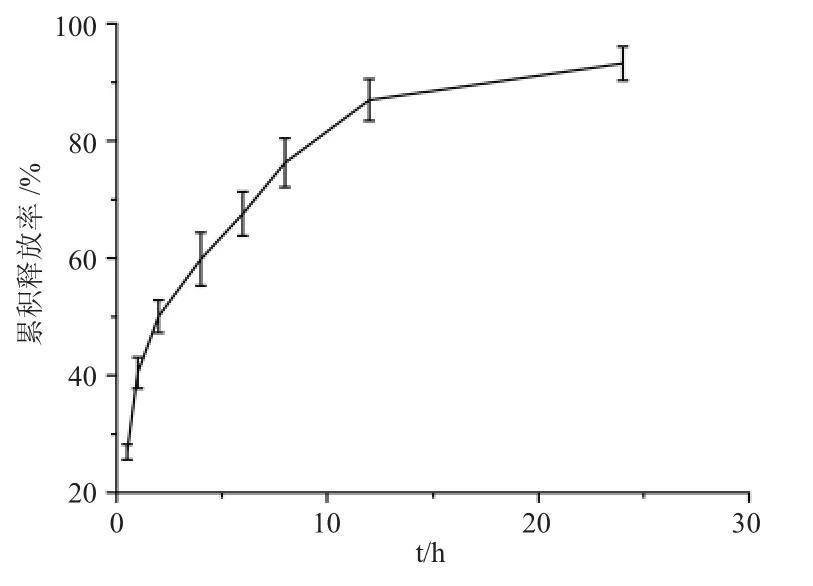
图3 盐酸川芎嗪鼻用凝胶的释放曲线Fig.3 The in vitro release curve of ligustrazine hydrochloride nasal gel
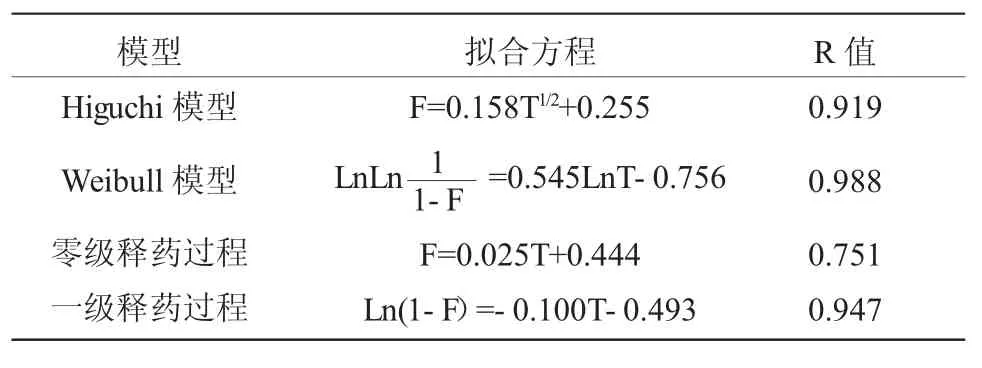
表4 体外释放曲线模型拟合Table 4 The in vitro release curve fitting result
3 结 论
(1)通过星点设计- 效应面法优化盐酸川芎嗪鼻用凝胶剂的处方,Design-Expert 8.0.5 软件进行数据分析,所建立的模型拟合度高,试验误差小,说明采用星点设计- 效应面法优化原位凝胶处方具有较好的预测效果。
(2)体外释药实验结果表明,鼻用凝胶释放过程符合Weibull 模型,表现出明显的缓释效果,达到了研究的预期目标,凝胶的鼻腔黏附性及鼻腔给药时的黏膜通透性有待进一步研究。

