微纤维相关蛋白2在结直肠癌中的表达及其对病人预后的影响
谭婉燕 李凝旭
结直肠癌(colorectal cancer,CRC)是一种常见的消化道恶性肿瘤,是导致癌症相关死亡的主要原因之一[1]。有数据显示,2018年全世界CRC的新发病例超过180万,死亡人数约为88.1万,分别高居所有恶性肿瘤的第3位和第2位[2]。目前研究证实,CRC的发生发展是一个涉及多基因的多阶段、多步骤的复杂过程,原癌基因的激活和抑癌基因的失调在其中发挥关键作用[3]。微纤维相关蛋白2(microfibril-associated protein 2,MFAP2)作为一种细胞外基质蛋白,其可与原纤维蛋白相互作用以调节微纤维的功能,在肥胖症,糖尿病和骨质疏松症中扮演重要角色[4]。近年来,MFAP2在恶性肿瘤发生发展中的作用也逐渐引起人们的重视。有研究表明,MFAP2在头颈部鳞状细胞癌、多发性骨髓瘤和胃癌中显著上调,发挥促癌基因的功能,参与肿瘤细胞的各种生命活动[5-7]。本研究旨在检测MFAP2在CRC细胞及组织中的表达情况,并分析其与CRC病人临床病理特征及预后的相关性。
对象与方法
一 、对象
2013年1月~2014年4月我院住院并接受手术治疗的CRC病人组织标本65例。纳入标准:术前未接受放化疗;病理检查证实为CRC;临床资料完整,具有5年随访资料。男性38例,女性27例,年龄36~74岁,平均年龄(60.21±10.14)岁,根据第7版国际抗癌联盟(UICC)TNM分期标准:Ⅰ期6例,Ⅱ期28例,Ⅲ期31例。术中收取组织标本包括癌及其配对的癌旁组织(距离癌组织5 cm以上),所有标本分成两份:一份放入液氮并迅速转移至-80℃冰箱冻存用于总RNA的提取;另一份放入10%的福尔马林溶液中固定用于免疫组化切片染色。本研究经我院医学伦理委员会批准,所有病人均签署知情同意书。
二、方法
1.主要试剂与仪器:主要试剂:胎牛血清(美国Gibco公司),RPMI-1640培养基(美国Gibco公司),0.25%胰蛋白酶(美国Gibco公司),RNA提取试剂盒(美国Invitrogen公司),荧光定量PCR试剂盒(美国Invitrogen公司),BCA蛋白浓度测定试剂盒(上海碧云天生物技术公司),鼠抗人MFAP2多克隆抗体(英国Abcam公司),鼠抗人GAPDH单克隆抗体(英国Abcam公司)。引物由武汉巴菲尔生物技术服务有限公司合成,MFAP2基因上游引物:5'-CCCAAGCTTGTGAGGAACAGTACCCGT-3',下游引物:5'-CGGAATTCGATACTCCCCCAACCCGA-3';GAPDH基因上游引物:5'-GCACCACCAACTGCTTAGCA-3',下游引物:5'-GTCTTCTGGGTGGCAGTGATG-3'。主要仪器:组织切片机(德国Leica公司),漂烘片机(德国Leica公司),PCR仪(美国Bio-rad公司),低温离心机(赛默飞世尔公司),微量加样器(德国Eppendorf公司),免疫印迹(Western-blot)电泳仪(美国Bio-rad公司),ChemiDoc MP全能型凝胶成像分析系统(美国Bio-rad公司)。
2.细胞培养:人结直肠癌细胞株(HCT116,SW480)及正常结直肠上皮细胞(NCM460)均培养于含10%胎牛血清的RMPI 1640培养基中,37℃、5%CO2条件下常规培养,2~3天传代1次。
3.实时荧光定量逆转录聚合酶链反应(RT-qPCR):Trizol法提取细胞及组织中RNA,-80℃冰箱保存。取1 μg RNA按照逆转录试剂盒说明书进行逆转录反应合成互补脱氧核糖核酸(cDNA),加入SYBR green染料(Qiagen)进行PCR扩增。实时荧光定量逆转录聚合酶链反应的条件为:95℃预变性30秒,之后95℃ 5秒,60℃ 30秒,共40个循环后进行溶解曲线检测,数据处理采用2-△△Ct法。
4.Western blot:细胞培养48小时后,吸弃上清液,收集细胞,加入细胞裂解液,提取总蛋白,应用BCA试剂盒对蛋白浓度进行检测。配制10%分离胶和5%浓缩胶,电泳转膜,5%脱脂牛奶封闭,置于鼠抗人MFAP2抗体(1∶3000稀释)或鼠抗人GAPDH(1∶1000稀释)中4℃孵育过夜孵育结束后,洗膜,再滴加兔抗鼠二抗室温摇床孵育1小时,再洗涤。将洗涤千净的PVDF膜置于ChemiDoc MP全能型凝胶成像分析系统仪器中扫膜,用Image Lab软件系处理图像即得到最终结果。
5.免疫组织化学染色:采用免疫组化SP法对切片进行染色。具体操作如下:取4 μm厚组织石蜡切片常规脱蜡至水化,3% H2O2去离子水(无色液体)孵育10~30分钟,以灭活内源性过氧化物酶活性。山羊血清封闭15~30分钟,孵MFAP2一抗(1∶100稀释),37℃孵育2~3小时,次日滴加标记有HRP的二抗室温孵育30分钟,显色剂显色(DAB),显微镜下控制反应时间。苏木素复染,逐级脱水、透明、中性树胶封片染色,然后使用光学显微镜进行阅片和结果判定。每张切片由2位资深病理专家读片,于400倍视野下随机选取5个不同视野,根据每个高倍镜视野中细胞的染色强度及阳性细胞所占比例进行评分,染色评分值计算为强度染色(0:阴性,1:弱,2:中度,3:强)乘以阳性肿瘤细胞的百分比(1:1%~25%;2:26%~50%;3:51%~75%;4:≥76%),总分≤3分为低表达,3分为高表达。
6.随访:采取门诊复查或电话随访方式进行,随访时间截止至2019年5月,纳入的65例病人均完成5年随访。观察指标为总生存期(overall survival,OS),定义为从明确诊断为结直肠癌开始至因任何原因导致病人死亡的时间。
三、统计学处理
结 果
1.MFAP2在结直肠细胞和组织中的表达:RT-qPCR结果显示,CRC细胞中MFAP2 mRNA的表达水平高于正常结直肠上皮细胞(P< 0.05)(图1A);Western blot结果表明,CRC细胞中MFAP2蛋白的表达水平高于正常细胞(图1B)。我们进一步验证了MFAP2在CRC组织及配对癌旁组织中的表达情况,结果显示MFAP2 mRNA和蛋白在CRC组织中的表达水平均高于癌旁组织(P<0.05)(图1C和1D)。
图1 MFAP2在结直肠细胞和组织中的表达
2.MFAP2蛋白在结直肠癌组织和癌旁组织中的表达:免疫组化检测结果显示,MFAP2蛋白主要定位于细胞质,其在癌旁组织中的表达水平高于癌组织>(图2)。在65例CRC病人中,癌组织中高表达MFAP2蛋白39例,占60%。
3.MFAP2表达与结直肠癌病人临床病理特征的关系见表1。根据免疫组化染色结果,将65例CRC病人分为高表达(39例)和低表达组(26例),分析MFAP2表达水平与临床病理特征的相关性。结果表明,MFAP2蛋白高表达与肿瘤的组织分化程度、浸润深度、淋巴结转移、脉管浸润、神经侵犯及TNM分期显著相关(P<0.05),而与性别、年龄、肿瘤位置、肿瘤大小及术前CEA水平无关(P>0.05)。
4.MFAP2表达与结直肠癌病人预后的关系:所有65例病人均完成随访,死亡34例,占所有病人的52.3%;其中,1、3、5年生存率分别为100%、76.9%、47.7%。Kaplan-Meier生存分析及Log-rank检验结果表明,MFAP2高表达病人的死亡率高于低表达病人,差异有统计学意义(P<0.05)(图3)。进一步的单因素分析结果显示,组织分化程度、浸润深度、淋巴结转移、脉管浸润、神经侵犯、TNM分期和MFAP2高表达是影响CRC病人预后的重要因素(P<0.05)。见表2。将单因素分析有意义的临床病理学因素纳入Cox多因素回归模型,结果显示脉管浸润、TNM分期和MFAP2高表达是CRC病人的独立预后因素(P<0.05)。见表3。
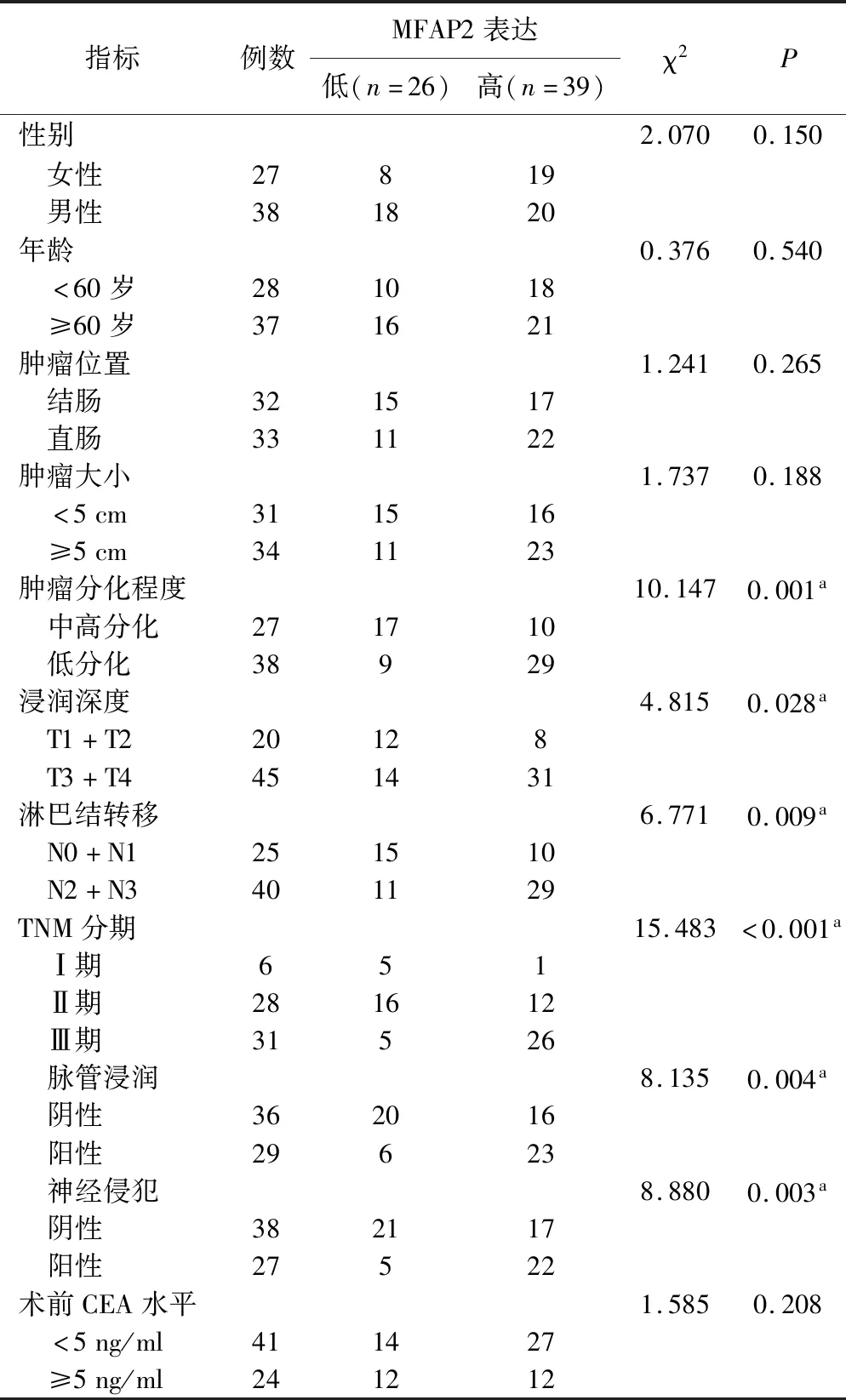
表1 结直肠癌组织中MFAP2表达水平与临床病理特征的关系(65例)
注:aP<0.05
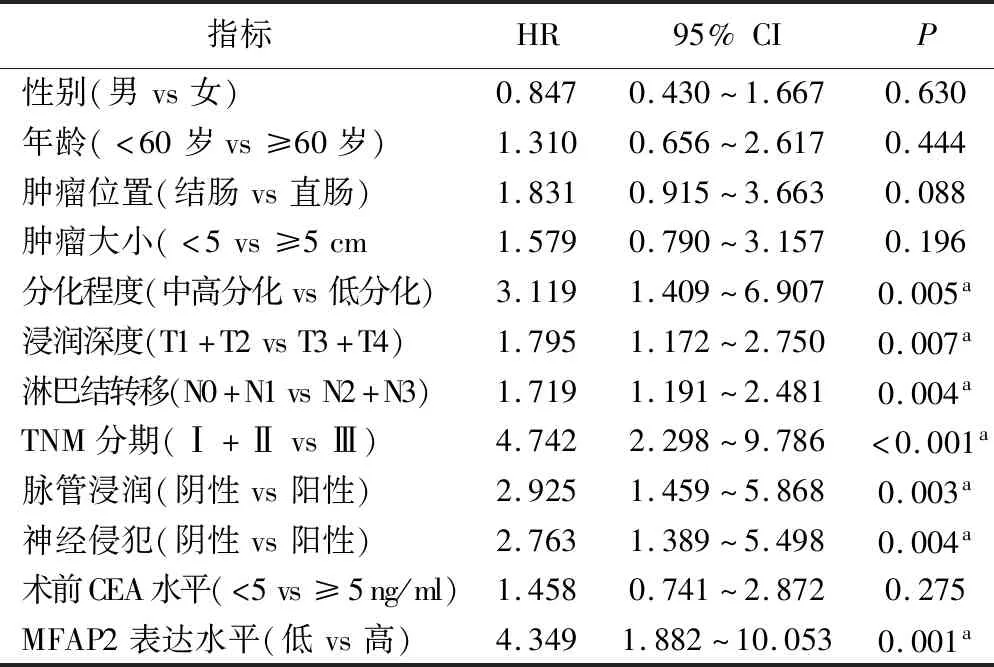
表2 影响CRC病人生存时间的单因素分析
注:aP<0.05
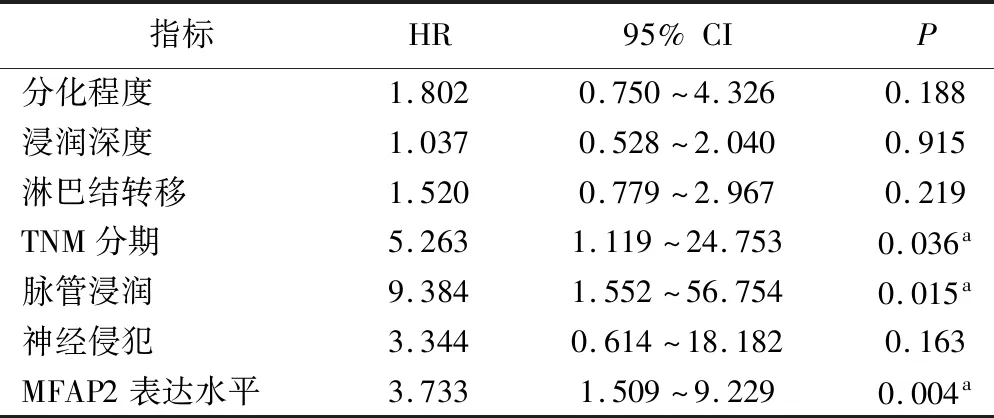
表3 影响CRC病人生存时间的Cox比例风险回归分析
注:aP<0.05
讨 论
随着早期筛查理念的深入和包括手术、放化疗及分子靶向治疗等多种治疗手段的发展,CRC的治疗效果和临床预后已取得明显进步,但病人的5年生存率仍较低[1]。目前,复发和转移仍是导致CRC病人死亡的主要原因[3]。既往研究已证实癌基因的激活在CRC的发生、进展和转移过程中发挥着重要作用[3]。
MFAP2也称为微纤维相关糖蛋白1(MAGP1),是微纤维的主要成分[4]。目前,对MFAP2作用的研究主要集中在其对原弹性蛋白沉积到微纤维上形成弹性纤维过程的调节:Fujita等[8]研究表明,MFAP2参与了人睫状体小脑发育过程中纤维蛋白-1的细胞外沉积中过程;体内研究也发现,MFAP2缺陷的小鼠在受伤后出现血小板数量减少、出血时间延长和颈动脉血栓闭塞延迟,表明其在止血和血栓形成过程发挥重要作用[9]。Silveira等[5]首先通过生物信息学分析表明,MFAP2在头颈部鳞状细胞癌组织中显著上调,尤其是在转移的淋巴结中;Apostolos等研究发现MFAP2是与多发性骨髓瘤中NF-κB/Snail/YY1/RKIP通路最共表达的基因之一,而上述通路在多发性骨髓瘤的发生发展中具有重要作用;Wang等[7]在最近的研究中证实,MFAP2在胃癌组织中过表达,且其过表达与胃癌病人无病生存期和总生存期显著相关。
在本研究中,我们分析了MFAP2在CRC细胞及组织中的表达水平及其与65例CRC病人临床病理学特征和预后的相关性,结果表明,MFAP2在CRC中表达上调,且其上调表达与多种不良临床病理特征显著相关,预示着病人的不良预后,提示MFAP2可能在CRC的发生发展中发挥促癌基因的功能。
当前,越来越多的研究已表明肿瘤细胞的上皮间质转化(Epithelial-mesenchymal transition,EMT)与肿瘤的发生发展和侵袭转移密切相关[10]。在既往的研究中,Wang等[7]研究发现,MFAP2可通过激活TGF-β/SMAD2/3信号传导通路调控胃癌细胞的EMT过程,从而促进细胞的增殖、迁移和侵袭;Zaravinos等[6]发现,多发性骨髓瘤中的MFAP2与NF-κB/Snail/YY1/RKIP通路共表达,NF-κB和Snail作为EMT的核心转录因子,在肿瘤细胞的EMT进程中扮演关键角色[11],提示MFAP2可能在多发性骨髓瘤细胞的EMT调控中具有重要作用。因此,我们推测MFAP2可能通过促进肿瘤细胞的EMT过程,影响肿瘤细胞的多种生物学行为,从而发挥其促癌功能。
MFAP2在CRC中表达上调,且其高表达与病人的不良临床病理特征及不良预后密切相关,有望成为CRC病人预后评估的新标志物和潜在的治疗靶标。

