可溶性程序性死亡受体-1与重症急性胰腺炎并发持续炎症-免疫抑制-分解代谢综合征的相关性分析
方琦 陶京 常剑 朱孔凡 荣愈平 梅佩
目前,重症急性胰腺炎(severe acute pancreatitis,SAP)的诊治水平和救治成功率得到了很大提高,但SAP后期易发严重复杂腹腔感染、肌肉丢失症、ICU获得性衰弱、呼吸机依赖和一般营养支持治疗有效性下降等问题是目前临床治疗的难点,而后期这些感染均与病人的炎症免疫状态尤其是持续炎症-免疫抑制-分解代谢综合征(persistent inflammation immunosuppression catabolism,PICS)有关[1-2]。我们收集我科SAP病例的临床资料,统计其入院后相关临床指标,与绝对淋巴细胞计数(absolute lymphocyte counts,ALCs)和可溶性程序性死亡受体配体1(soluble programmed death-ligand1,sPD-L1)为代表的实验室指标相结合,探讨发生PICS与否的SAP病人免疫抑制程度是否有不同,同时为临床诊断及治疗PICS提供参考。
对象和方法
一、对象
2017年3月~2018年10月收治的成年SAP病人63例,均在24小时内首诊于我科且住院时间>14天,依照PICS诊断标准分为PICS组(23例)和非PICS组(40例)。排除标准:伴严重的基础疾病者,如慢性心衰(NYHAClass IV)、急性心肌梗死(AMI)、Child-Pugh分级C级;不能配合治疗;艾滋病CD4+计数<200 mm3;器官移植受者或长期使用皮质激素或免疫抑制剂;30天内需要化疗或放疗;严重外伤性脑损伤(CT扫描显示神经损伤,GCS <8)和脊髓损伤导致永久性感觉和(或)运动缺陷者;孕妇。SAP诊断标准[3]:参照2012年亚特兰大急性胰腺炎分类国际共识,符合重新修订和完善的急性胰腺炎分类的诊断标准。
PICS诊断标准[2,4]:(1)ICU住院时间>14天;(2)住院期间体重下降>10%或体重指数(BMI)<18kg/m2;(3)同一天或前后间隔不到2天的检查结果同时满足CRP>150 mg/L;ALCs数量<0.8×109/L;血清白蛋白<30 g/L、前白蛋白<100 g/L。
脓毒症休克(sepsis shock)的诊断[5]:参照Sepsis及Sepsis shock 第三次国际共识会议提出的诊断标准,即符合Sepsis诊断的同时,在灌注充足时,伴有血清乳酸>2 mmol/L(18mg/dl),并伴有持续性低血压,需要用升压药维持MAP≥65 mmHg。
院内继发感染的诊断[6-8]:任何可能的或微生物学已确认的细菌、酵母菌、真菌或病毒感染,需要使用抗菌药物治疗,且在住院48小时后发生。在SAP入院48小时内发生的感染并没有被纳入院内继发感染之内。
二、方法
1.临床资料收集:记录病人的性别,年龄,BMI,APACHEⅡ评分,SAP诱因(因本科室绝大多数为胆源性和脂源性的SAP病人,因此本研究仅纳入上述两种诱因的SAP病人),住PICU(胰腺外科重症监护室)时间,总住院时间,继发感染发生情况,Sepsis shock,住院死亡率及出院后半年内的随访情况等。
2.实验室资料收集:包括SAP病人入院24小时、48小时、7天、14天、21天和30天外周血ALCs计数,并留取血清通过ELISA法检测sPD-L1水平。
三、统计学分析
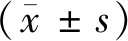
结 果
1.PICS组和非PICS组一般资料比较见表1。两组病人性别、年龄、BMI比较,差异无统计学意义。但PICS组总住院时间、ICU住院时间以及APACHEⅡ评分高于非PICS组,差异有统计学意义(P<0.05)。从病因学角度分析发现胆源性SAP较高脂血症性SAP更容易出现PICS(P<0.05)。本研究对两组病人预后进行随访发现,有6例PICS组病人(26.93%)在住院期间或出院半年内死亡,而非PICS组病人只有2例(5%)(P<0.05)。出院半年后92.5%的非PICS组病人能够继续工作,而PICS组只有47.8%(P<0.05)。
2.SAP病人感染的临床特征见表2。结果表明,入院48小时内感染以肺部感染比例最高,分别为21.74%和7.5%(P<0.05)。PICS组病人全部出现院内继发感染,而非PICS组病人仅有27.5%(P<0.05),并且PICS组病人有3倍以上的概率发生Sepsis shock(Sepsis shock发病住院48小时后)(P<0.05)。
3.免疫抑制的生物学证据比较见表3和表4。结果表明,在最初发病一周内,PICS组和非PICS组ALCs计数、sPD-L1水平无明显差异,但是随着病程发展,在第二周时PICS组与非PICS组ALCs计数和sPD-L1产生明显差异,并在入院第3周,第4周时差异依旧持续存在。
讨 论
PICS病人都会存在持久的免疫抑制[2]。但目前尚无明确实验证据证明发生PICS的SAP病人比未发生者出现更严重的免疫抑制。有学者发现,脓毒血症(Sepsis)继发感染病人的基因组反应与免疫抑制一致[6],因此,本研究将继发感染发生率作为量化SAP病人免疫抑制的临床指标。ALCs的降低与潜在病毒的激活和细菌感染相关[9-11],sPD-L1可以与程序性死亡受体1(programmed cell death-1,PD-1)结合抑制T细胞增殖活化,负向调节免疫功能[12-14]。因此,本研究使用ALCs和sPD-L1作为检测机体免疫功能改变的实验室指标,与临床指标相结合,分析并发PICS的SAP病人是否比未发生PICS的SAP病人的免疫抑制更严重,并指导临床诊断和治疗。
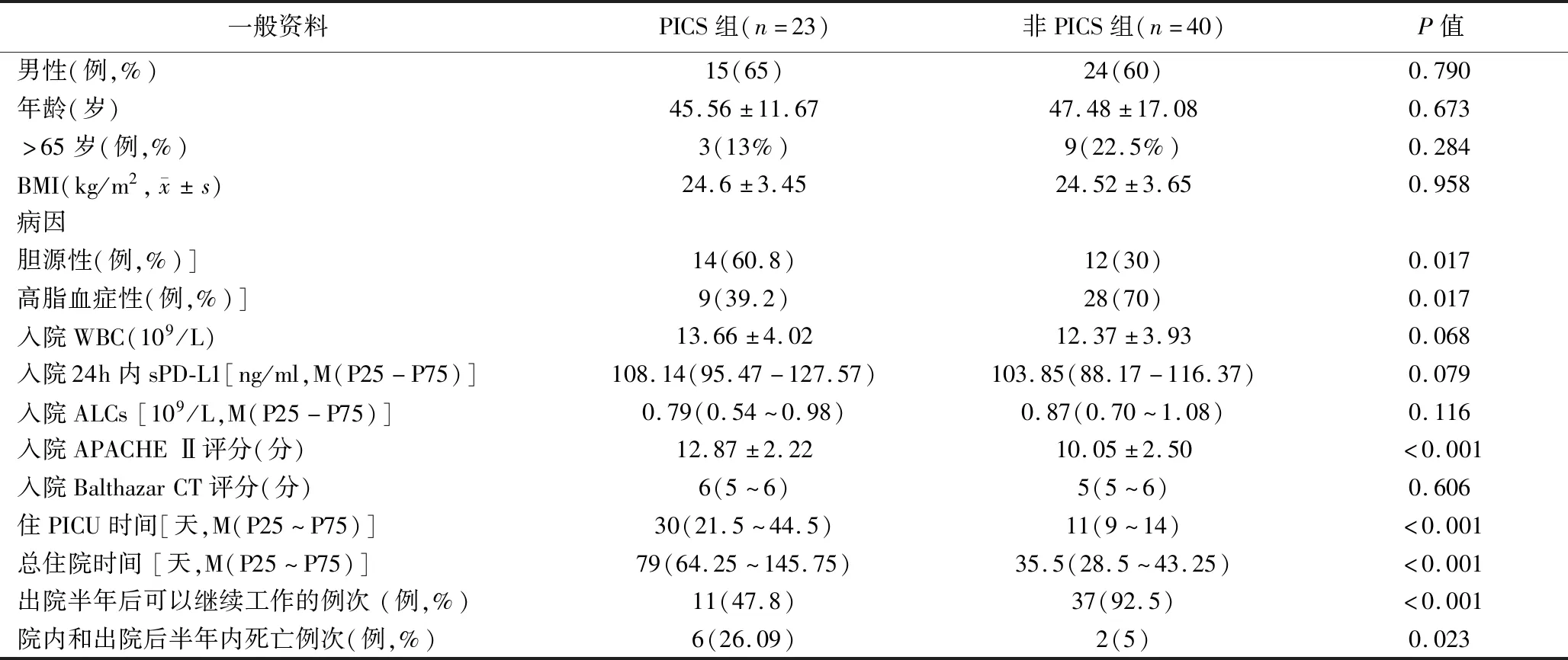
表1 SAP病人入院一般资料和预后的比较

表2 SAP感染的临床特征(例,%)
注:与PICS组比较,aP<0.05
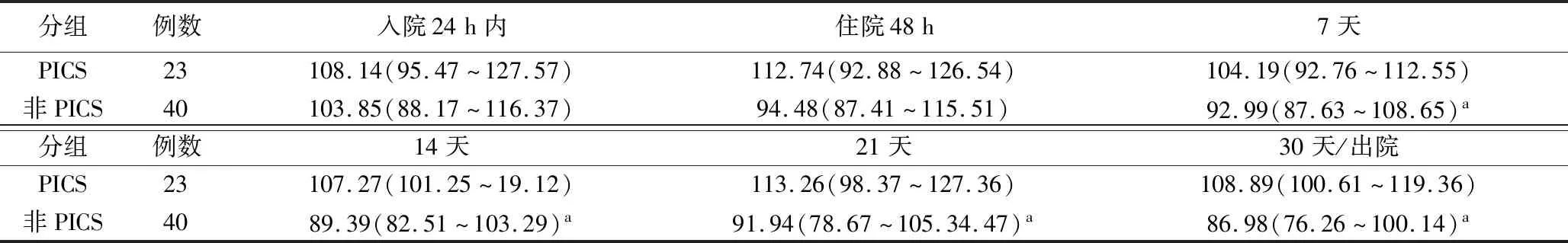
表3 PICS组与非PICS组的sPD-L1比较
注:与PICS组比较,aP<0.05
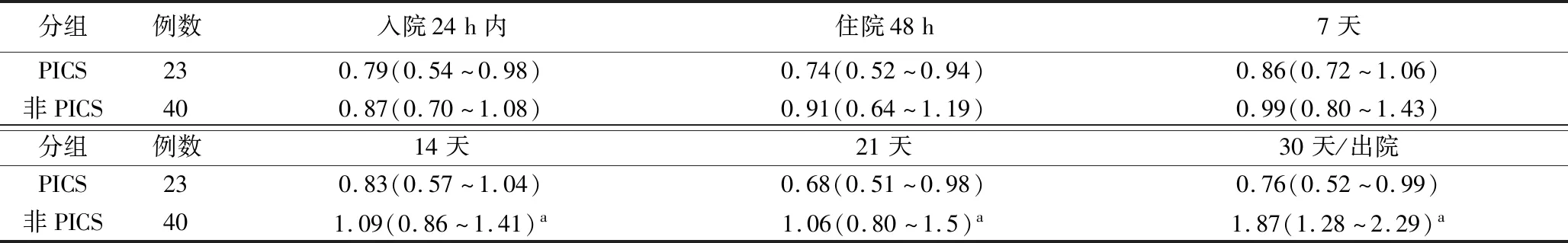
表4 PICS组与非PICS组的ALCs比较
注:与PICS组比较,aP<0.05
大量研究证实:APACHEⅡ评分在反映病人全身情况方面具有良好的敏感性和特异性[15-16]。本研究数据表明,PICS组病人入院时APACHEⅡ评分高于非PICS组病人,这证明在入院24小时内PICS组病人表现出更加严重的内环境紊乱,但并无临床及实验室数据证明入院24小时内PICS组较非PICS组发生更严重的免疫抑制。本研究结果表明,两组病人24小时内的sPD-L1水平和ALCs值差异无统计学意义,亦无法证明在SAP发病早期的免疫抑制更加严重。
但是本研究发现,SAP病人在临床上表现出继发感染易感性增加,有54%的SAP病人出现院内继发感染。其中,PICS组病人全部出现继发感染,而非PICS组仅有27.5%。有大量研究结果表明,PICS病人继发感染易感增加的一个重要原因是长期的免疫功能障碍[17]。本研究还发现,PICS组病人的ALCs和sPD-L1水平将维持更长时间的异常水平,而非PICS组病人则在发病2周后呈逐渐恢复正常的趋势。因此,PICS组病人ALCs和sPD-L1持续异常时间长,继发感染发生率明显增加,其实验室及临床证据都表明PICS组病人免疫功能受到更持久更严重的损伤,并在发病2周后与非PICS组病人存在明显统计学差异。
此外,虽然目前ALCs<0.8×109/L是诊断PICS免疫抑制方面的非常重要的指标[4],但是一般临床所获得的外周血淋巴细胞降低主要是抑制获得性免疫。而PICS的免疫抑制还包括巨噬细胞、单核细胞、树突细胞等在呈递抗原,清除病原体起到重要作用的固有免疫功能的损害[18-20]。目前有关PICS是哪种类型的免疫抑制更为严重尚未清楚,因此,我们认为仅将ALCs作为PICS在免疫抑制方面的唯一诊断指标可能还需要继续完善,那么是补充运用sPD-L1等其他相关分子生物学指标作为诊断PICS的标准之一是否合理,值得进一步的研究和探讨。

